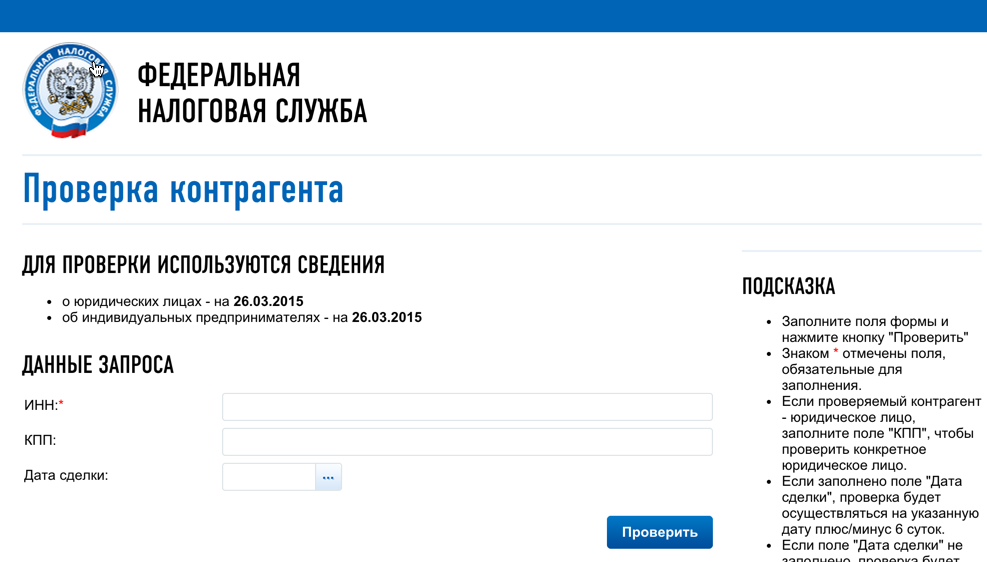
Межрайонная ИФНС России № 22 по Челябинской области
13.10.2021
О порядке заполнения раздела 7 налоговой декларации по налогу на добавленную стоимость
Как для «самозанятого» рассчитывается сумма налога к уплате?
Что такое Личный кабинет налогоплательщика
ПОЛУЧИТЕ КВАЛИФИЦИРОВАННУЮ ЭЛЕКТРОННУЮ ПОДПИСЬ В НАЛОГОВОМ ОРГАНЕ!!!
Срок уплаты имущественных налогов физических лиц (имущество, земля, транспорт) за 2020 год — не позднее 1 декабря 2021 года!!!
Новая промостраница поможет разобраться в направленных гражданам налоговых уведомлениях
Обжаловать ненормативные правовые акты и действия (бездействия) должностных лиц налогового органа теперь можно через портал «Госуслуги» !!!
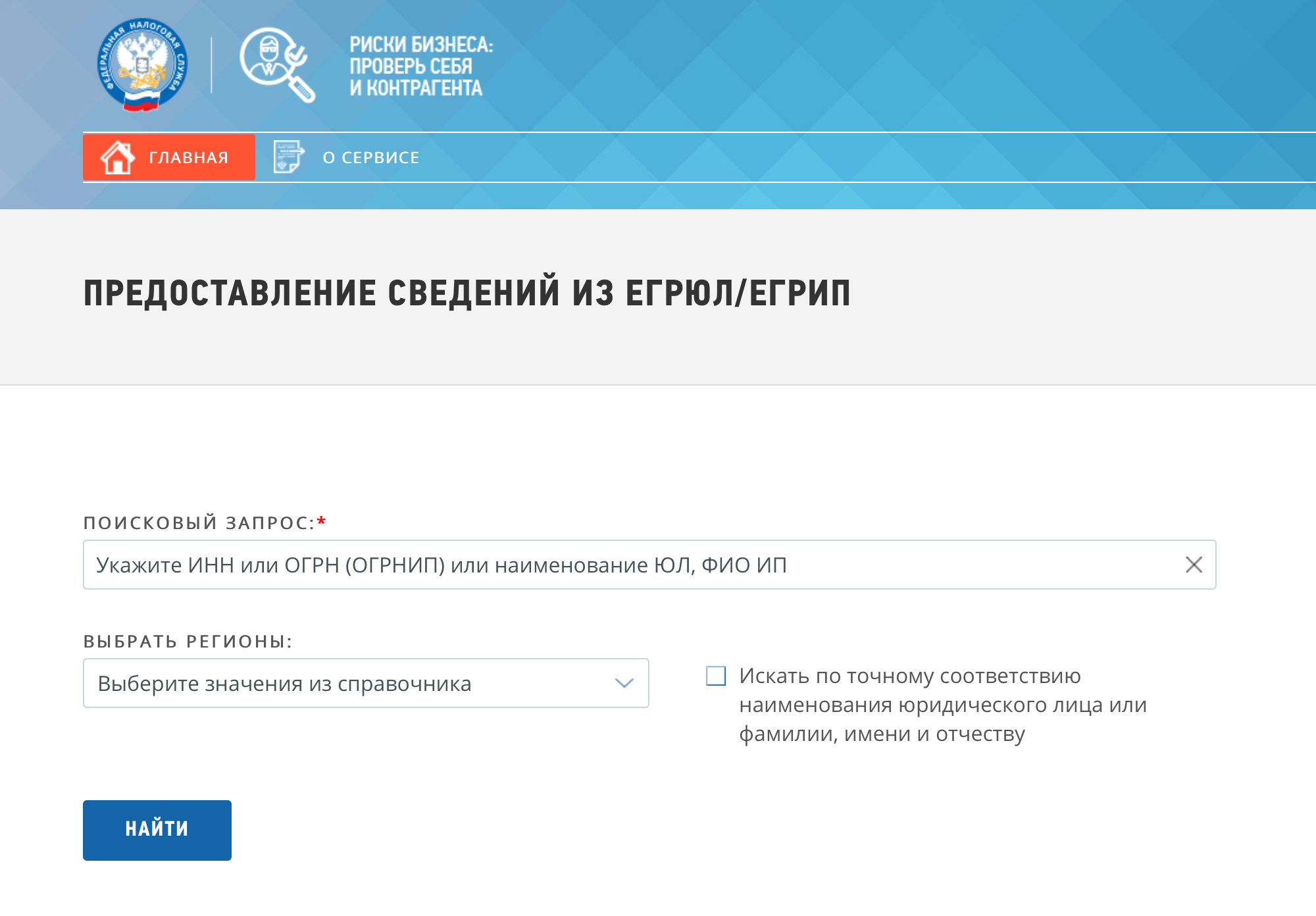
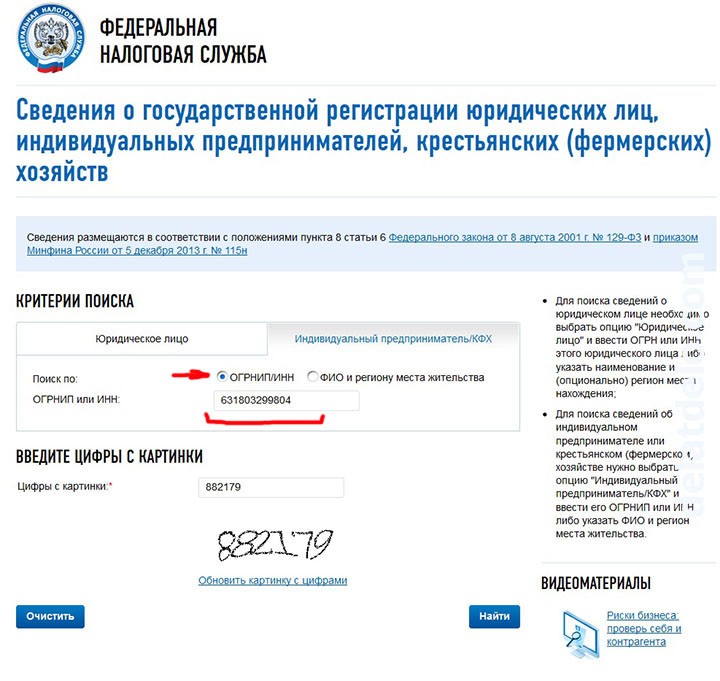
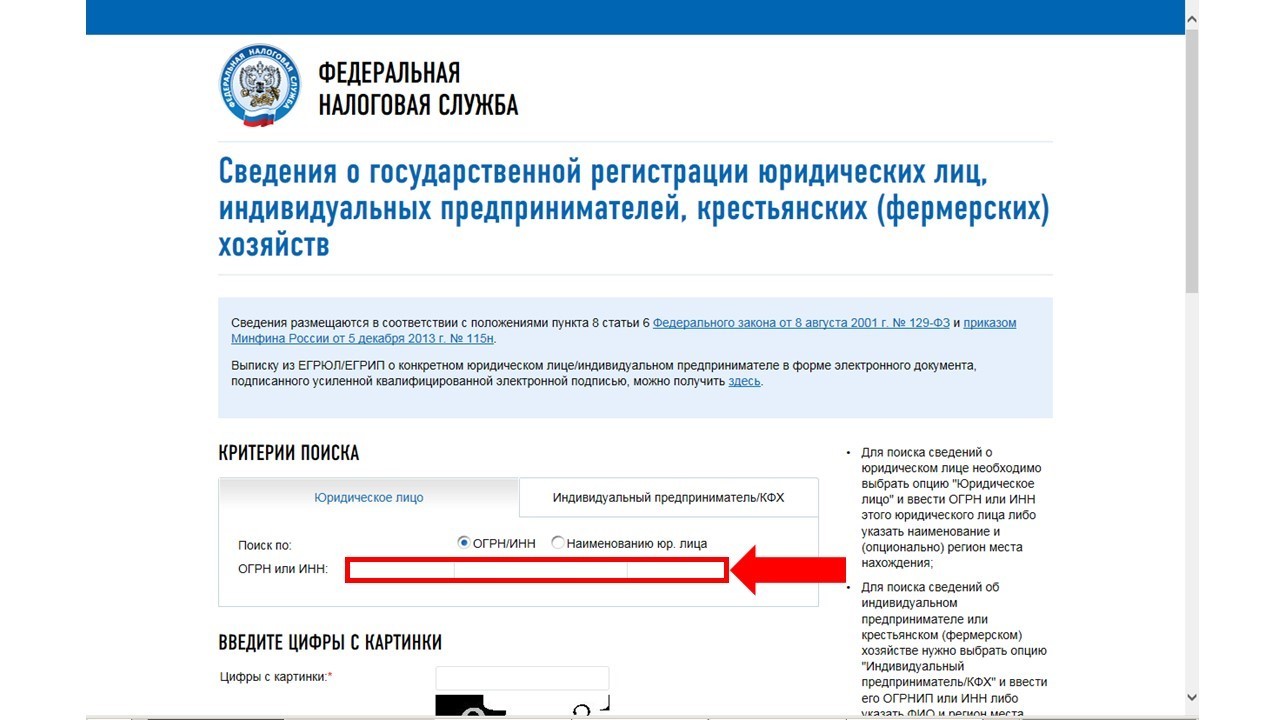
24.09.2021
Перечень государственных услуг ФНС России, предоставляемых в «Многофункциональных центрах предоставления государственных и муниципальных услуг Челябинской области»
22.09.2021
КТО И КАК МОЖЕТ ПОЛУЧИТЬ БЕСПЛАТНУЮ КВАЛИФИЦИРОВАННУЮ ЭЛЕКТРОННУЮ ПОДПИСЬ
20.
Межрайонная ИФНС России № 22 по Челябинской области провела «горячую линию» по вопросам порядка и уплаты имущественных налогов физических лиц за 2020 год
09.09.2021
«Горячая линия» по исчислению и уплате имущественных налогов (имущество, земля, транспорт) физическими лицами за 2020 год
13.08.2021
Порядок направления физическому лицу налогового уведомления об уплате имущественных налогов
12.08.2021
В каких случаях может быть приостановлено рассмотрение жалобы (апелляционной жалобы) по решению вышестоящего налогового органа?
04.08.2021
Перечень государственных услуг ФНС России, предоставляемых в «Многофункциональных центрах предоставления государственных и муниципальных услуг Челябинской области»
02.08.2021
Налогоплательщики — своевременно получайте информацию о задолженности
Есть задолженность по налогам? Оплати прямо сейчас!!!
30.07.2021
Выбираем электронный способ предоставления налоговой отчетности
29. 07.2021
07.2021
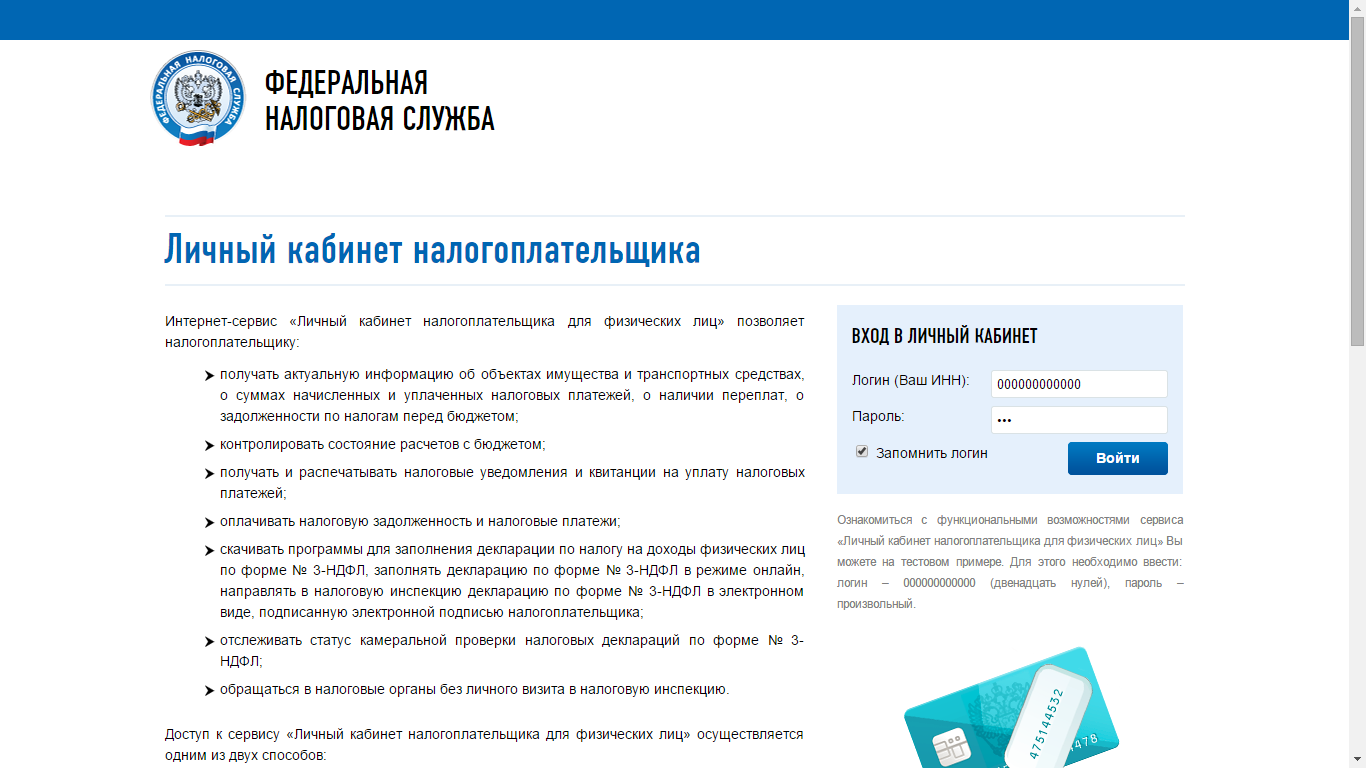
Воспользуйтесь преимуществами электронного сервиса «ЛИЧНЫЙ КАБИНЕТ НАЛОГОПЛАТЕЛЬЩИКА ДЛЯ ФИЗИЧЕСКИХ ЛИЦ» на сайте ФНС России www.nalog.ru
Какими документами подтверждается прекращение существования автомобиля для отмены его налогообложения
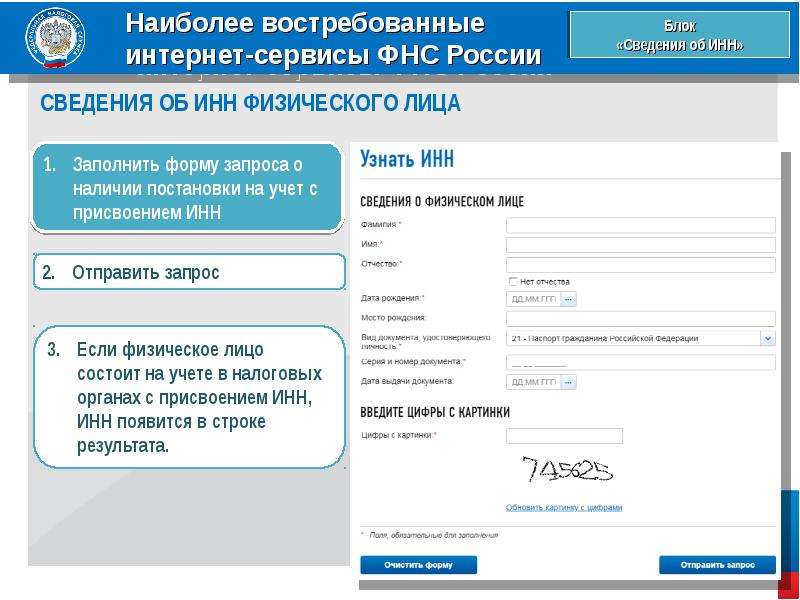
Как встать на учет и получить ИНН
Квитанцией от индивидуальных предпринимателей не стоит подтверждать расходы
Порядок регистрации контрольно-кассовой техники при личном обращении в налоговый орган
Налоговые органы Челябинской области приглашают получить квалифицированную электронную подпись бесплатно
О риске блокировки счета бизнес теперь сможет узнавать в личных кабинетах налогоплательщика
О предоставлении налоговых вычетов по НДФЛ в упрощенном порядке
Как «самозанятый» может получить информацию о полученных доходах и уплаченных налогах?
Какой порядок снятия с налогового учета плательщика налога на профессиональный доход в добровольном порядке?
Выбираем электронный способ предоставления налоговой отчетности
15. 07.2021
07.2021
СРОК УПЛАТЫ НАЛОГА НА ДОХОДЫ ЗА 2020 год — НЕ ПОЗДНЕЕ 15 ИЮЛЯ 2021 года
09.07.2021
Налоговые органы Челябинской области приглашают получить квалифицированную электронную подпись бесплатно
22.06.2021
Студенты 2 курса колледжа посетили налоговую инспекцию
17.06.2021
О применении контрольно-кассовой техники при осуществлении расчетов в Российской Федерации
Возможности электронного сервиса «Личный кабинет налогоплательщика — индивидуального предпринимателя»
Возможности сервиса на сайте ФНС России «Личный кабинет налогоплательщика — организации»
Уменьшение суммы налога, уплачиваемого в связи с применением патентной системой налогообложения (далее – ПСН), на сумму уплаченных индивидуальным предпринимателем (далее — ИП) страховых взносов за своих работников и страховых взносов на обязательное пенсионное страхование и обязательное медицинское страхование в фиксированном размере за себя
В какой налоговый орган индивидуальный предприниматель (далее – ИП) вправе подать уведомление об уменьшении суммы налога, уплачиваемого в связи с применением патентной системой налогообложения (далее – ПСН), на сумму уплаченных страховых платежей (взносов) и пособий
16. 06.2021
06.2021
Перечень государственных услуг ФНС России, предоставляемых в «Многофункциональных центрах предоставления государственных и муниципальных услуг Челябинской области»
26.05.2021
Налогоплательщик в ходе рассмотрения жалобы, до принятия по ней решения, вправе представить дополнительные документы, подтверждающие его доводы
Минимальный предельный срок владения жилыми помещениями, приобретенными по договору долевого участия при продаже исчисляется с даты полной оплаты стоимости такого жилого помещения или доли (долей) в нем
19.05.2021
Образовательная акция «Всероссийский налоговый диктант»: участвуем вместе!
Налоговый орган вправе самостоятельно исчислить налог на доходы физических лиц, в случае, если налоговая декларация не представлена в установленный срок!!!
11.05.2021
С 1 мая 2021 года действуют только новые казначейские счета для уплаты налогов
С 01.01.2021 устанавливаются новые ставки по налогу на доходы физических лиц (НДФЛ)
Освобождение от уплаты налога на имущество физических лиц в отношении имущества, используемого в предпринимательской деятельности
19. 04.2021
04.2021
22 апреля проводится «горячая линия» по декларированию доходов, полученных в 2020 году
13.04.2021
Гражданин, признанный банкротом, может применять специальный налоговый режим «Налог на профессиональный доход»
ПРИБЛИЖАЕТСЯ СРОК ПОДАЧИ ДЕКЛАРАЦИИ О ДОХОДАХ за 2020 ГОД!!!
Возможности электронного сервиса «ЛИЧНЫЙ КАБИНЕТ НАЛОГОПЛАТЕЛЬЩИКА ДЛЯ ФИЗИЧЕСКИХ ЛИЦ» на сайте ФНС России www.nalog.ru
О порядке получения налоговых льгот по имущественным налогам
09.04.2021
13.04.2021 года проводится «горячая линия» по декларированию доходов, полученных в 2020 году
22.03.2021
Граждане до 30 апреля 2021 года должны отчитаться о доходах, полученных в 2020 году
18.03.2021
Предоставление налоговых льгот по имущественным налогам физических лиц (имущество, транспорт, земля)
16.03.2021
Пресс — релиз С 1 января 2021 года началась декларационная кампания по доходам 2020 года!
02.03.2021
17 марта состоится Круглый стол на тему: «с 01 января 2021 года началась декларационная кампания по доходам 2020 года»
24. 02.2021
02.2021
Межрайонная ИФНС России № 22 по Челябинской области провела «горячую линию» по досудебному урегулированию налоговых споров
Кто может уплатить единый налоговый платеж?
19.02.2021
СРОК ПОДАЧИ УВЕДОМЛЕНИЯ О ПЕРЕХОДЕ НА УСН В СВЯЗИ С ОТМЕНОЙ ЕНВД ПРОДЛИЛИ ДО 31 МАРТА 2021 года!!!
Не забудьте представить декларацию о доходах за 2020 год!!!
Исчисление налога на доходы при получении доходов в 2020 году
Налогоплательщики до 30 апреля 2021 года должны отчитаться в Инспекцию о доходах, полученных в 2020 году
08.02.2021
«Горячая линия» 18.02.2021 г. по досудебному урегулированию налоговых споров
27.01.2021
В связи с отменой ЕНВД уведомление на УСН можно подать не позднее 01.02.2021 года
26.01.2021
Об уплате НДФЛ, транспортного, земельного налогов и налога на имущество физических лиц с помощью единого налогового платежа
Индивидуальный предприниматель, применяющий специальный налоговый режим «Налог на профессиональный доход», не вправе применять упрощенную систему налогообложения
Предоставление налогоплательщикам — организациям налоговых льгот по транспортному и земельному налогам
ПОРЯДОК ОБЛОЖЕНИЯ НАЛОГОМ НА ДОХОДЫ ФИЗИЧЕСКИХ ЛИЦ ПРОЦЕНТОВ, ПОЛУЧЕННЫХ ПО ВКЛАДАМ В БАНКАХ
Межрайонная ИФНС России № 22 по Челябинской области провела «горячую линию» по порядку применению патентной системы налогообложения
Изменения по сдаче налоговой и бухгалтерской отчетности с января 2021 года
Памятка по уплате страховых взносов за себя для граждан, принявших решение зарегистрироваться в качестве индивидуального предпринимателя
РЕКВИЗИТЫ ИНСПЕКЦИИИ ДЛЯ ОПЛАТЫ ФИКСИРОВАННЫХ СТРАХОВЫХ ВЗНОСОВ
Способы предоставления декларации (форма 3-НДФЛ)
Сроки проведения камеральной налоговой проверки и возврата излишне перечисленного налога на доходы
23. 12.2020
12.2020
ИНФОРМАЦИЯ ДЛЯ НАЛОГОПЛАТЕЛЬЩИКОВ ОБ ОТМЕНЕ ЕНВД И ВЫБОРЕ СИСТЕМЫ НАЛОГООБЛОЖЕНИЯ С 01.01.2021г.
30.11.2020
О специальном налоговом режиме «Налог на профессиональный доход» (далее – НПД) и порядке уплаты НПД.
24.11.2020
Межрайонная ИФНС России № 22 по Челябинской области провела 18.11.2020 года «горячую линию» по уплате имущественных налогов за 2019 год
Изменения в порядке применения ККТ для отдельных категорий налогоплательщиков и утрата актуальности системы налогообложения
Как физическому лицу уплатить налог без налогового уведомления
Система налогообложения ЕНВД отменяется с 01.01.2021 г.
С 1 января 2021 года годовая бухгалтерская (финансовая) отчетность представляется в налоговые органы только в электронном виде!!!
Отсутствие на Справке о состоянии расчетов по налогам, сборам, страховым взносам, пеням, штрафам, процентам в соответствии с Приказом ФНС России от 28 июля 2020 г. N ЕД-7-19/477@ подписи руководителя (заместителя руководителя)
17. 11.2020
11.2020
«Горячая линия» по исчислению и уплате имущественных налогов физическими лицами за 2019 год
06.11.2020
Жалобу в налоговый орган можно направить в электронном виде!
ПЕНСИОНЕР — САМОЗАНЯТЫЙ ГРАЖДАНИН!
23.09.2020
Межрайонная ИФНС России № 22 по Челябинской области провела «горячую линию» по уплате имущественных налогов за 2019 год
Что делать, если не получено налоговое уведомление?
НПД не применяется при сдаче в аренду нежилого помещения
Новая промостраница поможет разобраться в направленных физическим лицам налоговых уведомлениях
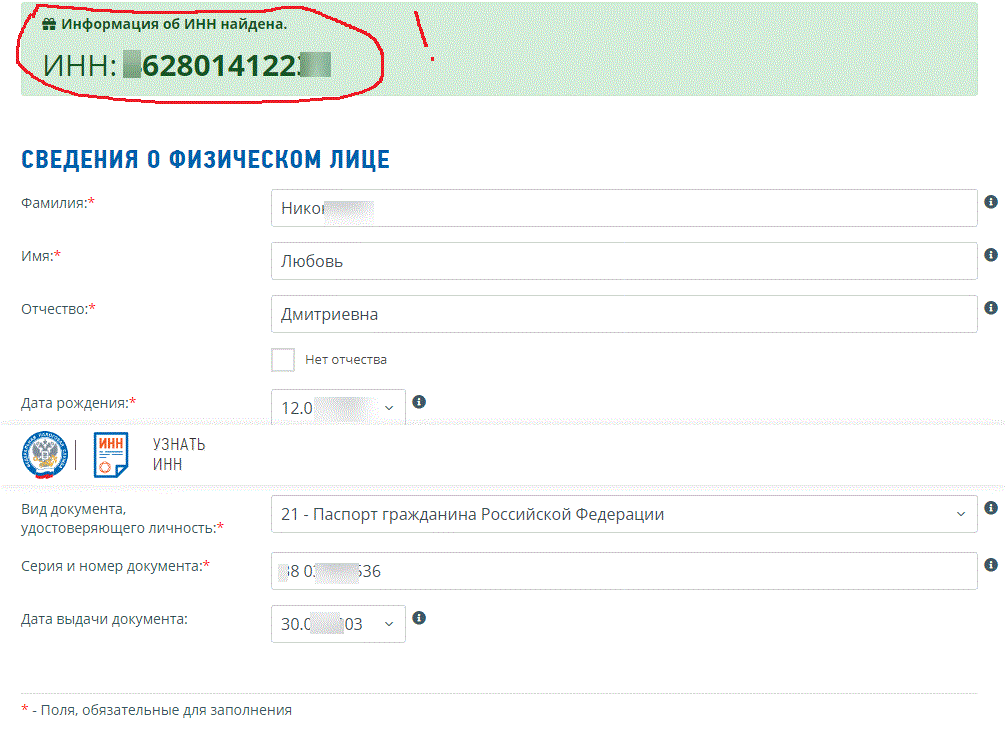
ИНН теперь можно получить в Личном кабинете налогоплательщика
Единый налоговый платеж упрощает физическим лицам уплату имущественных налогов (налог на имущество, земельный и транспортный налог)
Где можно получить сводное налоговое уведомление
ВОЗМОЖНОСТИ ЛИЧНОГО КАБИНЕТА НАЛОГОПЛАТЕЛЬЩИКА ДЛЯ ФИЗИЧЕСКИХ ЛИЦ
21.09.2020
Межрайонной ИФНС России № 22 по Челябинской области проведена «горячая линия» по переходу на иные режимы налогообложения в связи с отменой ЕНВД с 01 января 2021 года
Налоговый орган не позднее 30 дней до наступления срока платежа по налогам обязан направить налогоплательщику налоговое уведомление
Перечень государственных услуг ФНС России, предоставляемых в «Многофункциональных центрах предоставления государственных и муниципальных услуг Челябинской области»
Срок уплаты имущественных налогов за 2019 год
02. 09.2020
09.2020
Электронный документооборот
Федеральной налоговой службой усовершенствован порядок направления жалоб в электронном виде по ТКС !!!
Снятие с налогового учета плательщика налога на профессиональный доход (далее – НПД)
Перечень государственных услуг ФНС России, предоставляемых в «Многофункциональных центрах предоставления государственных и муниципальных услуг Челябинской области»
В личном кабинете налогоплательщика для физических лиц появились новые разделы и функции
01.08.2020
Межрайонная ИФНС России №22 по Челябинской области информирует о проведении 22 сентября 2020 года с 14:00 – 18:00 «горячей линии» по исчислению и уплате имущественных налогов (имущество, земля, транспорт) физическими лицами за 2019 год
07.08.2020
ПРЕИМУЩЕСТВА СПЕЦИАЛЬНОГО НАЛОГОВОГО РЕЖИМА «НАЛОГ НА ПРОФЕССИОНАЛЬНЫЙ ДОХОД»
29.07.2020
Как выдавать платежные документы (чек) и платить налог на профессиональный доход?
Как зарегистрироваться в качестве «самозанятого» налогоплательщика налога на профессиональный доход через мобильное приложение «Мой налог»?
Чат-бот Таксик поможет разобраться с налогами физических лиц!!!
13. 07.2020
07.2020
Ознакомьтесь с возможностями электронного сервиса «ЛИЧНЫЙ КАБИНЕТ ИНДИВИДУАЛЬНЫЕ ПРЕДПРИНИМАТЕЛИ»
Машиночитаемые бланки с двухмерным штрих — кодом для заполнения налоговой отчетности – новые технологии в сфере бумажного документооборота
Личный кабинет налогоплательщика — юридического лица
09.07.2020
СРОК УПЛАТЫ НАЛОГА НА ДОХОДЫ ЗА 2019 год — НЕ ПОЗДНЕЕ 15 ИЮЛЯ 2020 года
При продаже единственного жилья минимальный срок владения объектом недвижимого имущества для определения имущественного вычета составляет 3 года!
Об отмене ЕНВД с 01.01.2021 и переходе на иные специальные налоговые режимы
ФНС России разработала новый сервис «Налоговый калькулятор – Какой режим подходит моему бизнесу»
Воспользуйтесь шаблонами при заполнении налоговой декларации о доходах по форме 3-НДФЛ в онлайн-режиме посредством интерактивного сервиса «Личный кабинет налогоплательщика для физических лиц»
20.05.2020
Проверка права на получение субсидии субъектом МСП, ведущим деятельность в пострадавших отраслях
Проверка возможности получения отсрочки/рассрочки в связи с связи с GOVID — 19 субъектами МСП, ведущим деятельность в пострадавших отраслях
Прием в МФЦ налоговых документов по имущественным налогам физических лиц
Предоставляем декларацию о доходах в электронном виде
ПРЕДОСТАВЛЕНИЕ ЗАЯВЛЕНИЯ НА НАЛОГОВЫЕ ЛЬГОТЫ ПО ИМУЩЕСТВЕННЫМ НАЛОГАМ
Пониженные тарифы страховых взносов
Поддержка медперсоналу, малому и среднему бизнесу
О предоставлении физическим лицам, применяющим налог на профессиональный доход (далее – НПД), налоговых вычетов по налогу на доходы физических лиц
О предоставлении организациям и индивидуальным предпринимателям налоговой льготы по транспортному налогу
Направление заявления о прекращении деятельности в качестве индивидуального предпринимателя в электронном виде!
Машиночитаемые бланки с двухмерным штрих — кодом для заполнения налоговой отчетности – новые технологии в сфере бумажного документооборота
Личный кабинет для физических лиц
«Личный кабинет налогоплательщика — юридического лица»
Ознакомьтесь с возможностями электронного сервиса «ЛИЧНЫЙ КАБИНЕТ ИНДИВИДУАЛЬНЫЕ ПРЕДПРИНИМАТЕЛИ» на сайте ФНС России www. nalog.ru
nalog.ru
29.04.2020
29 апреля Вебинар Торгово-промышленной палаты и ФНС России
27.04.2020
Межрайонной ИФНС России № 22 по Челябинской области проведена «горячая линия» по доходам, полученным в 2019 году
Продление сроков представления деклараций и сроков уплаты налогов (взносов) в соответствии с Постановлением Правительства РФ №409 от 02.04.2020
16.04.2020
Декларационная кампания по доходам 2019 года!
Декларация по форме 3-НДФЛ отправляем через Личный кабинет
ФНС России рекомендует взаимодействовать с налоговыми органами в электронном виде
Порядок возврата налога на доходы физических лиц
Порядок предоставления расчетов по страховым взносам
Правительство России перенесло сроки уплаты налогов и сдачи налоговой отчетности
Декларационная кампания по доходам физических лиц полученных в 2019 году продлится до 30 июля
17.02.2020
Пресс — релиз КС изменения налогового законодательства
Основные изменения налогового законодательства с 2020 года!!!
Межрайонной ИФНС России № 22 по Челябинской области приняла участие в обсуждении нового специального налогового режима
06. 02.2020
02.2020
Не копите долги!!! Оплачивайте налоги вовремя!!!
10.12.2019
Налоговая отчетность по страховым взносам, по форме 2-НДФЛ и 6-НДФЛ при условии численности работников свыше 10 человек подлежит представлению налоговым агентом в электронном виде!
ПОЛУЧИТЬ ВЫЧЕТ ТЕПЕРЬ МОЖНО ЗА ЛЮБОЕ ЛЕКАРСТВО ПО РЕЦЕПТУ ВРАЧА
22.11.2019
Федеральная Налоговая Служба утвердила для организаций форму заявления о льготах по транспортному и земельному налогах
Собственники недвижимости и транспорта обязаны не позднее 2 декабря 2019 года уплатить имущественные налоги за 2018год!!!
О снятии с учета в качестве налогоплательщика ЕНВД, в случае приостановления деятельности
14.11.2019
Инспекция провела «горячую» линию по порядку и уплате имущественных налогов за 2018 год
За какие налоговые периоды можно уменьшить сумму исчисленного налога ЕНВД при приобретении ККТ
Внесены важные изменения в Федеральный закон от 06.12.2011 №402-ФЗ «О бухгалтерском учете»
Разобраться в налоговых уведомлениях поможет промостраница «Налоговое уведомление 2019»
Студенты 2 курса колледжа посетили налоговую инспекцию
Утверждена новая форма декларации по форме 3-НДФЛ за 2019 год
06. 11.2019
11.2019
«Горячая линия» по исчислению и уплате имущественных налогов (имущество, земля, транспорт) физическими лицами за 2018 год
01.11.2019
Налоговики подвели итоги «Дней открытых дверей» по информированию физических лиц по вопросам исполнения налоговых уведомлений и системы оценки качества обслуживания в территориальных налоговых органах
18.10.2019
Государственный информационный ресурс бухгалтерской (финансовой) отчетности
Внесены важные изменения в Федеральный закон от 06.12.2011 №402-ФЗ «О бухгалтерском учете»
17.10.2019
Зачем нужен Личный кабинет налогоплательщика?
ТРЕТИЙ ЭТАП ДОБРОВОЛЬНОГО ДЕКЛАРИРОВАНИЯ СЧЕТОВ И АКТИВОВ
Налоговое уведомление теперь можно получить в многофункциональных центрах
16.10.2019
Межрайонная ИФНС России №22 по Челябинской области сообщает о проведении 18.10.2019 года в 10:00 час по адресу: г. Челябинск, Часовая ,6, каб. 109 «Круглого стола» на тему: «Государственный информационный ресурс бухгалтерской (финансовой) отчетности». Ждем ВАС!!!
Ждем ВАС!!!
26.09.2019
Школьникам рассказали о налогах!
Срок уплаты имущественных налогов за 2018 год – 02.12.2019 года!
24.09.2019
Налоговая служба проводит ДНИ ОТКРЫТЫХ ДВЕРЕЙ
Срок уплаты имущественных налогов физических лиц за 2018 год — 2 декабря 2019 года
Перечень государственных услуг, предоставляемых в соответствии с Соглашением о взаимодействии между областным государственным казенным учреждением «Многофункциональный центр предоставления государственных и муниципальных услуг Челябинской области» и Управлением Федеральной налоговой службы по Челябинской области
19.09.2019
Что делать, если налоговое уведомление не получено?
Сервисы «Проверка ИНН, ФИО, СНИЛС работающих лиц»
Погасите задолженность по налогам!!!
Основные изменения по транспортному налогу с 2019 года
Основные изменения по земельному налогу с 2019 года
О предоставлении бухгалтерской отчетности в электронном виде
Налоговый орган не позднее 30 дней до наступления срока платежа по налогам обязан направить налогоплательщику налоговое уведомление.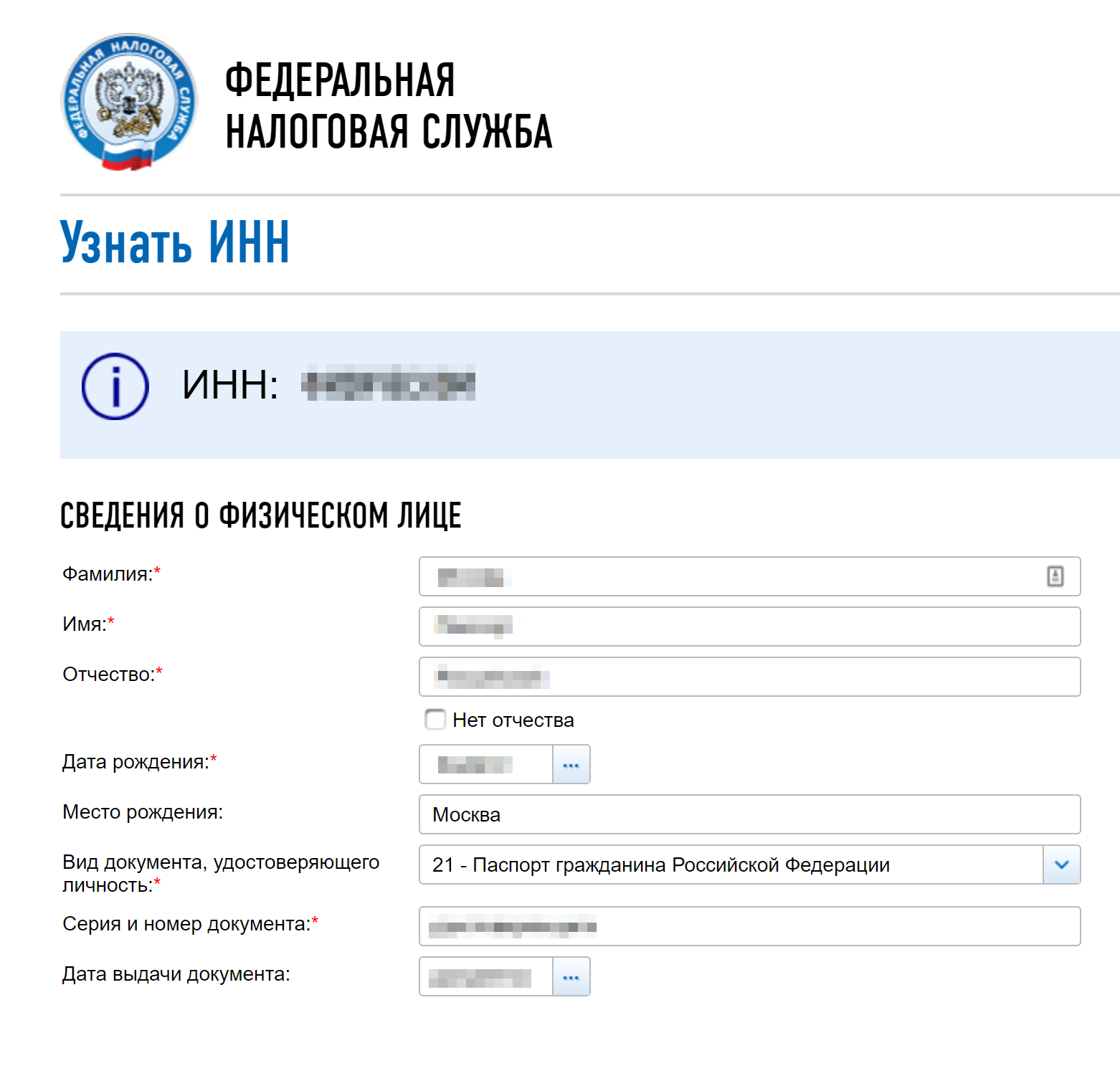
Где можно получить сводное налоговое уведомление?
17.09.2019
Круглый стол 25.09.2019 года в 10:00 час по адресу: г. Челябинск, Часовая, 6, каб. 109 на тему: «Началась кампания по уплате имущественных налогов за 2018 год».
16.09.2019
Инспекция поздравила воспитанников детского дома с Днем знаний!
29.08.2019
Выписку по сведениям из ЕГРЮЛ и ЕГРИП можно получить в электронном виде
Пользователи, в работе контрольно-кассовой техники которых произошел сбой, вправе осуществлять расчеты без применения контрольно-кассовой техники в связи с отсутствием вины.
16.08.2019
Как присваивается ИНН и используется налоговым органом
Должен ли вышестоящий налоговый орган устанавливать и применять смягчающие ответственность обстоятельства, если налогоплательщик не заявлял в жалобе о снижении размера взыскиваемого штрафа в связи с их наличием?
Внимание налогоплательщикам – физическим лицам! Срок уплаты по налогам, уплачиваемым физическими лицами за 2018 год (налог на имущество, транспортный налог, земельный налог) не позднее 02 декабря 2019 года
Уменьшение индивидуальными предпринимателями налога на суммы уплаченных страховых взносов при разных системах налогообложения
Физические лица обязаны уведомлять налоговые органы о счетах и вкладах за пределами России 2019
21. 06.2019
06.2019
Перечень государственных услуг ФНС России, предоставляемых в «Многофункциональных центрах предоставления государственных и муниципальных услуг Челябинской области»
СРОК УПЛАТЫ НАЛОГА НА ДОХОДЫ ФИЗИЧЕСКИХ ЛИЦ ЗА 2018 год
Направляем налоговую, бухгалтерскую отчетность и документы по ТКС!
Плакат Встречай лето без долгов
Двухмерное штрихкодирование данных налоговой и бухгалтерской отчетности
График тематических семинаров на 3 квартал 2019 года
График работы по информированию ККТ
17.06.2019
С 2019 года налогоплательщики – физические лица могут уплачивать налог на имущество, транспортный и земельный налоги при помощи единого налогового платежа
О предоставлении сообщения о наличии объектов недвижимого имущества и (или) транспортных средств, признаваемых объектами налогообложения по соответствующим налогам, уплачиваемым физическими лицами
В отпуск без долгов!!!
13.06.2019
Межрайонная ИФНС России № 22 по Челябинской области сообщает о проведении Федеральной налоговой службой информационной кампании – «Отпуск без долгов»
Воспитанники подшефного Детского дома отметили День защиты детей
20. 05.2019
05.2019
Электронный сервис «Личный кабинет для юридических лиц» на сайте www.nalog.ru
Налог на имущество с 2019 года российские организации уплачивают только в отношении недвижимого имущества
С 01 июля 2019 года перейти на новый порядок применения контрольно-кассовой техники (далее – ККТ) обязаны все налогоплательщики, которым ранее была предоставлена отсрочка применения ККТ
Социальный налоговый вычет на лечение ребенка
Сумма земельного налога для физических лиц за 2018 год может быть увеличена не более чем на 10 процентов!
06.05.2019
Межрайонной ИФНС России № 22 по Челябинской области (далее – Инспекция) 30 апреля 2019 года проведена ознакомительная экскурсия для студентов 2 курса «Южно-Уральского многопрофильного колледжа»
30.04.2019
Межрайонной ИФНС России № 22 по Челябинской области проведена «горячая линия» по доходам, полученным в 2018 году
26.04.2019
С 2019 года отменен вычет по транспортному налогу по ПЛАТОНу
О необходимости применения контрольно-кассовой техники с 01. 07.2019
07.2019
12.04.2019
22.04.2019г. проводится «Горячая линия» по декларированию доходов, полученных в 2018 году
10.04.2019
СРОК УПЛАТЫ НАЛОГА НА ДОХОДЫ ФИЗИЧЕСКИХ ЛИЦ ЗА 2018 год
Дополнительные налоговые вычеты по имущественным налогам многодетным семьям
01.04.2019
В апреле налоговые инспекции Челябинской области проведут «Дни открытых дверей для граждан, декларирующих доходы»
22.03.2019
Менять свидетельство о постановке на учет (ИНН) при изменении места жительства не надо!
Новая льгота по транспортному налогу для физических лиц
Вправе ли организация обжаловать решение налогового органа в суд, если вышестоящий налоговый орган не рассмотрел ее жалобу по причине отсутствия в ней подписи представителя организации
21.03.2019
НОВЫЙ ВИД НАЛОГОВОГО ПЛАТЕЖА ДЛЯ ФИЗИЧЕСКИХ ЛИЦ
НАЛОГ НА ПРОФЕССИОНАЛЬНЫЙ ДОХОД
Коэффициенты-дефляторы на 2019 год
Граждане не позднее 30 апреля 2019 года должны отчитаться о доходах, полученных в 2018 году
Ознакомьтесь с возможностями электронного сервиса «ЛИЧНЫЙ КАБИНЕТ ИНДИВИДУАЛЬНЫЕ ПРЕДПРИНИМАТЕЛИ» на сайте ФНС России www.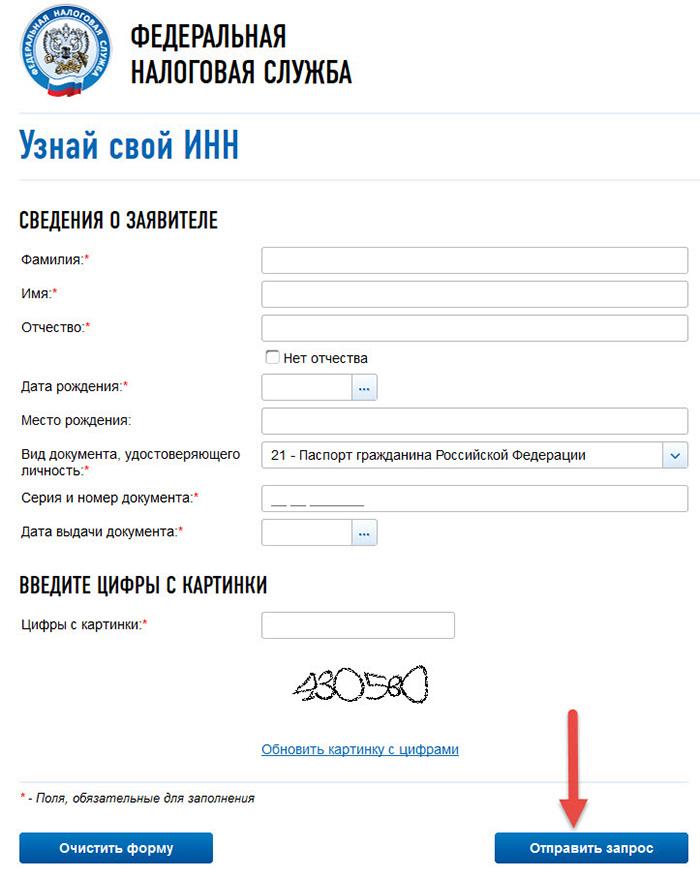 nalog.ru
nalog.ru
05.03.2019
С 01 января 2019 года началась декларационная кампания по доходам 2018 года
УВАЖАЕМЫЕ НАЛОГОПЛАТЕЛЬЩИКИ! Налоговая служба проводит ДНИ ОТКРЫТЫХ ДВЕРЕЙ для физических лиц по информированию о налоговом законодательстве и порядке заполнения налоговых деклараций по налогу на доходы физических лиц!
Студенты медицинского колледжа вновь посетили налоговую инспекцию!
04.03.2019
Межрайонная ИФНС России №22 по Челябинской области сообщает о проведении 07.03.2019 года круглого стола
12.02.2019
С 1 марта 2018 года по 28 февраля 2019 года можно сообщить о своих зарубежных активах и счетах в любую налоговую инспекцию или в ФНС России
Задолженность по имущественным налогам за 2017 год снижается
29.01.2019
Пост-Релиз по результатам проведения информационной кампании «Новый год без долгов»
25.01.2019
Не забудьте представить декларацию о доходах за 2018 год!!!
Способы предоставления декларации (форма 3-НДФЛ)
Заявление на льготу по имущественным налогам (имущество, транспорт, земля) носит заявительный характер
Срок подачи заявления на льготу по имущественным налогам (имущество, транспорт, земля) – 01.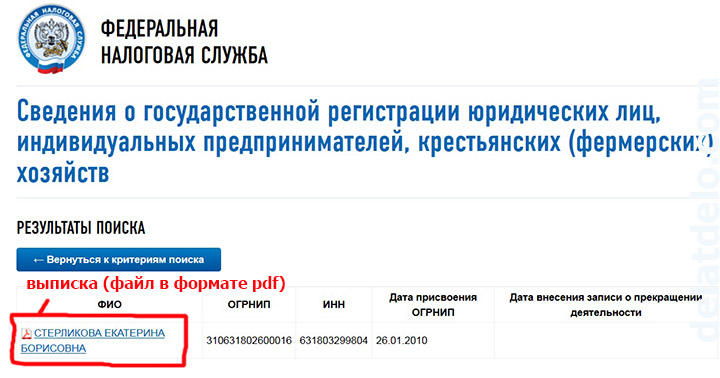 04.2019 года
04.2019 года
Сроки проведения камеральной налоговой проверки и возврата излишне перечисленного налога на доходы
11.01.2019
Для физических лиц, имеющих задолженность по имущественным налогам (налог на имущество физических лиц, транспортных налог, земельный налог)!
Архив новостей
ИФНС
// ИФНС
15.10.2021
Что делать, если в налоговом уведомлении некорректная информация Ответственность за достоверность, полноту и актуальность указанных сведений, используемых в целях налогообложения имущества, несут вышеперечисленные регистрирующие органы.
// ИФНС
15.10.2021
Как проверить налоговые ставки и льготы, указанные в налоговом уведомлении С информацией о налоговых ставках, налоговых льготах и налоговых вычетах можно ознакомиться в рубрике «Справочная информация о ставках и льготах по имущественным налогам» .
// ИФНС
15. 10.2021
10.2021
Что такое налоговое уведомление и как его исполнить Обязанность по ежегодному исчислению для налогоплательщиков-физических лиц транспортного налога, земельного налога, налога на имущество физических лиц возложена на налоговые органы (статья 52 Налогового кодекса Российской Федерации).
// ИФНС
15.10.2021
Столичное Управление проводит онлайн-опрос С 15 октября по 15 ноября 2021 года УФНС России по г.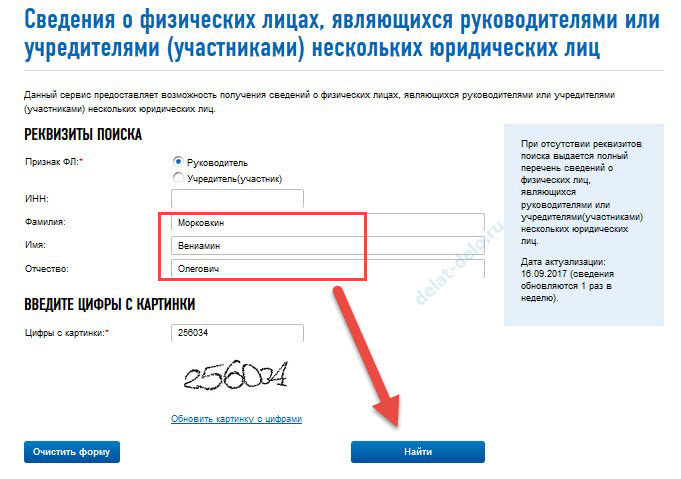 Москве проводит онлайн – опрос по вопросу эффективности деятельности подразделений по профилактике коррупционных и иных правонарушений.
Москве проводит онлайн – опрос по вопросу эффективности деятельности подразделений по профилактике коррупционных и иных правонарушений.
// ИФНС
28.09.2021
План проведения ИФНС России № 24 по г. Москве вебинаров с налогоплательщиками на IV квартал 2021 года
// ИФНС
23. 07.2021
07.2021
Получение квалифицированного сертификата ключа проверки электронной подписи Услуга по выдаче квалифицированного сертификата будет предоставляться в территориальных налоговых органах.
// ИФНС
28.04.2021
Получить свидетельство о постановке на учет (ИНН) можно уже на следующий рабочий день С 22 марта 2021 года пользователям сервиса «Постановка физического лица на учет в налоговом органе на территории Российской Федерации»
на сайте ФНС России www. nalog.gov.ru предоставлена возможность посещения налогового органа с целью постановки на учет и получения соответствующего свидетельства уже на следующий рабочий день после отправки заявки с помощью данного сервиса.
nalog.gov.ru предоставлена возможность посещения налогового органа с целью постановки на учет и получения соответствующего свидетельства уже на следующий рабочий день после отправки заявки с помощью данного сервиса.
// ИФНС
14.04.2021
В Управлении пройдет онлайн-вебинар для налогоплательщиков 21 апреля 2021 года УФНС России по г. Москве проведет вебинар по теме: «Декларационная кампания 2021 года».
// ИФНС
19. 03.2021
03.2021
В Управлении пройдет онлайн-вебинар для организаций и индивидуальных предпринимателей
25 марта 2021 года УФНС России по г. Москве проведет вебинар для организаций и индивидуальных предпринимателей.
// ИФНС
12.03.2021
В Управлении пройдет онлайн-вебинар для налогоплательщиков 22.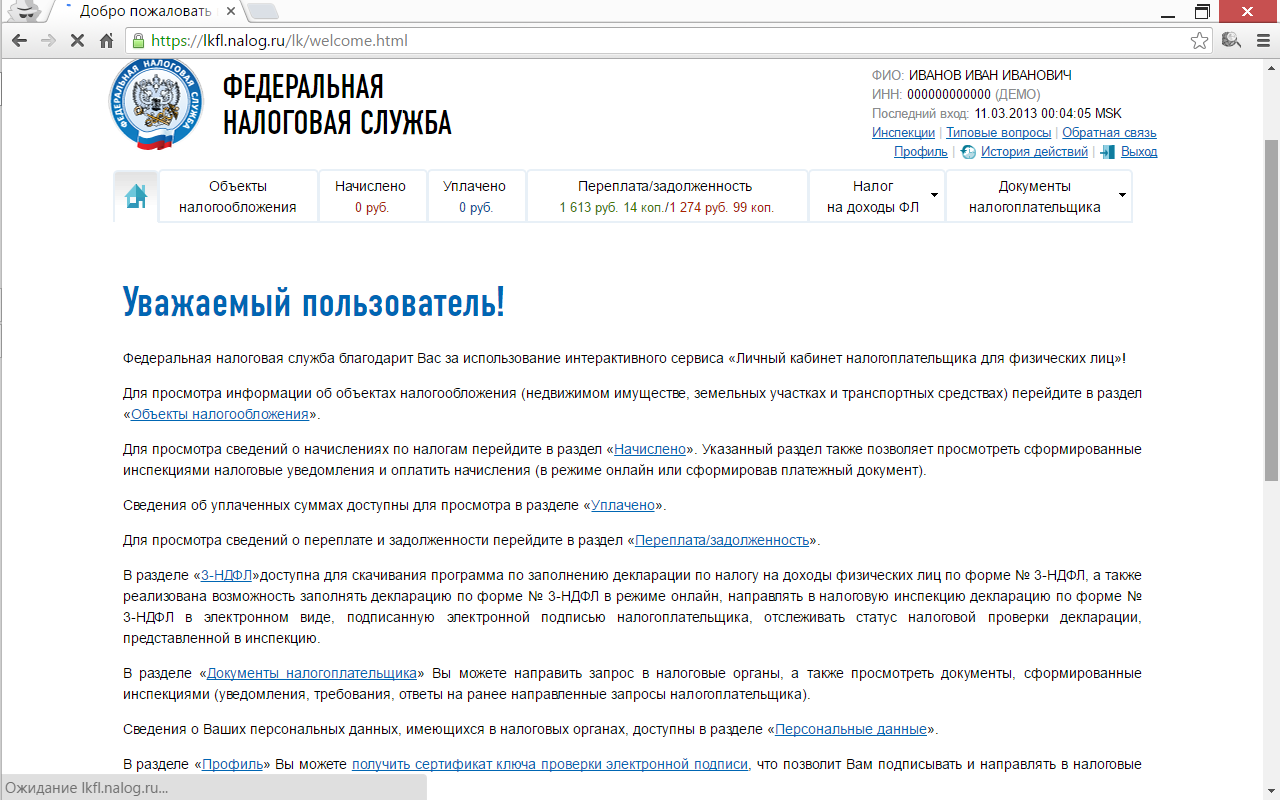 03.2021 УФНС России по г. Москве проведет вебинар по теме: «Налоговые льготы по уплате физическими лицами имущественных налогов. Порядок их предоставления».
03.2021 УФНС России по г. Москве проведет вебинар по теме: «Налоговые льготы по уплате физическими лицами имущественных налогов. Порядок их предоставления».
// ИФНС
12.03.2021
В Москве проходит информационная кампания в рамках отраслевого проекта «Общественное питание» Федеральная налоговая служба приступила к осуществлению отраслевого проекта в отношении субъектов предпринимательской деятельности, оказывающих услуги общественного питания.
// ИФНС
12.03.2021
УПРАВЛЕНИЕ ФЕДЕРАЛЬНОЙ НАЛОГОВОЙ СЛУЖБЫ ПО Г. МОСКВЕ напоминает о возможности участия граждан в осуществлении контроля за соблюдением законодательства о применении контрольно-кассовой техники
// ИФНС
05. 03.2021
03.2021
Льгота в виде предоставления налогового вычета по земельному налогу и налогу на имущество физических лиц для лиц, имеющих трех и более несовершеннолетних детей
В соответствии с пунктом 5 статьи 391 Налогового кодекса Российской Федерации налоговая база по земельному налогу уменьшается на величину кадастровой стоимости 600 квадратных метров площади земельного участка.
// ИФНС
05.03.2021
Льгота по транспортному налогу в отношении электромобилей
В соответствии с Законом г. Москвы физические лица, проживающие на территории г. Москвы, на которых зарегистрированы транспортные средства, оснащенные исключительно электрическими двигателями, освобождены от уплаты транспортного налога.
Москвы физические лица, проживающие на территории г. Москвы, на которых зарегистрированы транспортные средства, оснащенные исключительно электрическими двигателями, освобождены от уплаты транспортного налога.
// ИФНС
16.02.2021
Порядок действий в случае гибели или уничтожении объекта налогообложения В отношении объекта налогообложения, прекратившего свое существование в связи с его гибелью или уничтожением, исчисление транспортного налога или налога на имущество физических лиц прекращается.
// ИФНС
16.02.2021
Беззаявительный порядок представления физическим лицам льгот по имущественным налогам
Беззаявительный порядок предусматривает предоставление налоговой льготы и (или) налогового вычета на основании имеющейся у налогового органа информации, то есть без обращения налогоплательщика.
// ИФНС
09. 02.2021
02.2021
В УФНС пройдет онлайн-вебинар для налогоплательщиков
10 февраля 2021 года УФНС России по г. Москве проведет вебинар по теме: «Электронные сервисы ФНС России для граждан».
// ИФНС
29.01.2021
Уважаемые налогоплательщики сферы услуг общественного питания 02 февраля 2021 года в 11. 00 ИФНС России № 24 по г. Москве проведет семинар по теме: реализация отраслевого проекта «Общественное питание».
00 ИФНС России № 24 по г. Москве проведет семинар по теме: реализация отраслевого проекта «Общественное питание».
// ИФНС
29.01.2021
ФНС России проводит отраслевой проект «Общественное питание» Федеральная налоговая служба приступила к осуществлению отраслевого проекта в отношении субъектов предпринимательской деятельности, оказывающих услуги общественного питания.
// ИФНС
29. 01.2021
01.2021
Условия освобождения от уплаты имущественных налогов для ИП Индивидуальные предприниматели, признанные осуществляющими деятельность в соответствующей отрасли российской экономики, в наибольшей степени пострадавшей в условиях ухудшения ситуации в результате распространения новой коронавирусной инфекции, освобождаются от уплаты имущественных налогов физических лиц за II квартал 2020 года.
Межрайонная ИФНС России № 3 по Челябинской области
Контакты
Юридический адрес: 456870, Челябинская область, г. Кыштым, ул. Ю.Ичевой, 175
Телефон:
приемная +7 (351-51) 4-00-29
контакт-центр: 8-800-222-2222
телефон доверия +7 (351-51) 4-00-25
Факс: +7 (351-51) 4-00-29
Начальник: Сумин Алексей Сергеевич
Время работы
| | Время работы инспекции (перерыв с 13. 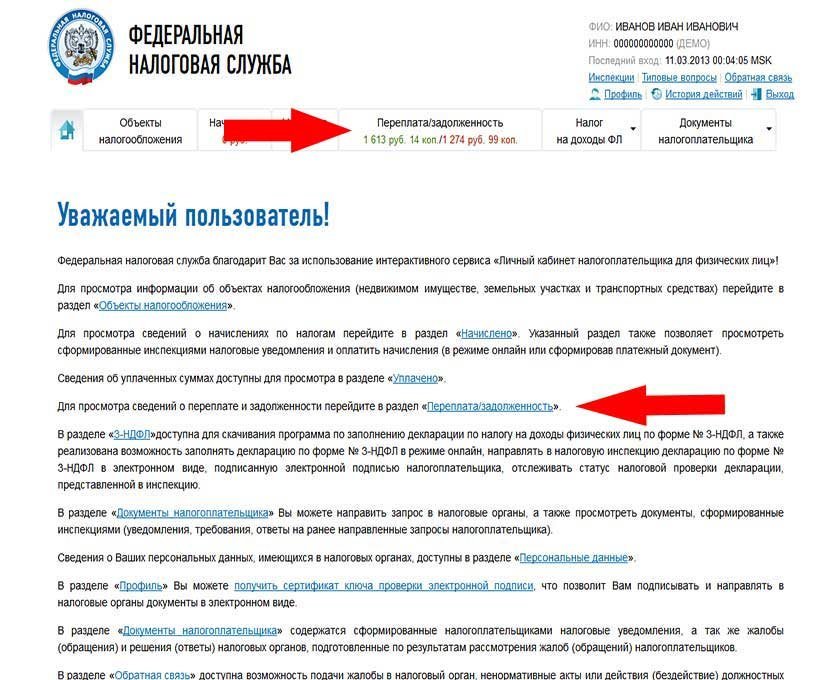 00 до 13.45) 00 до 13.45) | Время работы операционного зала и ТОРМов (без перерыва) | Время приема документов по государственной регистрации ЮЛ и ИП, присвоение ИНН |
| Пн. | 9.00-18.00 | 9.00-18.00 | 9.00-18.00 |
| Вт. | 9.00-18.00 | 9.00-20.00 | 9.00-18.00 |
| Ср. | 9.00-18.00 | 9.00-18.00 | 9.00-18.00 |
| Чт. | 9.00-18.00 | 9.00-20.00 | 9.00-18.00 |
| Пт. | 9.00-16.45 | 9.00-16.45 | 9.00-16.45 |
| Сб. | — | — | — |
Реквизиты
| Код ИФНС | 7413 |
| Наименование | Межрайонная инспекция Федеральной налоговой службы № 3 по Челябинской области |
| ИНН | 7413009544 |
| КПП | 741301001 |
| Адрес | ,456870,Челябинская обл,,Кыштым г,,Ичевой Юлии ул,175,, |
| Банк получателя | Отделение Челябинск |
| БИК | 047501001 |
| Бюджетный счет | 40101810400000010801 |
| Наименование получателя | УФК по Челябинской области (Межрайонная ИФНС России № 3 по Челябинской области) |
Для определения кода ОКТМО воспользуйтесь сервисом «Узнай ОКТМО» — https://www.
 nalog.ru/rn74/service/oktmo/
nalog.ru/rn74/service/oktmo/Для заполнения платежного поручения воспользуйтесь сервисом «Заполни платежные документы» — https://service.nalog.ru/
Тормы
Территориальный участок 7422 (Озерск)
456780, Челябинская область, г. Озерск, пр. Ленина,37
Телефон: контакт-центр: 8-800-222-2222
Дополнительная информация
Для направления обращений в электронной форме в ФНС России и ее территориальный налоговые органы Вы можете воспользоваться onlain – сервисом: «Обратиться в ФНС России» — https://www.nalog.ru/rn74/service/obr_fts/
- Инспекция обслуживает налогоплательщиков Кыштымского, Озерского и Карабашского городских округов
Новости
Решение по результатам налоговой проверки — Контур.Эксперт — СКБ Контур
Привлечение к ответственности
Рассмотрев материалы налоговой проверки и мероприятий дополнительного налогового контроля (когда они нужны), руководитель ИФНС (замруководителя) может привлечь компанию к ответственности за нарушение налогового законодательства (п. 7 ст. 101 НК РФ).
7 ст. 101 НК РФ).
Но, прежде чем вынести решение, руководитель ИФНС должен выяснить, есть ли обстоятельства, которые исключают или смягчают вину компании или, наоборот, отягчают ее ответственность (п. 5 ст. 101 НК РФ).
Что указывается в документе
В решении о привлечении к ответственности указываются (п. 8 ст. 101 НК РФ):
- обстоятельства совершенного налогового правонарушения;
- доводы компании в свою защиту;
- результаты проверки этих доводов;
- решение о привлечении компании к налоговой ответственности с указанием соответствующих статей НК РФ;
- меры ответственности, которые будут приняты в отношении налогоплательщика;
- размер выявленной недоимки, пени и штрафа;
- срок, в течение которого можно обжаловать решение, а также порядок обжалования;
- наименование и адрес органа, в котором решение можно обжаловать.
В решении об отказе в привлечении к ответственности указываются обстоятельства, послужившие основанием для отказа. Также в таком решение могут быть указаны размер недоимки, выявленной в ходе проверки, и сумма пени (п. 8 ст. 101 НК РФ).
Также в таком решение могут быть указаны размер недоимки, выявленной в ходе проверки, и сумма пени (п. 8 ст. 101 НК РФ).
Оцените финансовое состояние вашего предприятия с помощью Контур.Эксперт
Отправить заявкуВручение решения
Решение должно быть вручено представителю организации в течение 5 рабочих дней после его принятия (п. 9 ст. 101 НК РФ). Если это не представляется возможным, то ИФНС направит решение заказным письмом. В этом случае будет считаться, что решение получено налогоплательщиком по прошествии 6 рабочих дней с даты отправки письма инспекцией (п. 13 ст. 101 НК РФ).
Вступление решения в силу
Вынесенное решение вступит в законную силу по истечении месяца со дня его вручения (п. 9 ст. 101 НК РФ).
Организация вправе обжаловать решение ИФНС, подав апелляционную жалобу. Есть три варианта развития событий.
Есть три варианта развития событий.
- Вышестоящий налоговый орган не отменяет решение ИФНС. В этом случае оно вступает в силу со дня принятия соответствующего решения вышестоящим налоговым органом.
- Вышестоящий налоговый орган отменяет решение и выносит новое. Тогда оно вступает в силу со дня его принятия.
- Апелляционная жалоба остается без рассмотрения. В этой ситуации решение ИФНС вступит в силу со дня принятия вышестоящим налоговым органом решения об отклонении жалобы, но не ранее истечения срока ее подачи (ст. 101.2 НК РФ).
После вступления решения в силу в течение 20 рабочих дней в адрес компании будет направлено требование об уплате доначисленного налога (пени, штрафа) (п. 2 ст. 70 НК РФ).
Как узнать код налогового органа? Определяем код инспекции ФНС
08 января 2021
53Как узнать код налогового органа?
Налоговый консультант
Ирина Ерёмина
3 минуты чтения
11 105
Код инспекции — это обязательный реквизит в отчетности и других важных документах, связанных с уплатой и исчислением налогов. Физлица заполняют и сдают налоговую декларацию по форме 3-НДФЛ, правила ее заполнения утверждаются отдельным документом (приказ ФНС России от 07.10.2019 № ММВ-7-11/506@).
Физлица заполняют и сдают налоговую декларацию по форме 3-НДФЛ, правила ее заполнения утверждаются отдельным документом (приказ ФНС России от 07.10.2019 № ММВ-7-11/506@).
Каждая инспекция имеет свой уникальный номер и “обслуживает” определенную территорию. По вашему месту жительства может быть только одно подразделение ФНС. Есть несколько способов, как узнать свою налоговую инспекцию. Рассмотрим их в статье.
СтатьиСодержание статьи
Что такое код налогового органа? Как узнать код инспекции ФНС?Что такое код налогового органа?
Код инспекции — это уникальный номер налогового органа. Он состоит из 4 цифр — первые две указывают на регион или субъект РФ, другие две — на конкретный орган ИФНС внутри региона или субъекта.
Инспекции поделены по территориям, а значит, конкретный код контролирующего органа единый для всех физлиц и компаний, зарегистрированных в определенной части города или районе.
Это номер нужен физлицам и организациям для правильного оформления деклараций (например, 3-НДФЛ для физлиц), для уплаты налогов, для получения различных справок, льгот и вычетов.
Далее расскажем, как быстро понять, к какой налоговой относишься.
Как узнать код инспекции ФНС?
Есть несколько способов, как узнать код надзорного органа:
— узнать код налогового органа по ИНН
— узнать номер органа ФНС по адресу
— позвонить в “горячую линию” ФНС России
Рассмотрим каждый из способов.
Если вы недавно получили ИНН, то вы можете посмотреть номер ИФНС в нем. Первые 4 цифры в номере — это и есть реквизиты вашей ИФНС. Но если вы получали ИНН давно или меняли место жительства, то лучше перепроверить другими способами. Т.к. ИНН выдается один раз и на всю жизнь (ст. 84 НК РФ), а вы могли переехать, ИФНС закрыться …
Чтобы узнать налоговый орган по месту жительства, нужно зайти на официальный сайт ФНС России (www.nalog.ru), зайти в раздел “Контакты” и нажать на поле “Адреса и платежные реквизиты вашей инспекции”. Затем . откроется сервис “Определение реквизитов ИФНС, органа государственной регистрации ЮЛ и/или ИП, обслуживающих данный адрес”. Теперь вам нужно указать свой адрес и система автоматически определит код ИФНС и муниципального образования.
Можно позвонить в контакт-центр по единому телефону 8 (800) 222-22-22, чтобы узнать, к какой инспекции прикреплен человек или предприниматель. Также по этому номеру можно получить и другую справочную информацию касательно проверок, сроков сдачи отчетности и получить ответы на другие вопросы.
В сети Интернет также есть много сервисов и справочников, позволяющих узнать номер “своей” ИФНС. Но лучше доверять проверенным источникам, а если у вас есть сомнения, то позвонить на “горячую линию” ФНС России.
Наш онлайн-сервис “Налогия” автоматически определяет и заполняет специфические данные (такие как реквизиты инспекции, ОКТМО, номер корректировки и др.) в декларации 3-НДФЛ.
Теперь вы сможете легко и быстро узнать код налогового органа, в который вам нужно предоставлять декларацию. Не запоминайте эти цифры, это ни к чему, тем более что иногда они меняются. Проще всего сохранить эту статью, чтобы всегда нужная информация была под рукой.
Получите налоговый вычет
Выберите удобный тариф
и получите налоговый вычет быстро и просто
Как узнать ИНН физического лица и организации. Проверка своего ИНН
Идентификационный номер – это уникальный код налогоплательщика, который присваивается организациям и гражданам налоговой службой при постановке на учет. Для его назначения следует обратиться по месту жительства в ИФНС. Если нужно узнать собственный идентификационный код или какой-либо организации, то делается это несколькими методами.
Как узнать свой ИНН
Уникальный код, который состоит из 12 цифр, нужен человеку редко. Как правило, его спрашивают при устройстве на работу или для заключения каких-либо договоров. Если такой случай представился, а наизусть код вы не помните, как узнать номер ИНН? Сделать это возможно несколькими вариантами: если обратиться в налоговое отделение по месту прописки или через интернет. Развитие всемирной паутины дало возможность каждому гражданину РФ найти свой ИНН или сделать запрос на присвоение кода. Для этого нужно:
- найти в поисковике интернет-портал Государственных услуг;
- ввести в специальную форму паспортные данные;
- набрать контрольные буквы и цифры, отравить запрос;
- после обработки ответ появится в нужной строке.
Как узнать чужой ИНН
Для определения идентификационного номера другого человека нужно наличие его паспорта. Как узнать чужой ИНН, КПП или БИК, если его удостоверения личности нет. Есть небольшой шанс узнать информацию онлайн на сайте nalog.ru. Если объект оформлен как юридическое лицо или индивидуальный предприниматель, то вы сможете пробить ИНН. Поможет узнать информацию услуга «Риски бизнеса». При наличии данных о фамилии и месте жительства предпринимателя система отобразит его идентификационный номер и список всех видов деятельности.
Как узнать ИНН физического лица по паспорту
Проверить через интернет идентификационный код человека проще простого. Для этого нужно найти сервис, который предоставляет такую информацию. Среди них официальный сайт налоговой инспекций РФ, Единый портал госуслуг. В отличие от СНИЛС, идентификационный номер не является информацией персональной, поэтому лежит в свободном доступе. Для его получения надо зайти на любой выбранный сайт и онлайн найти ИНН физического лица по паспортным данным.
Проверить ИНН организации на сайте налоговой
Камнем преткновения контролирующих органов и налогоплательщиков являются фирмы однодневки. К сожалению, ответственность за недобросовестные сделки ложится на плечи тех, кто заключает их с такими компаниями. Сотрудничество с сомнительными бизнес-партерами грозит предпринимателю внеплановой выездной проверкой. Где узнать свой ИНН, вы уже знаете.
Проверить ИНН организации на сайте налоговой nalog.ru можно абсолютно бесплатно. Государственный ресурс содержит большое количество проверочных сервисов. С их помощью легко получить ОГРН и основную информацию о предприятии или нотариусе: сведения из ЕГРЮЛ, данные о юридическом адресе, задолженности по налогам, нахождения на стадии банкротства и так далее. Для более достоверной информации можно сделать в налоговую инспекцию письменный запрос.
Проверить ИНН физического лица на сайте налоговой
Чтобы проверить свой ИНН или получить другую информацию на портале налоговой службы, необходимо пройти процедуру регистрации и заполнить в личном кабинете свои данные. Узнать идентификационный код постороннего человека тоже можно. Для того чтобы проверить ИНН физического лица на сайте налоговой, следует ввести в соответствующей графе паспортные данные интересующего вас человека и дату выдачи документа.
Как узнать ИНН по фамилии
Любой человек за несколько минут может узнать собственный код налогоплательщика. Многие люди интересуются, как узнать ИНН физического лица по ФИО? Если человек не занимается официально коммерцией, то получить такую информацию нельзя – это незаконно. Для поиска индивидуального предпринимателя хватит знания его фамилии, имени и отчества, чтобы получить нужные сведения на сайте госслужбы РФ.
Как узнать ИНН организации по названию
В отличие от физических лиц, юридический идентификационный номер из 10 цифр состоит. Узнать ИНН юридического лица по названию в режиме онлайн можно несколькими способами. Через официальный портал налоговой, веб-сервис ведомств, которые выдавали лицензию на деятельность или через службы судов и судебных приставов. Сайт Арбитражные Суды РФ содержит сведения обо всех делах, а поиск прост. Нужно лишь ввести название компании или имя владельца (директора), и система выдаст перечень всех данных об участниках судебного процесса.
Вычислить нужную организацию по названию можно и просто задав запрос в сети интернет. Сейчас лица, которые активно ведут свою деятельность, напрямую сотрудничают со справочными сервисами, желтыми страницами и другими службами с целью саморекламы. Все вышеуказанные способы помогут в поиске нужного предприятия, но это в крайнем случае. Чтобы оградить свой бизнес от мошенников, лучше перед сделкой встретиться с партнером лично и на добровольных началах предоставить все сведения друг другу.
Как узнать ИНН по СНИЛС
Индивидуальный страховой номер гражданина РФ называют сокращенно СНИЛС. Он нужен для перечисления работодателем средств в Пенсионный фонд для формирования будущей пенсии сотруднику. Индивидуальный страховой номер является уникальным, поэтому принадлежит только одному человеку. Он может понадобиться для получения всевозможных льгот. Иностранный гражданин, временно находящийся в России, тоже может претендовать на получение СНИЛС, если имеет трудовой договор, сроком от 6 месяцев.
Можно ли узнать свой ИНН по СНИЛС? Выдают страховой номер в Пенсионном фонде РФ. Как узнать свой номер ИНН с помощью этого сайта?
Видео: как проверить ИНН
Источник: mstud.org
ФНС России
ФЕДЕРАЛЬНАЯ НАЛОГОВАЯ СЛУЖБА
ИНФОРМАЦИЯ
Верховный Суд РФ в определении
N 305-АД18-9558 подтвердил, что Межрайонная инспекция может привлекать к административной ответственности организации, не состоящие у нее на учете, если иное не указано в ее положении, утвержденном вышестоящим налоговым органом.
Не согласившись с инспекцией, организация обратилась в суд. Она сослалась на то, что административное правонарушение было совершено по адресу, на который распространяются полномочия ИФНС России N 27 по г. Москве. Сама же компания состоит на учете в ИФНС России N 23 по г. Москве. Следовательно, Межрайонная ИФНС России N 49 по г. Москве, которая проводила проверку, не имела право рассматривать это дело и штрафовать организацию.
Суд первой инстанции отказал компании в удовлетворении требований. Он признал правомерным привлечение ее к ответственности, указав, что Межрайонная ИФНС России N 49 по г. Москве действовала в пределах полномочий, предусмотренных приказом Минфина России от 17.07.2014 N 61н и Положением о Межрайонной инспекции Федеральной налоговой службы N 49 по г. Москве, утвержденным УФНС России по г. Москве 17.12.2015. Последнее вправе делегировать нижестоящей инспекции полномочия по проведению контрольных мероприятий на всей территории города Москвы. Нарушений порядка привлечения организации к административной ответственности суд первой инстанции не установил.Суд апелляционной инстанции отменил решение суда первой инстанции, указав, что рассматриваемое правонарушение было совершено на территории, подконтрольной ИФНС России N 27 по г. Москве. Следовательно, у Межрайонной ИФНС России N 49 по г. Москве не было полномочий рассматривать это дело.
Межрайонная инспекция Федеральной налоговой службы N 49 по г. Москве обратилась в Верховный Суд РФ с кассационной жалобой. Судебная коллегия по экономическим спорам Верховного Суда РФ отменила постановление суда апелляционной инстанции, оставив в силе решение суда первой инстанции. Она указала, что согласно вышеуказанному положению, Межрайонная инспекция Федеральной налоговой службы N 49 по г. Москве, находясь в непосредственном подчинении УФНС России по г. Москве, может осуществлять на всей территории города контроль и надзор за соблюдением требований к контрольно-кассовой технике, а также за полнотой учета выручки. В положении об инспекции не указано, что ее полномочия распространяются только на какую-то отдельную территорию столицы. Таким образом, Межрайонная инспекция Федеральной налоговой службы N 49 по г. Москве была вправе проводить проверку организации, рассматривать дело об административном правонарушении, а также составлять соответствующий протокол.
Открыть полный текст документа
Интерферонов типа III в вирусных инфекциях и противовирусном иммунитете — FullText — Cellular Physiology and Biochemistry 2018, Vol. 51, № 1
Аннотация
Интерфероны (IFN) могут служить первой линией иммунной защиты от вирусной инфекции. Идентификация IFN-λs 1, 2, 3 и 4 (называемых IFN типа III) показала, что противовирусный иммунный ответ на вирусы содержит больше компонентов, чем IFN типа I, которые известны более 50 лет.IFN-λ представляют собой IFN-λ1 (IL-29), IFN-λ2 (IL-28a), IFN-λ3 (IL-28b) и IFN-λ4, который напоминает IFN-λ3. IFN-λ обладают иммунными ответами и биологической активностью типа I-IFN, но наши знания об этих новых участниках противовирусного ответа недостаточно хорошо установлены. В этом обзоре мы пытаемся описать текущую информацию об экспрессии и функции IFN-λ во врожденной противовирусной иммунной защите и роли IFN-λ2 в регуляции и формировании адаптивного иммунного ответа. Мы предполагаем, что IFN-λ являются ключевыми противовирусными цитокинами, непосредственно осуществляющими противовирусный иммунный ответ на эпителиальных поверхностях на ранних стадиях вирусной инфекции, и что эти цитокины также искажают баланс клеток Th2 и Th3 в сторону фенотипа Th2.Кроме того, генетический полиморфизм генов IFN-λ может нарушать противовирусные иммунные ответы при клиническом лечении.
© 2018 Автор (ы). Опубликовано S. Karger AG, Базель
Введение
Первая линия защиты для противодействия патогенным инфекциям обычно зависит от врожденного иммунного ответа. В ходе иммунного ответа рецепторы распознавания образов (PRR), которые ограничены зародышевой линией, используются для идентификации молекулярных организаций, консервативных среди классов патогенов, таких как вирусная двухцепочечная РНК.Интерфероны (IFN), которые представляют собой секретируемые белки, кодируемые хозяином и подразделяются на три типа (I, II и III), часто участвуют во множественных иммунных взаимодействиях и выполняют как индукцию, так и регуляцию врожденных и адаптивных противовирусных механизмов, когда вирусы инфицируют хозяина. . При возникновении вирусных инфекций экспрессия IFN типа I (как правило, сосредоточена на IFN-α и IFN-β) будет функционировать как основной врожденный ответ противовирусной защиты [1]. Противовирусная активность, проявляемая IFN типа I, напрямую подавляет репликацию вируса.Кроме того, IFN типа I могут опосредовать клеточные иммунные функции как врожденной, так и адаптивной иммунной системы, обеспечивая устойчивость к вирусным инфекциям и поддерживая долгосрочный иммунитет [2]. Из-за очевидных противовирусных функций IFN типа I [3] было проведено множество исследований иммунной активности IFN типа I, и был получен большой объем информации о молекулярных механизмах его биологических действий, иммунной индукции IFN типа I и иммунное уклонение, осуществляемое вирусами [4].Основываясь на многочисленных исследованиях IFN типа I, он используется в качестве иммунного индуктора или лекарственного средства для лечения хронической вирусной инфекции. Среди трех типов IFN, IFN типа III, называемые IFN-λ или IFNL, также играют важную роль в противовирусной иммунной активности [5]. IFN типа III (IFN-λ1, 2 и 3) были обнаружены как интерлейкин (IL) -29, 28a и 28b и обладают многими иммунными активностями, общими с IFN типа I [6, 7]. Позднее был открыт новый член, названный IFN-λ4, который может экспрессироваться только людьми, несущими символ гена (аллель IFNL4-ΔG [rs368234815]) [8].Следует отметить, что врожденные противовирусные ответы на проникновение вирусных частиц напрямую опосредуются PRR и не зависят от путей TLR и RIG-I, а именно IFN-независимым образом [9]. Этот вывод иллюстрирует, что ранние события, связанные с врожденной антивирусной активностью, более сложны, чем считалось ранее, и подчеркивает, что исследователям все еще необходимо оценить гораздо больше случаев, чтобы понять ранние этапы борьбы с вирусом-хозяином. В этом обзоре мы пытаемся представить, как были открыты IFN типа III, и обсудить, что было изучено об их роли в посредничестве врожденной / адаптивной иммунной системы и их механизме противовирусной защиты.Наконец, мы предлагаем дальнейшие направления исследований биологии IFN типа III.
Открытие IFN типа III
IFN типа III, включая IFN-λ1, IFN-λ2 и IFN-λ3, были впервые описаны с помощью компьютерных предсказаний в соответствии с данными генома [6, 7]. Открытие IFN-λ4 было сделано путем анализа многих маркеров однонуклеотидного полиморфизма (SNP), расположенных выше хромосомной области IFN-λ3, на основе полногеномных исследований вирусной инфекции гепатита C [8]. Чтобы лучше классифицировать символ гена IFN-λ4, основная информация о местоположении семейства IFN-λ в геноме проиллюстрирована на рис.1. Все четыре члена существуют в области от 19q13.12 до 19q13.13 в длинном (q) плече хромосомы 19. Ген IFNL1 (Il-29) расположен ниже IFNL2 (IL-28a). ), а ген IFNL3 расположен ниже IFNL4 . Три белка (IFN-λ1, IFN-λ2 и IFN-λ3) транскрибируются и транслируются из генов (IFNL1, IFNL2 и IFNL3) и очень похожи друг на друга. В частности, степень сходства между IFN-λ2 и IFN-λ3 составляет примерно 96% на уровне аминокислотной последовательности, а аминокислотная идентичность между IFN-λ1 и IFN-λ2 / IFN-λ3 составляет примерно 81% [6, 7 ].Хотя IFN-λ4 наиболее близок к IFN-λ3, аминокислотная идентичность между IFN-λ3 и IFN-λ4 составляет примерно 30% [10]. Рецептор IFN-λ исследовали посредством сканирования транслированных геномных последовательностей человека на предмет последовательностей, относящихся к рецепторам цитокинов класса II. IFN-λ1-4 рассматриваются как IFN типа III, потому что они передают сигнал через рецепторный комплекс, который отличается от рецептора, используемого IFN типа I и типа II [11, 12]. Следовательно, дальнейшее описание нового типа врожденного противовирусного цитокина вызвало ряд вопросов и потребовало дополнительного понимания роли IFN-λ в противовирусной защите.Здесь мы приводим некоторые новые данные, касающиеся роли IFN-λ в врожденных и адаптивных иммунных ответах, чтобы проиллюстрировать биологическую активность этих IFN и предоставить некоторые справочные предложения для потенциального клинического применения IFN-λ при вирусных инфекциях.
Рис. 1.
Расположение генов семейства IFN-λ в хромосоме 19.
Образование IFN-λ во время вирусной инфекции
Основным этапом образования IFN является требование для обнаружения микробов внутриклеточным методом. рецепторы.Вирусные генетические материалы являются наиболее мощными индукторами IFN-ответов. В цитоплазме 5’-трифосфорилированная или двухцепочечная (ds) РНК распознается геликазами RIG-I и MDA5 домена «DEXD-H box» [13, 14]. В эндосомах ssRNA или dsRNA могут распознаваться Toll-подобными рецепторами (TLR3, TLR7, TLR8 и TLR9) [15-17]. В некоторых случаях ДНК может служить мощным индуктором генерации IFN, но данных о рецепторных системах, опосредующих эти события, не поступало. Сообщалось, что ДНК-зависимый активатор IFN-регуляторных факторов (DAI), также называемый DLM-1 или ZBP1, может распознавать Z- / B-ДНК и запускать экспрессию IFN [18, 19].Взаимодействие между IRF3 и DAI может способствовать ответу IFN на ДНК цитомегаловируса человека [20]; однако DAI, вероятно, увеличивает уровни репликации ВИЧ-1 через путь DAI-NF-κB [21]. Интересно, что из-за перекрестного взаимодействия между системами, чувствительными к ДНК и РНК, РНК-полимераза III распознает некоторые ДНК в качестве матриц и выполняет de novo генерацию 5′-трифосфорилированных РНК с двухцепочечными структурами, которые могут запускать системы IFN через RIG- I путь [22, 23]. Кроме того, были идентифицированы другие новые пути, задействованные в системах запуска IFN с помощью ДНК-сенсора, включая путь cGAS-STING и отсутствующий в меланоме 2 (AIM2) путь инфламмасомы [24–26].В пути cGAS-STING динуклеотид 2 ‘, 3’-GMP-AMP может служить в качестве вторичного эндогенного мессенджера в передаче сигналов врожденного иммунитета, индуцированной чужеродной ДНК, связанной с бактериальной и вирусной инфекцией, и распознаваться рецептором STING, вызывая фосфорилирование TANK-связывающей киназы 1 (TBK1) и IRF3, приводящее к образованию IFN [27]. Для нового рецептора цитоплазматической ДНК AIM2 может формировать инфламмасому с лигандом и ASC (связанный с апоптозом пятнышкообразный белковый домен, содержащий домен активации и рекрутирования каспазы) для активации как каспазы-1, так и NF-κB.Эти сигнальные трансдукции затем запускают систему IFN типа I и пути пироптозной и апоптотической смерти [28-30]. В целом, внутриклеточное зондирование микробов через различные рецепторные системы врожденной иммунной системы запускает передачу сигналов некоторым транскрипционным факторам и, наконец, приводит к образованию IFN.
Что касается роли факторов транскрипции в экспрессии двух типов IFN, то стратегии транскрипции основываются на ядерном факторе (NF) κB и факторах регуляции IFN (IRF).Несмотря на в целом сходную модель транскрипции для экспрессии двух типов, существуют важные различия в механизмах транскрипции, опосредующих экспрессию двух типов [31]. Взяв, например, IFN-α, кластер сайтов связывания IRF существует в промоторах IFN-α, но существуют разные аффинности для связывания IRF3 и IRF7 с соответствующими сайтами, и IRF7 имеет сильную тенденцию связывать IFN-α. промотор для индукции экспрессии гена [32, 33]. Для экспрессии IFN-β как IRF3, так и IRF7 могут хорошо связываться с правильным сайтом в промоторе.Поскольку экспрессия является конститутивной, в то время как экспрессия IRF7 является IFN-специфичной, экспрессия IFN-β является ранним врожденным иммунным ответом, тогда как экспрессия IFN-α является отложенным ответом, но находится на высоком уровне [33, 34]. Что касается экспрессии IFN-λ, то промоторы всех генов IFN-λ имеют сайты связывания для NF-κB и IRF [35, 36]. Следует отметить, что промотор в гене IFN-λ1 имеет высокое сродство к IRF3, тогда как промотор IFN-λ2 / 3 имеет высокое сродство к IRF7. Следовательно, ответы IFN-λ2 / 3 представляют собой замедленную кинетику по сравнению с IFN-λ1 [36].По сравнению с промотором IFN-β человека, кластер дистальных сайтов NF-κB играет важную роль в полной индукции IFN-λ1, и эти сайты активируют промотор IFN-λ1 без IRF-3/7 [37]. Когда путь NF-κB ингибировался в дендритных клетках (DC), генерация IFN-λ серьезно блокировалась, но это ингибирование оказывало незначительное влияние на генерацию IFN типа I [38]. Несмотря на то, что одни и те же транскрипционные факторы участвуют в активации генерации IFN типа I и III, путь NF-κB является ключевым регулятором в генерации IFN-λ, тогда как путь IRFs доминирует над экспрессией IFN типа I.Более того, из-за независимого действия NF-κB и IRF-3/7 промоторы IFN-λ кажутся более гибкими, чем промотор IFN-β, в получении отдельных сигналов для активации генерации IFN-λ независимо.
Индукция IFN-λs и сигнальные пути
Все биологические активности цитокинов осуществляются путем взаимодействия со специфическими рецепторами, которые получают стимулы и затем запускают внутриклеточные события через пути передачи сигнала. Стимулы, запускающие экспрессию генов IFNL , включая вирусы, аналогичны трансляциям IFN типа I [6, 7, 39-41].Тем не менее, существуют различия в требованиях к рецепторам и факторам транскрипции между IFN типа I и IFN типа III. Передача сигнала IFN типа I зависит от комплекса IFNAR, который состоит из IFNAR 1 и IFNAR2, в то время как передача сигнала IFN типа III зависит от IFN-λ-специфической цепи IL-28Ra и цепи IL-10R2, которая включает IL-10 и другие члены суперсемейства IL-10 [6, 7]. Когда хозяин обнаруживает ассоциированные с патогеном молекулярные структуры с помощью PRR, могут быть синтезированы IFN типа I и III.Для передачи сигнала, индуцированного IFN типа I, взаимодействия между IFN-α / β и IFNAR запускают активацию специфических рецепторных взаимодействующих тирозинкиназ Jak1 и Tyk2, которые могут фосфорилировать членов сигнального преобразователя и активатора семейства транскрипции (STAT) до запускают димеризацию STAT и активацию активности родственных факторов транскрипции [42]. STAT1 и 2 считаются основными факторами транскрипции, активируемыми IFN, которые вместе с IRF9 образуют тримерный комплекс ISGF3, который управляет транскрипцией стимулированных IFN генов (ISG) (PMID: 7959489).После исследований функций семейства STAT, STATs 3, 4 и 5 также могут активироваться IFN типа I [43]. Несмотря на различия между рецепторными системами, используемыми IFN типов I и III, внутриклеточные сигнальные программы, активируемые IFN-λ, в некоторой степени схожи. Комбинация IFN-λ и IL-28Rα вызывает конформационное изменение, которое эффективно осуществляет привлечение IL-10R2 в комплекс IFN-λ-IL-28Rα-IL-10R2. Затем активируются ассоциированные с рецептором тирозинкиназы (TYK2 и JAK1), чтобы контролировать фосфорилирование тирозина внутриклеточного домена цепи IL-28Rα [44, 45].Белки STAT отслеживают и связываются с мотивами с фосфотирозином в этом домене и формируют ISGF3, например IFN типа I. ISGF3 перемещается из цитозоля в ядро и связывается с интерферон-стимулированными элементами ответа (ISRE) в промоторах ISG (рис. 2), которые могут продуцировать множество белков с противовирусными функциями [10, 46, 47]. Несмотря на аналогичные модели передачи сигнала, опосредованные IFN типов I и III, IFN типа I могут индуцировать экспрессию ISG с более высокой кинетикой, чем у IFN типа III, а IFN типа III могут продлевать более стабильно высокий уровень экспрессии ISG, чем у типа I. IFNs [46].Остается неясным, обладает ли IFN типа III иммунной активностью, отличной от активности IFN типа I, и обладают ли два типа IFN противовирусной активностью с разной кинетикой.
Рис. 2.
Модель сходства в передаче сигналов, запускаемых рецепторами IFN типов I и III. IFN типов I и III основаны на рецепторных комплексах IFNAR1 / IFNAR2 и IL-28Rα / IL-10R2 соответственно. В некоторой степени внутриклеточные сигнальные трансдукции, индуцированные двумя различными рецепторными комплексами, подобны, особенно с IFN-активированным фактором транскрипции ISGF3, состоящим из SAT1-SAT2-IRF9.ISGF3 может связываться с интерферон-стимулированными элементами ответа (ISRE) в промоторах многочисленных IFN-стимулированных генов (ISG), чтобы запускать экспрессию ISG.
Роль IFN-λ в противовирусных ответах
IFN обычно считаются противовирусными цитокинами при врожденных иммунных ответах. В семействе IFN типа III IFN-λ1, IFN-λ2 и IFN-λ3 представляют собой противовирусную активность против ряда вирусов in vitro [6, 7]. Это быстро вызвало вопросы о функциях IFN-λ в ограничении репликации основных патогенных вирусов человека.Первое сообщение о противовирусном ответе IFN-λ заключается в том, что IFN-λ могут блокировать репликацию вируса гепатита C и вируса гепатита B in vitro [48]. Однако IFN-λ4, который вырабатывается только людьми, несущими аллель IFNL4-ΔG в качестве основного варианта у африканцев и второстепенного варианта у азиатов, связан с неспособностью противостоять инфекции HCV либо спонтанно, либо в ответ на лечение [ 10]. Согласно текущим данным о функциях IFN-λs, многочисленные исследования были сосредоточены на их вкладе в противовирусные иммунные ответы.Рекомбинантные IFN-λ1 и -λ2 ограничивают уровни репликации и цитотоксическую активность вируса простого герпеса (HSV) в клетках HepG2 [40]. После этого IFN-λ1 и -λ2 могут индуцировать экспрессию хемокинов CC, которые способны связываться с входным корецептором ВИЧ-1 CCR5 и ограничивать инфицирование макрофагов ВИЧ-1 [49]. вирусная инфекция, IFN-λ может индуцировать противовирусный фактор Mx1, чтобы ограничить распространение вируса гриппа A в легких; однако IFN-λ не может индуцировать Mx1 для ограничения репликации гепатотропного вируса в печени [50], что позволяет предположить, что IFN-λ играет важную роль во врожденном иммунном ответе в тканях слизистой оболочки.Когда мышей с нокаутированными рецепторами IFN типов I и III заражали вирусом желтой лихорадки (YFV), у этих мышей наблюдались отчетливые изменения в частотах множественных линий иммунных клеток, нарушение активации Т-клеток и серьезное нарушение баланса провоспалительных цитокинов [51]. ]. Кроме того, широкий спектр противовирусных иммунных активностей IFN-λ был идентифицирован в печени, легких, головном мозге и кишечном тракте [52–55]. В совокупности репликация функционально и структурно различных вирусов человека нарушается IFN-λ в различных органах и тканях.
Несмотря на сходные противовирусные реакции между IFN типа III и типа I, упомянутые выше, эти два типа IFN существенно различаются в отношении того, на какие клетки они нацелены. Рецепторы (IFNAR) IFN типа I существуют повсеместно, однако рецептор (IL-28Rα) существует только в нескольких типах клеток, включая некоторые классы лейкоцитов, такие как макрофаги, лимфоциты периферической крови, обычные DC, эпителиальные клетки и плазмоцитоидные DC. и поэтому клеточный ответ на IFN-λ ограничен узким спектром типов клеток и тканей [6, 7, 41, 56-60]. Эти данные также указывают на то, что дифференциальная экспрессия рецепторов IFN типа I по сравнению с типом III очевидна. эффекты на биологическую активность этих функционально связанных цитокинов в противовирусном ответе живых организмов.После исследований противовирусных иммунных ответов IFN-λ in vitro рекомбинантный IFN-λ, добавленный экзогенно или экспрессированный из рекомбинантного вируса, был способен ограничивать репликацию вируса у мышей, включая вирус Зика (ZIKV), вирус осповакцины, вирус гриппа А. , вирус гриппа B, коронавирус тяжелого острого респираторного синдрома, метапневмовирус человека, респираторно-синцитиальный вирус, HSV-2 и другие [40, 50, 61-64]. В этих исследованиях сообщается, что IFN-λ играет ключевую роль в противовирусных иммунных ответах in vivo и что эпителиальные поверхности являются основным полем битвы за эффективность IFN-λ в врожденных иммунных ответах, которые возникают в дыхательных и желудочно-кишечных трактах.Вышеупомянутые серьезные результаты в основном зависели от модели инфекции (мыши IL-28RA — / — и мыши IFNAR — / -). В литературе сообщается, что мыши STAT1 — / — проявляют более выраженный фенотип по сравнению с мышами IFNAR — / — после вирусного заражения. Это предполагает, что путь STAT играет важную роль во врожденных иммунных ответах на IFN-λ и IFN-γ [64-66].
Несмотря на то, что IFNs служат первой линией иммунной защиты от вторжения вирусных инфекций, вирусы могут применять различные стратегии для подавления противовирусных иммунных ответов IFNs.Подобно вирусам, ингибирующим ответы IFN типа I различными методами, как ДНК-, так и РНК-вирусы используют различные стратегии уклонения, чтобы блокировать молекулы, необходимые для экспрессии IFN типа III (например, IRF3), и ингибировать необходимые биологические функции (например, STAT1 / 2). , что приводит к нарушению ответа IFNs типа III [67]. Цитоплазматический белок (E3L) вируса осповакцины может нарушать PKR-зависимый путь для предотвращения противовирусного иммунного ответа, опосредованного IFN-λ. [68] Вирусы Эбола (EBoV) могут генерировать вирусный белок (VP24), который подавляет активацию IRF3 ниже по течению. , блокируя экспрессию IFN-λ [69].Вирусная протеаза (2A pro ) вируса Коксаки может блокировать как путь TLR3, так и пути RIG-I / MDA5, чтобы в дальнейшем генерировать белки передачи сигнала (TRIF и IPS1) и, следовательно, снижать экспрессию IFN-λ [70]. Несмотря на то, что IFN-λ выполняет важный противовирусный иммунный ответ на норовирусную инфекцию эпителиальных клеток кишечника, вирусный белок (NS1) действует через прямой антагонизм системы IFN-λ и доминирует в тропизме вирусных клеток [71]. Два дополнительных белка ВИЧ-1 (Vpr и Vif) могут связываться с TANK-связывающей киназой 1 (TBK1) и блокировать экспрессию IFN типов I и III в человеческих DC и макрофагах [72], хотя IFN-λ играет ключевую роль в противовирусные иммунные ответы на эпителиальных поверхностях, вирусы изо всех сил стараются уклоняться от противовирусных иммунных ответов для создания инфекции.
Влияние IFN-λ на адаптивные иммунные ответы
Из-за некоторых схожих функций и сигнальных путей между IFN типа I и типа III предполагается, что система IFN-λ обладает некоторыми новыми аспектами врожденной иммунной системы, регулирующей адаптивный иммунитет. отклик. IFN-λ регулирует дифференцировку DC из моноцитов посредством формирования рецепторного комплекса IFN-λ, и стимуляция через этот рецептор специфически индуцирует пролиферацию толерогенных CD4 + CD25 + Foxp3 + регуляторных T (Treg) -клеток, в результате чего в генерации толерогенных ДК, которые могут подавлять функции IFNs [73].Согласно аналогичным результатам исследования рекомбинантный аденовирус, экспрессирующий человеческий IFN-λ1, может снижать секрецию сывороточного IgE и увеличивать количество клеток селезенки CD4 + CD25 + Foxp3 + Treg, ослабляя аллергическое воспаление дыхательных путей [74]. Последующие исследования также отметили, что IFN-λ снижает активность Treg во время развития адаптивного иммунного ответа в более физиологических системах [75]. Таким образом, иммуностимулятор (экстракт выдержанного чеснока) может повышать уровень цитокинов IFN-λ и IL-4 в спленоцитах, стимулированных специфическим опухолевым антигеном, и уменьшать количество Treg-клеток в селезенке [76].Похоже, что IFN-λ позволяет адаптивной иммунной системе снижать иммуносупрессию, регулируемую Treg-клетками. Однако совсем недавно, по сравнению с активностью иммуносупрессии, регулируемой живыми Treg-клетками, мертвые Treg-клетки поддерживают и усиливают супрессорную способность иммунных ответов [77]. Основываясь на этих выводах, мы предполагаем, что дальнейшие исследования роли IFN-λ в снижении активности, индуцированной Treg-клетками, могут пролить свет на то, как контролировать поведение Treg-клеток и повысить эффективность терапии, направленной на контрольные точки рака.
Отдельные подтипы IFN обладают различной эффективностью в избирательной активации подмножеств иммунных клеток для запуска противовирусной иммунной активности, приводящей к выработке устойчивой В- и Т-клеточной памяти [78]. Вскоре после первоначального открытия IFN-λ в некоторых сообщениях было высказано предположение, что IFN-λ может регулировать хелперные Т-клетки и подавлять экспрессию IL-4 и IL-13 в отсутствие ответа IFN-γ [79, 80]. Несмотря на смещение пролиферации Th2 / Th3 в сторону фенотипа Th2, общие однонуклеотидные полиморфизмы в генах IFN-λ и его рецепторных α-субъединиц влияют на передачу сигналов IFN-λ и, таким образом, модулируют баланс Th2 / Th3 и ухудшают терапевтический эффект лечения IFN во время инфекций. [81-83].Вместе с недавним сообщением о том, что IFN-λ блокирует превращение Т-клеток центральной памяти в эффекторные Т-клетки памяти, эти результаты предполагают, что IFN-λ может регулировать наиболее благоприятную среду Т-клеток путем предотвращения дифференцировки Th3 и, следовательно, поддерживать оптимальную адаптивную среду. противовирусный иммунный ответ для борьбы с вирусными инфекциями.
Будущие тенденции применения для клинического лечения
На основании литературы о IFN-λ в настоящее время хорошо установлено, что IFN-λ играет ключевую роль в врожденных / адаптивных иммунных ответах и является лекарством будущего против хронических вирусных инфекций.Эта область срочно требует дальнейшего изучения как базовой биологии, так и терапевтической противовирусной активности IFN-λ. Например, так много исследований улучшили наше понимание эффектов различных подтипов IFN-λ на выведение инфекции HCV [84–89]. Однако остается путаница в отношении влияния подтипов IFN-λ на иммунный ответ на вирусные инфекции. Даже несмотря на то, что пациенты, инфицированные HCV с аллелем IFNL4-ΔG, обычно не избавляются от инфекции HCV, а IFN-λ4 секретируется лишь незначительно, эти пациенты имеют более низкую вирусную нагрузку HCV без лечения [10].Совсем недавно было сообщено, что генетические варианты в IFNL4 обладают различной эффективностью в устранении инфекции HCV в китайской популяции хань [90]. В частности, остается неясным, существует ли взаимосвязь между противовирусными иммунными ответами моделей мышей с инвазивной инфекцией ВГС и отсутствием цитокинов (IFN-λ1 или IFN-λ4) [91]. Такие знания могут выявить новые пути улучшения подтипов IFN-λ при разработке вакцин против ВГС. Из-за частично перекрывающихся сигнальных путей (RIG-I, MDA5 и MAVS), опосредованных IFN типа I и типа III, парадоксальная иммунная активность может осуществляться двумя типами IFN.Независимо от подтипов IFN, RIG-I активирует две различные категории ISG, одну JAK-STAT-зависимую, а другую JAK-STAT-независимую, которые согласованно вносят вклад в противовирусный иммунный ответ на инфекцию HEV [92]. Однако стойкая активация JAK-STAT-зависимого сигнального пути позволяет HEV-инфицированным клеткам противостоять экзогенному воздействию IFN, в то время как истощение рецепторов IFN-λ или MAVS (митохондриальный антивирусный сигнальный белок) приводит к противовирусному иммунному ответу, индуцированному IFN, предполагая, что постоянное присутствие IFN-λ способствует возникновению инфекции HEV [93].Вместе с недавним сообщением о противовирусной иммунной активности, опосредованной IFN-λ, нам все еще не хватает важной информации об основных функциях IFN-λ. Какова молекулярная природа взаимодействий между цитокином и рецептором? Совсем недавно кристаллизованный тройной комплекс (комплекс IFN-λ-IL28Ra-IL-10R2) подчеркивает пластичность передачи сигналов IFN-λ и его терапевтический потенциал [94]. Лучшее понимание взаимодействия между IFN-λ и его рецепторами может пролить свет на то, что активирует передачу сигналов, а также может способствовать развитию цитокинов с измененной функцией.Что касается передачи сигналов, опосредованной IFN-λ, то в настоящее время известно, что IFN I и III типов индуцируют сходные пути передачи сигналов. Несмотря на то, что JAK-STAT-зависимая передача сигнала осуществляется IFN как I, так и III типа, у нас все еще очень ограниченные знания о других активируемых IFN-λ путях, которые могут потенциально влиять на иммунную активность IFN-λ.
Для связи между врожденным иммунным ответом и IFN-λ необходимы дальнейшие исследования относительного вклада полиморфизмов IFNL в иммунную защиту хозяина.Например, недавно сообщалось, что полиморфизмы IFNL3 и IRF7 могут модулировать иммунный ответ против HSV-1 при болезни Альцгеймера [95] и что полиморфизмы IFNL3 также играют роль в иммунном ответе на терапию IFN у пациентов с хроническим HBV и HCV [ 96, 97], предполагая, что генетический полиморфизм IFNL3 может играть очевидную роль во врожденной защите. Что касается роли IFN-λ в адаптивном иммунном ответе, нам необходимо определить, какие клетки адаптивной иммунной системы отвечают на IFN-λ, и роль эндогенного IFN-λ в поддержании и развитии оптимальных адаптивных иммунных ответов на противостоять вирусной инфекции.Соответствующие исследования могут внести вклад в разработку терапевтических препаратов IFN-λ и адъювантов для вакцин, связанных с IFN-λ.
Заключение
В заключение, IFN типа III были идентифицированы как новый класс цитокинов, которые представляют собой специализированные вирус-индуцированные IFN с иммунными и биологическими функциями, как перекрывающимися с IFN типа I, так и отличными от них. Лучшее понимание связанных функций и взаимодействий между различными противовирусными системами в иммунной системе может помочь исследователям в разработке терапевтических методов или иммунных регуляторов, включающих IFN-λ, для вторжения вирусных патогенов в организме хозяина и установления долговременного иммунитета без чрезмерного воздействия. активация воспаления.
Благодарности
Работа поддержана Национальным фондом естественных наук Китая (№ 31302100; 31700763; 81760287).
Заявление о раскрытии информации
Все авторы заявляют, что у них нет конкурирующих интересов.
Список литературы
- Гарсия-Састре А., Бирон, Калифорния: Интерфероны типа 1 и отношения вирус-хозяин: урок разрядки.Наука 2006; 312: 879-882.
- Мальмгаард Л. Индукция и регулирование интерферонов при вирусных инфекциях. J Interferon Cytokine Res 2004; 24: 439-454.
- Айзекс А., Линденманн Дж .: Вмешательство вирусов.I. Интерферон. Авторы A. Isaacs и J. Lindenmann, 1957. J. Interferon Res 1987; 7: 429-438.
- Самуэль CE: Противовирусное действие интерферонов. Clin Microbiol Rev 2001; 14: 778-809.
- Hamana A, Takahashi Y, Uchida T, Nishikawa M, Imamura M, Chayama K, Takakura Y: Оценка противовирусного эффекта интерферонов I, II и III типа на противовирусный устойчивый вирус гепатита C прямого действия.Antiviral Res 2017; 146: 130-138.
- Котенко С.В., Галлахер Г., Баурин В.В., Льюис-Антес А., Шен М., Шах Н.К., Лангер Дж. А., Шейх Ф., Диккеншитс Х., Доннелли Р.П.: IFN-лямбды опосредуют противовирусную защиту через отдельный рецепторный комплекс цитокинов класса II. Nat Immunol 2003; 4: 69-77.
- Шеппард П., Киндсфогель В., Сюй В., Хендерсон К., Шлуцмайер С., Уитмор Т. Е., Куэстнер Р., Гарригес Ю., Биркс С., Рорабак Дж., Острандер С., Донг Д., Шин Дж., Преснелл С., Фокс Б., Холдеман Б., Купер И. , Taft D, Gilbert t, Grant FJ et al .: IL-28, IL-29 и их рецептор цитокинов класса II IL-28R.Nat Immunol 2003; 4: 63-68.
- Прокунина-Олссон Л., Мучмор Б., Тан В., Пфайффер Р. М., Парк Х, Диккеншитс Х, Херготт Д., Портер-Гилл П., Муми А., Кохар I, Чен С., Бренд N, Тарвей М., Лю Л., Шейх Ф, Астемборски J, Бонковский HL, Эдлин BR, Howell CD, Morgan TR и др.: Вариант выше IFNL3 (IL28B), создающий новый ген интерферона IFNL4, связан с нарушением клиренса вируса гепатита C.Nat Genet 2013; 45: 164-171.
- Паладино П., Каммингс Д. Т., Нойс Р. С., Моссман К. Л.: IFN-независимый ответ на проникновение вирусной частицы обеспечивает первую линию противовирусной защиты, которая не зависит от TLR и гена, индуцируемого ретиноевой кислотой I. J Immunol 2006; 177: 8008-8016.
- О’Брайен Т.Р., Прокунина-Олссон Л., Доннелли Р.П.: IFN-lambda4: парадоксальный новый член семейства интерфероновых лямбда.J Interferon Cytokine Res 2014; 34: 829-838.
- de Weerd NA, Nguyen T: Интерфероны и их рецепторы — распределение и регуляция. Immunol Cell Biol 2012; 90: 483-491.
- Hamming OJ, Terczynska-Dyla E, Vieyres G, Dijkman R, Jorgensen SE, Akhtar H, Siupka P, Pietschmann T., Thiel V, Hartmann R: сигналы интерферона лямбда 4 через рецептор IFNlambda для регулирования противовирусной активности против HCV и коронавирусов.EMBO J 2013; 32: 3055-3065.
- Като Х, Такеучи О, Сато С., Ёнеяма М., Ямамото М., Мацуи К., Уэмацу С., Юнг А., Кавай Т., Исии К.Дж., Ямагути О, Оцу К., Цудзимура Т., Кох К.С., Рейс и Соуза К., Мацуура Ю., Fujita T, Akira S: Различная роль геликаз MDA5 и RIG-I в распознавании РНК-вирусов.Природа 2006; 441: 101-105.
- Йонеяма М., Кикучи М., Нацукава Т., Синобу Н., Имаидзуми Т., Миягиши М., Тайра К., Акира С., Фудзита Т.: РНК-геликаза RIG-I играет важную роль в индуцированных двухцепочечной РНК врожденных противовирусных реакциях. Нат Иммунол 2004; 5: 730-737.
- Alexopoulou L, Holt AC, Medzhitov R, Flavell RA: Распознавание двухцепочечной РНК и активация NF-kappaB с помощью Toll-подобного рецептора 3.Nature 2001; 413: 732-738.
- Diebold SS, Kaisho T, Hemmi H, Akira S, Reis e Sousa C. Врожденные противовирусные реакции посредством TLR7-опосредованного распознавания одноцепочечной РНК. Наука 2004; 303: 1529-1531.
- Heil F, Hemmi H, Hochrein H, Ampenberger F, Kirschning C, Akira S, Lipford G, Wagner H, Bauer S: Видоспецифическое распознавание одноцепочечной РНК через толл-подобные рецепторы 7 и 8.Наука 2004; 303: 1526-1529.
- Ким К., Хайрутдинов Б.И., Ли С.К., Чеонг Х.К., Кан С.В., Пак Х., Ли С., Ким Ю.Г., Джи Дж., Рич А., Ким К.К., Чон Й.Х .: Структура раствора домена Zbeta ДНК-зависимого активатора IFN человека. -регуляторные факторы и способы их связывания с B- и Z-ДНК.Proc Natl Acad Sci USA 2011; 108: 6921-6926.
- Takaoka A, Wang Z, Choi MK, Yanai H, Negishi H, Ban T, Lu Y, Miyagishi M, Kodama T, Honda K, Ohba Y, Taniguchi T: DAI (DLM-1 / ZBP1) — датчик цитозольной ДНК и активатор врожденного иммунного ответа. Природа 2007; 448: 501-505.
- ДеФилиппис В.Р., Альварадо Д., Сали Т., Ротенбург С., Фру К.: Человеческий цитомегаловирус вызывает ответ интерферона через датчик ДНК ZBP1. J Virol 2010; 84: 585-598.
- Hayashi T, Nishitsuji H, Takamori A, Hasegawa A, Masuda T., Kannagi M: ДНК-зависимый активатор IFN-регуляторных факторов усиливает транскрипцию ВИЧ-1 через NF-kappaB.Microbes Infect 2010; 12: 937-947.
- Ablasser A, Bauernfeind F, Hartmann G, Latz E, Fitzgerald KA, Hornung V: RIG-I-зависимое восприятие поли (dA: dT) посредством индукции РНК-полимеразы III-транскрибируемого промежуточного звена РНК. Нат Иммунол 2009; 10: 1065-1072.
- Chiu YH, Macmillan JB, Chen ZJ: РНК-полимераза III обнаруживает цитозольную ДНК и индуцирует интерфероны типа I через путь RIG-I.Cell 2009; 138: 576-591.
- Fernandes-Alnemri T, Yu JW, Datta P, Wu J, Alnemri ES: AIM2 активирует инфламмасомы и гибель клеток в ответ на цитоплазматическую ДНК. Природа 2009; 458: 509-513.
- Hornung V, Ablasser A, Charrel-Dennis M, Bauernfeind F, Horvath G, Caffrey DR, Latz E, Fitzgerald KA: AIM2 распознает цитозольную дцДНК и с ASC формирует воспаление, активирующее каспазу-1.Природа 2009; 458: 514-518.
- Sun L, Wu J, Du F, Chen X, Chen ZJ: Циклическая GMP-AMP-синтаза — это цитозольный ДНК-сенсор, который активирует путь интерферона I типа. Наука 2013; 339: 786-791.
- Като К., Омура Х, Ишитани Р., Нуреки О: Циклический GMP-AMP как эндогенный второй мессенджер в врожденной иммунной передаче сигналов цитозольной ДНК.Annu Rev Biochem 2017; 86: 541-566.
- Compan V, Martin-Sanchez F, Baroja-Mazo A, Lopez-Castejon G, Gomez AI, Verkhratsky A, Brough D, Pelegrin P: связанный с апоптозом пятнышкообразный белок, содержащий CARD, образует пятнышки, но не активирует каспазу-1 в отсутствие NLRP3 при набухании макрофагов.J Immunol 2015; 194: 1261-1273.
- Sagulenko V, Thygesen SJ, Sester DP, Idris A, Cridland JA, Vajjhala PR, Roberts TL, Schroder K, Vince JE, Hill JM, Silke J, Stacey KJ: Инфламмасомы AIM2 и NLRP3 активируют пути апоптотической и пироптотической смерти через ASC. Cell Death Differ 2013; 20: 1149-1160.
- Унтерхольцнер Л: Реакция интерферона на внутриклеточную ДНК: почему так много рецепторов? Иммунобиология 2013; 218: 1312-1321.
- Свецки М., Колонна М.: Интерфероны типа I: разнообразие источников, пути производства и влияние на иммунные ответы.Curr Opin Virol 2011; 1: 463-475.
- Genin P, Vaccaro A, Civas A: роль дифференциальной экспрессии человеческого интерферона-генов в противовирусном иммунитете. Cytokine Growth Factor Rev 2009; 20: 283-295.
- Хонда К., Янаи Х, Негиси Х, Асагири М., Сато М., Мизутани Т., Шимада Н., Охба Й, Такаока А, Йошида Н., Танигути Т.: IRF-7 является главным регулятором интерферон-зависимых иммунных ответов типа I.Природа 2005; 434: 772-777.
- Мари I, Дурбин JE, Леви DE: Дифференциальная вирусная индукция отдельных генов интерферона-альфа посредством положительной обратной связи через фактор регуляции интерферона-7. EMBO J 1998; 17: 6660-6669.
- Оногути К., Йонеяма М., Такемура А., Акира С., Танигучи Т., Намики Х., Фудзита Т.: вирусные инфекции активируют гены интерферона I и III типов посредством общего механизма.J Biol Chem 2007; 282: 7576-7581.
- Osterlund PI, Pietila TE, Veckman V, Kotenko SV, Julkunen I. Члены семейства регуляторных факторов IFN по-разному регулируют экспрессию генов IFN типа III (IFN-лямбда). J Immunol 2007; 179: 3434-3442.
- Томсон С.Дж., Го Ф.Г., Бэнкс Х., Краусгрубер Т., Котенко С.В., Фоксвелл Б.М., Удалова И.А.: Роль мобильных элементов в регуляции экспрессии гена IFN-lambda1.Proc Natl Acad Sci USA 2009; 106: 11564-11569.
- Iversen MB, Ank N, Melchjorsen J, Paludan SR: Экспрессия интерферона типа III (IFN) в слизистой оболочке влагалища опосредуется в основном дендритными клетками и проявляет более сильную зависимость от NF-kappaB, чем IFN типа I. J Virol 2010; 84: 4579-4586.
- Ank N, Iversen MB, Bartholdy C, Staeheli P, Hartmann R, Jensen UB, Dagnaes-Hansen F, Thomsen AR, Chen Z, Haugen H, Klucher K, Paludan SR: важная роль интерферона III типа (IFN-lambda / IL-28) с TLR-индуцированной противовирусной активностью. J Immunol 2008; 180: 2474-2485.
- Ank N, West H, Bartholdy C, Eriksson K, Thomsen AR, Paludan SR: Лямбда-интерферон (IFN-lambda), IFN типа III, индуцируется вирусами и IFN и проявляет мощную противовирусную активность против некоторых вирусных инфекций in vivo.J Virol 2006; 80: 4501-4509.
- Дурбин Р.К., Котенко С.В., Дурбин Ю.Е.: Индукция и функция интерферона на поверхности слизистой оболочки. Immunol Rev 2013; 255: 25-39.
- Старк Г. Р., Керр И. М., Уильямс Б. Р., Сильверман Р. Х., Шрайбер Р. Д.: Как клетки реагируют на интерфероны.Annu Rev Biochem 1998; 67: 227-264.
- Ank N, West H, Paludan SR: IFN-lambda: новые противовирусные цитокины. J Interferon Cytokine Res 2006; 26: 373-379.
- Gad HH, Dellgren C, Hamming OJ, Vends S, Paludan SR, Hartmann R: Интерферон-лямбда функционально является интерфероном, но структурно связан с семейством интерлейкинов-10.J Biol Chem 2009; 284: 20869-20875.
- Микнис З.Дж., Маграчева Э., Ли В., Зданов А., Котенко С.В., Влодавер А: Кристаллическая структура человеческого интерферона-лямбда1 в комплексе с его высокоаффинным рецептором интерферон-лямбдаR1. J Mol Biol 2010; 404: 650-664.
- Marcello T, Grakoui A, Barba-Spaeth G, Machlin ES, Kotenko SV, MacDonald MR, Rice CM: Интерфероны альфа и лямбда ингибируют репликацию вируса гепатита С с помощью четкой кинетики трансдукции сигнала и регуляции генов.Гастроэнтерология 2006; 131: 1887-1898.
- Zhou Z, Hamming OJ, Ank N, Paludan SR, Nielsen AL, Hartmann R: Интерферон III типа (IFN) индуцирует IFN-подобный ответ I типа в ограниченном подмножестве клеток через сигнальные пути, включающие как путь Jak-STAT, так и митоген-активируемые протеинкиназы.J Virol 2007; 81: 7749-7758.
- Робек М.Д., Бойд Б.С., Чисари Ф.В.: Лямбда-интерферон подавляет репликацию вирусов гепатита В и С. J Virol 2005; 79: 3851-3854.
- Хоу В., Ван X, Е Л., Чжоу Л., Ян З. К., Ридель Э, Хо В. З.: Лямбда-интерферон подавляет инфицирование макрофагов вирусом иммунодефицита человека 1 типа.J Virol 2009; 83: 3834-3842.
- Mordstein M, Kochs G, Dumoutier L, Renauld JC, Paludan SR, Klucher K, Staeheli P: Интерферон-лямбда способствует врожденному иммунитету мышей против вируса гриппа A, но не против гепатотропных вирусов. PLoS Pathog 2008; 4: e1000151.
- Дуам Ф., Сото Альбрехт Ю.Е., Хребикова Г., Садимин Е., Дэвидсон С., Котенко С.В., Плосс А: Интерферон-опосредованная передача сигналов типа III имеет решающее значение для борьбы с живой ослабленной вирусной инфекцией желтой лихорадки in vivo.MBio 2017; 8: e00819-17.
- Boisvert M, Shoukry NH: Интерфероны типа III при вирусной инфекции гепатита С. Фронт Иммунол 2016; 7: 628.
- Davidson S, McCabe TM, Crotta S, Gad HH, Hessel EM, Beinke S, Hartmann R, Wack A: IFNlambda является мощным противогриппозным терапевтическим средством без побочных воспалительных эффектов лечения IFNalpha.EMBO Mol Med 2016; 8: 1099-1112.
- Lazear HM, Daniels BP, Pinto AK, Huang AC, Vick SC, Doyle SE, Gale M., Jr Klein RS, Diamond MS: Интерферон-лямбда ограничивает нейроинвазию вируса Западного Нила, ужесточая гематоэнцефалический барьер. Sci Transl Med 2015; 7: 284ra259.
- Ли С., Болдридж MT: Интерферон-лямбда: мощный регулятор кишечных вирусных инфекций.Фронт Иммунол 2017; 8: 749.
- Lalle E, Bordi L, Caglioti C, Garbuglia AR, Castilletti C, Taibi C, Cristofari F, Capobianchi MR: повышенная регуляция IFN-альфа-рецептора-1 в PBMC от пациентов, ранее не инфицированных HCV, несущих генотип cc. возможная роль IFN-лямбда. PLoS One 2014; 9: e.
- Lazear HM, Nice TJ, Diamond MS: Интерферон-лямбда: иммунные функции на барьерных поверхностях и за их пределами.Иммунитет 2015; 43: 15-28.
- Sommereyns C, Paul S, Staeheli P, Michiels T: IFN-лямбда (IFN-лямбда) экспрессируется тканезависимым образом и в первую очередь действует на эпителиальные клетки in vivo. PLoS Pathog 2008; 4: e1000017.
- Stiff A, Carson W: Исследования интерферона-лямбда для лечения рака.J Innate Immun 2015; 7: 243-250.
- Йошио С., Канто Т., Курода С., Мацубара Т., Хигаситани К., Какита Н., Исида Х., Хирамацу Н., Нагано Х, Сугияма М., Мурата К., Фукухара Т., Мацуура Ю., Хаяси Н., Мизоками М., Такехара Т.: Человеческая кровь дендритные клетки антиген 3 (BDCA3) (+) дендритные клетки являются мощным продуцентом интерферона-лямбда в ответ на вирус гепатита С.Гепатология 2013; 57: 1705-1715.
- Бартлетт Н.В., Буттигег К., Котенко С.В., Смит Г.Л.: Лямбды мышиного интерферона (интерфероны типа III) проявляют мощную противовирусную активность in vivo на модели поксвирусной инфекции. J Gen Virol 2005; 86: 1589-1596.
- Jagger BW, Miner JJ, Cao B, Arora N, Smith AM, Kovacs A, Mysorekar IU, Coyne CB, Diamond MS: гестационная стадия и передача сигналов IFN-лямбда регулируют инфекцию ZIKV в утробе матери.Cell Host Microbe 2017; 22: 366-376.
- Kim BJ, Cho SW, Jeon YJ, An S, Jo A, Lim JH, Kim DY, Won TB, Han DH, Rhee CS, Kim HJ: Интраназальная доставка ДНК Duox2 с использованием катионного полимера может предотвратить острую вирусную инфекцию гриппа A in vivo легкое. Appl Microbiol Biotechnol. 2018; 102: 105-115.
- Mordstein M, Neugebauer E, Ditt V, Jessen B, Rieger T, Falcone V, Sorgeloos F, Ehl S, Mayer D, Kochs G, Schwemmle M, Gunther S, Drosten C, Michiels T, Staeheli P: интерферон лямбда визуализирует эпителиальные клетки респираторного и желудочно-кишечного трактов, устойчивых к вирусным инфекциям.J Virol 2010; 84: 5670-5677.
- Johnson TR, Mertz SE, Gitiban N, Hammond S, Legallo R, Durbin RK, Durbin JE: Роль врожденных IFNs в определении иммунопатологии респираторно-синцитиального вируса. J Immunol 2005; 174: 7234-7241.
- Karst SM, Wobus CE, Lay M, Davidson J, Virgin HWt: STAT1-зависимый врожденный иммунитет к норволк-подобному вирусу.Наука 2003; 299: 1575–1578.
- Katze MG, He Y, Gale M, Jr: Вирусы и интерферон: борьба за превосходство. Nat Rev Immunol 2002; 2: 675-687.
- Bandi P, Pagliaccetti NE, Robek MD: Ингибирование активности интерферона типа III иммуномодулирующими белками ортопоксвируса.J Interferon Cytokine Res 2010; 30: 123-134.
- He F, Melen K, Maljanen S, Lundberg R, Jiang M, Osterlund P, Kakkola L, Julkunen I. Белок VP24 эболавируса мешает врожденным иммунным ответам, подавляя экспрессию гена интерферона-лямбда1. Вирусология 2017; 509: 23-34.
- Линд К., Сведин Е., Домсген Е., Капелл С., Лайтинен О, Молл М., Флодстром-Тулберг М.: Вирус Коксаки противостоит врожденному иммунному ответу хозяина, блокируя экспрессию интерферона III типа. J Gen Virol 2016; 97: 1-12.
- Lee S, Wilen CB, Orvedahl A, McCune BT, Kim KW, Orchard RC, Peterson ST, Nice TJ, Baldridge MT, Virgin HW: Тропизм клеток норовируса определяется комбинаторным действием вирусного неструктурного белка и цитокина хозяина.Cell Host Microbe 2017; 22: 449-459.
- Harman AN, Nasr N, Feetham A, Galoyan A, Alshehri AA, Rambukwelle D, Botting RA, Hiener BM, Diefenbach E, Diefenbach RJ, Kim M, Mansell A, Cunningham AL: ВИЧ блокирует индукцию интерферона в дендритных клетках человека и макрофагах Нарушение регуляции TBK1.J Virol 2015; 89: 6575-6584.
- Mennechet FJ, Uze G: Дендритные клетки, обработанные интерфероном лямбда, специфически индуцируют пролиферацию FOXP3-экспрессирующих супрессорных Т-клеток. Кровь 2006; 107: 4417-4423.
- Li Y, Gao Q, Yuan X, Zhou M, Peng X, Liu X, Zheng X, Xu D, Li M: аденовирус, экспрессирующий IFN-lambda1 (IL-29), ослабляет аллергическое воспаление дыхательных путей и гиперреактивность дыхательных путей при экспериментальной астме.Инт Иммунофармакол 2014; 21: 156-162.
- Morrow MP, Pankhong P, Laddy DJ, Schoenly KA, Yan J, Cisper N, Weiner DB: сравнительная способность IL-12 и IL-28B регулировать популяции Treg и повышать адаптивный клеточный иммунитет. Кровь 2009; 113: 5868-5877.
- Larypoor M, Bayat M, Zuhair MH, Akhavan Sepahy A, Amanlou M: Оценка количества Treg-клеток CD4 (+) CD25 (+) FoxP3 (+) у нормальных мышей, подвергшихся действию AFB1 и обработанных экстрактом старого чеснока.Cell J 2013; 15: 37-44.
- Maj T, Wang W, Crespo J, Zhang H, Wei S, Zhao L, Vatan L, Shao I, Szeliga W, Lyssiotis C, Liu JR, Kryczek I, Zou W: Окислительный стресс контролирует апоптоз регуляторных Т-клеток и активность супрессоров и Устойчивость к PD-L1-блокаде в опухоли. Nat Immunol.2017; 18: 1332.
- Берри CM: Понимание терапии подтипа интерферона при вирусных инфекциях: использование силы врожденной иммунной системы. Cytokine Growth Factor Rev 2016; 31: 83-90.
- Dai J, Megjugorac NJ, Gallagher GE, Yu RY, Gallagher G: IFN-lambda1 (IL-29) ингибирует экспрессию GATA3 и подавляет ответы Th3 в человеческих наивных Т-клетках и Т-клетках памяти.Кровь 2009; 113: 5829-5838.
- Джордан В.Дж., Эскдейл Дж., Сринивас С., Пекарек В., Келнер Д., Родия М., Галлахер Г.: Человеческий интерферон лямбда-1 (IFN-lambda1 / IL-29) модулирует ответ Th2 / Th3. Genes Immun 2007; 8: 254-261.
- Бхушан А., Гош С., Бхаттачарджи С., Чиннасвами С. Смешение с помощью однонуклеотидного полиморфизма rs117648444 (P70S) влияет на ассоциацию вариантов локуса интерферона лямбда с ответом на терапию интерферон-альфа-рибавирином у пациентов с вирусным гепатитом с хроническим генотипом инфекции.J Interferon Cytokine Res 2017; 37: 369-382.
- Эгли А., Сантер Д.М., О’Ши Д., Тиррелл Д.Л., Хоутон М.: Влияние семейства интерферонов-лямбда на врожденный и адаптивный иммунный ответ на вирусные инфекции. Emerg Microbes Infect 2014; 3: e51.
- Hegazy AN, Peine M, Helmstetter C, Panse I, Frohlich A, Bergthaler A, Flatz L, Pinschewer DD, Radbruch A, Lohning M: Интерфероны направляют перепрограммирование клеток Th3 для создания стабильного GATA-3 (+) T-бет (+ ) подмножество клеток с комбинированными функциями клеток Th3 и Th2.Иммунитет 2010; 32: 116-128.
- Griffiths SJ, Dunnigan CM, Russell CD, Haas JG: Роль полиморфизмов интерферон-лямбда-локуса в гепатите C и других инфекционных заболеваниях. J Innate Immun 2015; 7: 231-242.
- Hermant P, Michiels T: Интерферон-лямбда в контексте вирусных инфекций: продукция, ответ и терапевтические последствия.J Innate Immun 2014; 6: 563-574.
- Лейдлоу С.М., Дастин Л.Б.: Интерферон-лямбда: возможности, риски и неопределенности в борьбе с ВГС. Фронт Иммунол 2014; 5: 545.
- Nguyen LT, Van Nguyen D, Carr MJ, Hall WW, Nguyen LA: Ассоциация полиморфизмов лямбда-интерферона с повышенными исходными вирусными нагрузками при хронической инфекции вируса гепатита C генотипа 6.Arch Virol. 2018; 163: 115-124.
- Сахаи Ф., Газанфари М., Вазири Ф., Джамнани Ф.Р., Давари М., Гарибзаде С., Фатех Р., Абдолрахими Ф., Дизаджи С.П., Фатех А., Сиадат С.Д .: Влияние генетической изменчивости генов IL28B, IFNL4 и HLA на реакцию на лечение хронических заболеваний. инфекция вирусом гепатита С.Infect Genet Evol 2017; 54: 330-337.
- Wieczorek-Godlewska R, Ploski R, Perkowska-Ptasinska A, Tronina O, Sadowska A, Pacholczyk M, Lisik W., Durlik M: Влияние полиморфизма интерферона лямбда-3 реципиента и донора на течение инфекции ВГС после трансплантации печени.Clin Exp Hepatol 2017; 3: 152-158.
- Хуанг П, Яо Й, Юэ М., Тиан Т, Чен Х, Чен М., Ван Дж, Чжан И, Ю Р: Генетические варианты интерферона-лямбда 4 влияют на клиренс ВГС в китайской ханьской популяции. Sci Rep 2017; 7: 42408.
- Ласфар А., Злоза А., Коэн-Солал К.А.: IFN-лямбда-терапия: текущее состояние и перспективы на будущее.Drug Discov Today 2016; 21: 167-171.
- Xu L, Wang W, Li Y, Zhou X, Yin Y, Wang Y, de Man RA, van der Laan LJW, Huang F, Kamar N, Peppelenbosch MP, Pan Q: RIG-I — ключевой антивирусный ген, стимулируемый интерфероном. против вируса гепатита Е независимо от выработки интерферона. Гепатология 2017; 65: 1823-1839.
- Инь X, Ли X, Амбардекар C, Ху Z, Lhomme S, Feng Z: вирус гепатита E сохраняется в присутствии интерферонового ответа типа III. PLoS Pathog 2017; 13: e1006417.
- Mendoza JL, Schneider WM, Hoffmann HH, Vercauteren K, Jude KM, Xiong A, Moraga I, Horton TM, Glenn JS, de Jong YP, Rice CM, Garcia KC: комплекс IFN-lambda-IFN-lambdaR1-IL-10Rbeta Выявлены структурные особенности, лежащие в основе функциональной пластичности IFN типа III.Иммунитет 2017; 46: 379-392.
- Costa AS, Agostini S, Guerini FR, Mancuso R, Zanzottera M, Ripamonti E, Racca V, Nemni R, Clerici M: Модуляция иммунных ответов на вирус простого герпеса типа 1 с помощью полиморфизмов IFNL3 и IRF7: исследование болезни Альцгеймера. J Alzheimers Dis 2017; 60: 1055-1063.
- Индольфи Г., Аззари С., Рести М.: Полиморфизмы в гене IFNL3 / IL28B и гепатит С: от взрослых к детям. World J Gastroenterol 2014; 20: 9245-9252.
- Lin Z, Zhang J, Ma X, Yang S, Tian N, Lin X, Zhou S, Liu L, Gao Y: Роль генетических полиморфизмов интерферона лямбда 3 в ответ на терапию интерфероном у пациентов с хроническим гепатитом B: обновленная информация Анализ.Hepat Mon 2016; 16: e37534.
Автор Контакты
Юнхао Ху и Синь Цао
Колледж ветеринарной медицины,
Ганьсуский сельскохозяйственный университет Ланьчжоу, 730000, Ганьсу (Китай)
Электронная почта [email protected]; [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 14 апреля 2018 г.
Дата принятия: 7 ноября 2018 г.
Опубликована онлайн: 15 ноября 2018 г.
Дата выпуска: ноябрь 2018 г.
Количество страниц для печати: 13
Количество рисунков: 2
Количество столов: 0
ISSN: 1015-8987 (печатный)
eISSN: 1421-9778 (онлайн)
Для дополнительной информации: https: // www.karger.com/CPB
Лицензия открытого доступа / Дозировка лекарства / Заявление об ограничении ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененных материалов требует письменного разрешения. Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Роль интерферонов типа I в гриппе: противовирусные супергерои или иммунопатогенные злодеи? — FullText — Журнал врожденного иммунитета 2020, Vol.12, № 6
Аннотация
Важная роль интерферонов (IFN) в противовирусной защите врожденного иммунитета хорошо известна. Хотя рекомбинантный IFN-α был одобрен для лечения рака и хронических вирусных инфекций регулирующими органами многих стран, начиная с 1986 г., IFNs не одобрены для лечения инфекции, вызванной вирусом гриппа A (IAV). Частично это связано с комплексным действием интерферонов при острой гриппозной инфекции. IAV атакует респираторную систему человека и вызывает значительную заболеваемость и смертность во всем мире.Во время инфекции гриппа, в зависимости от штамма IAV и отдельного хозяина, IFN типа I могут оказывать защитное противовирусное действие или вносить вклад в иммунопатологию. В контексте вирусной инфекции иммунная система имеет сложные механизмы, регулирующие экспрессию и эффекты IFN типа I, чтобы максимизировать противовирусный ответ за счет как активации, так и усиления полезной функции врожденных клеток, ограничивая иммунопатологические ответы, которые приводят к преувеличенному повреждению тканей. В этом обзоре мы суммируем сложную, но важную роль IFN типа I в инфекциях гриппа.Это включает как защитные, так и вредные эффекты этих важных цитокинов во время инфекции.
© 2020 Автор (ы) Опубликовано S. Karger AG, Базель
Введение
Вирус гриппа A (IAV) является членом семейства Orthomyxoviridae и представляет собой оболочечный вирус с отрицательной цепью РНК, вызывающий значительную заболеваемость и смертность во всем мире. Эпителиальные клетки верхних дыхательных путей являются основными мишенями IAV после преодоления местных защитных сил, включая слизистую, содержащую сиаловую кислоту, в эпителиальной выстилочной жидкости.В то время как вирус реплицируется в эпителиальных клетках, вирус также распространяется на непермиссивные иммунные клетки, такие как макрофаги и дендритные клетки (ДК), в дыхательных путях легких [1, 2]. В этих инфицированных клетках вирус распознается 3 семействами рецепторов распознавания образов (PRR): Toll-подобными рецепторами (TLR), RIG-I-подобными геликазами (RLR) и нуклеотид-связывающим доменом и белками, содержащими богатые лейцином повторы. (NLR). Распознавание и связывание вирус-специфических нуклеиновых кислот с помощью PRR вызывает продукцию и секрецию интерферонов (IFN) и провоспалительных цитокинов, которые являются критическими компонентами противовирусного ответа у млекопитающих.IFN являются основными цитокинами, экспрессируемыми во время ответа хозяина, с противовирусным, антипролиферативным и иммуномодулирующим действием на вирусную или бактериальную инфекцию. Помимо их роли в ограничении инфекции, IFN также участвуют как в иммунном надзоре за раком, так и в аутоиммунной системе [3, 4].
IFN могут продуцироваться практически всеми ядросодержащими клетками позвоночных и классифицируются как IFN типа I, типа II или типа III в соответствии с их генетическими, структурными и функциональными характеристиками и специфическими рецепторами на поверхности клетки [5].В 1957 году Линденманн и др. [6] открыли вещество, защищающее клетки от инфекции IAV, — они назвали его интерфероном [6]. У людей и мышей IFN типа I состоят из 19 белков IFN: 14 подтипов IFN-α (от IFN-α1 до α14), IFN-ω, IFN-, IFN-τ, IFN-κ и IFN-β. IFN-α и IFN-β могут экспрессироваться почти каждым типом клеток [7, 8]. Семейство IFN типа II представлено продуктом одного гена, IFN-γ, и в основном продуцируется Т-лимфоцитами и естественными киллерными (NK) клетками [9, 10]. IFN типа III включают 4 подтипа, IFN-λ1, IFN-λ2, IFN-λ3 и IFN-λ4, а также экспрессируются во множестве типов клеток [11, 12].
ИАВ являются сильными индукторами всех типов ИФН на различных стадиях инфекции [13]. В этом обзоре мы сосредоточимся на роли IFN типа I, индуцируемых во время инфекции IAV, поскольку врожденные и адаптивные иммунные ответы на IAV у млекопитающих в значительной степени зависят от IFN типа I.
Ингибирование IFN типа I репликации IAV
IFN типа I при инфицировании IAV стимулирует экспрессию сотен генов, которые в целом известны как интерферон-стимулированные гены (ISG), которые действуют для уничтожения вируса и предотвращения его распространения путем стимулирования противовирусное состояние в соседних клетках (рис.1). Все ISG демонстрируют одинаковую характерную структуру спиральных цитокинов с пучком из 4 α-спиралей, организованных в конфигурации «вверх-вверх-вниз-вниз», а также содержат дополнительную отдельную α-спираль [14].
Рис. 1.
Индукция IFN и ISG типа I вирусом гриппа. Врожденные иммунные клетки, такие как макрофаги и эпителиальные клетки легких, продуцируют IFN типа I после зондирования геномной РНК IAV с использованием различных PRR. В инфицированных и соседних клетках передача сигналов IFN типа I активирует путь JAK-STAT, приводя к транскрипции ISG, продукты которых инициируют внутриклеточные противовирусные эффекторы, ограничивающие распространение вирусов.ИФН, интерферон; ISG, IFN-стимулированный ген; PRR, рецептор распознавания образов; JAK, киназа Януса; STAT, преобразователь сигнала и активатор транскрипции; TLR, Toll-подобный рецептор; RLR, RIG-I like геликаза; NLR, нуклеотид-связывающий домен и белок, содержащий повторы с высоким содержанием лейцина.
Как секретируемые белки, IFN типа I действуют как межклеточные мессенджеры и оказывают сильные биологические эффекты при чрезвычайно низких концентрациях через рецептор IFN-α / β типа 1 (IFNAR), трансмембранный рецептор клеточной поверхности.IFNAR состоит из 2 субъединиц — IFNAR1 и IFNAR2. Обычно IFNAR подвергаются эндоцитозу и активируют связанные с ними тирозинкиназы Tyk2 и Jak1 [15] с последующим связыванием IFN типа I. Jak1 активирует преобразователь сигнала и активатор транскрипции (STAT) 1 путем фосфорилирования. Этот классический сигнальный каскад приводит к образованию IFN-стимулированного генного фактора 3 (ISGF3), комплекса фосфорилированных STAT1 и STAT2 с IRF9. Активация ISGF3 приводит к повышенной экспрессии более 100 ISG, включая 2 ‘, 5’-олигоаденилатсинтетазу (OAS), Mx белки, интерферон-индуцированный трансмембранный белок 3 (IFITM3) и протеинкиназу R (PKR), вызывая противовирусное состояние [16].
Роль IFN типа I в патогенезе IAV сложна. Например, у мышей, генетически лишенных передачи сигналов IFN типа I, клиренс IAV был неэффективным [17, 18]. При профилактическом применении IFN типа I снижает репликацию IAV и тяжесть заболевания как у животных [19], так и у людей [20]. Вовлечение IFN-ответа типа I до инфицирования может быть терапевтической стратегией для контроля инфекции IAV в различных моделях животных, но, конечно, имеет ограниченное практическое применение [21, 22].
Эксперименты с заражением 2 различными штаммами IAV выявили значительное снижение выживаемости и повышение титров вируса в легких мышей с дефицитом IFN-β, демонстрируя, что IFN-β способствует врожденному иммунитету против IAV [18].Поскольку белок STAT1 необходим для передачи сигналов от IFN типа I, животные STAT1 — / — в 100 раз более чувствительны к летальной инфекции A / WSN / 33 (h2N1) IAV, чем их аналоги дикого типа (WT) [23]. Кроме того, как показано группой Гарсиа-Састре [23], LD 50 вируса IAV PR8 была в 10 раз ниже у мышей STAT1 — / -, чем у мышей WT. In vitro WSN33 реплицируется с высокими титрами в фибробластах STAT1 — / — или IFNAR — / -, тогда как клетки, полученные от животных WT, устойчивы к инфекции IAV [23]. Однако эти результаты не были напрямую переведены на модели in vivo с использованием IFNAR — / — мышей другими группами.Титры X31 (h4N2) IAV в легких мышей с дефицитом IFNAR существенно не отличались от контрольных мышей дикого типа, а мыши IFNAR — / — и мыши дикого типа были сравнительно восприимчивы к инфекции X31 [24].
Отличная работа Crotta et al. [25] позже объяснили очевидные противоречивые результаты с использованием мышей STAT1 — / — и IFNAR1 — / — во время инфекции IAV [25]. Разница, по-видимому, связана с разными типами эффектов IFN в эпителии легких мышей. IAV были более патогенными и реплицировались с более высокими титрами в легких мышей, лишенных как IFNAR, так и рецептора IFN-λ (IFNLR), чем у мышей с дефектами одного рецептора IFN.При использовании химерных мышей костного мозга с донорами WT и реципиентами с двойным дефицитом IFNAR1 / IFNLR отсутствие передачи сигналов IFN типа I и типа III в стромальном компартменте значительно увеличивало восприимчивость к инфекции гриппа. В частности, когда эти химеры были инфицированы IAV PR8, высокая чувствительность и смертность были обнаружены только в группе, лишенной рецепторов IFN на стромальных клетках, и это коррелировало с более высокими вирусными титрами [25]. Это исследование демонстрирует перекрывающуюся и потенциально компенсаторную функцию IFN типа I и типа III в контроле IAV, поскольку нокаут обоих рецепторов требуется для повышенной восприимчивости к IAV-инфекции.Поскольку активация STAT1 необходима для передачи сигналов через оба рецептора, нокаут STAT1 подавляет функцию путей передачи сигналов IFN как типа I, так и типа III. Таким образом, результаты с использованием химерных двойных нокаутов проясняют путаницу, возникшую из более ранней литературы, в которой сообщалось, что IFN типа I не могут сами по себе учитывать потребность в передаче сигналов STAT1 для защиты от инфекции IAV.
Дополнительные исследования показали, что в отличие от рецепторов IFN типа I, экспрессия функциональных комплексов рецепторов IFN-λ ограничена эпителиальными клетками в легких и кишечном тракте.Следовательно, эффекты IFN типа III могут быть ограничены борьбой с репликацией вируса на поверхности слизистых оболочек из-за ограниченной экспрессии рецепторов IFN-λ [11]. Передача сигналов IFN типа I более важна для ограничения распространения системной инфекции IAV из-за его универсального распределения во всех типах клеток. Эта парадигма эксклюзивного эпителиального действия IFN типа III недавно подверглась сомнению, поскольку другие клетки, такие как нейтрофилы и DC, также реагируют на IFN-λ [26]. С другой стороны, недавняя работа с IAV-инфицированными мышами [27] показала, что IFN-λ продуцируется быстрее, чем IFN типа I, предполагая, что IFN типа III играет неизбыточную роль в подавлении раннего роста вируса в дыхательных путях.IAV быстрее распространяется из носовой полости в легкие у мышей, чья система IFN типа III была дефектной. Инфекции у мышей, которым не хватало IFN типа III, также с большей вероятностью распространялись на других животных. Кроме того, лечение мышей ИФН типа III, но не ИФН типа I, обеспечивало длительную защиту их верхних дыхательных путей от инфекций гриппа и предотвращало распространение вируса [28]. Таким образом, IFN типа III составляет первую линию противовирусного невоспалительного ответа, в то время как IFN типа I могут действовать как реагирующие на вторую линию, а также увеличивать продукцию воспалительных цитокинов в дополнение к противовирусным медиаторам.
IFN-индуцированное воспаление и повреждение тканей типа I
Помимо вышеуказанных противовирусных эффектов, данные также указывают на патогенную роль IFNs типа I во время вирусной инфекции. Во время хронической вирусной инфекции исследования in vivo выявили супрессивные механизмы, участвующие во вредных эффектах интерферонов I типа. Хроническая передача сигналов IFN связана с гипериммунной активацией и прогрессированием заболевания при стойких инфекциях [29]. Существует прямая причинно-следственная связь между передачей сигналов IFN, активацией иммунной системы, экспрессией отрицательного иммунного регулятора, дезорганизацией лимфоидной ткани и персистенцией вируса [30].Поскольку грипп в основном вызывает острую инфекцию, подробности пагубных последствий хронической вирусной инфекции здесь не рассматриваются.
При инфекции высокопатогенным штаммом IAV, таким как пандемический штамм h2N1 1918 г. и птичий штамм H5N1, IAV вызывает пневмонию у людей с прогрессированием до легочной недостаточности и летальным исходом. Обычно наблюдается прогрессирующая первичная вирусная пневмония, при этом вторичная бактериальная пневмония более заметна после вспышки пандемического вируса 1918 года, чем у людей, инфицированных H5N1 [31].Рекомбинантный IAV, несущий гликопротеины гемагглютинина (HA) и нейраминидазы (NA) вируса 1918 года, реконструировали на генетическом фоне штамма h2N1 человека (1918 HA / NA: Tx / 91). Хотя уровни IFN-α в легких были одинаковыми для обеих групп, инфицированных вирусом, хемокины IFN-γ, TNF-α, MIP-1α и MIP-2 были обнаружены на значительно более высоких уровнях в 1918 г., инфицированных HA / NA: TX / 91. мышей, чем у мышей, инфицированных сезонным TX / 91 [32, 33]. Приматы, отличные от человека, инфицированные реконструированным пандемическим вирусом 1918 года, продемонстрировали дисрегулируемую экспрессию врожденного иммунного ответа, который может быть критическим фактором, определяющим тяжесть и исход инфекции пандемическим вирусом 1918 года.Вирус 1918 г. вызывал противовирусный ответ, отличный от ответа на сезонный штамм h2N1 и менее защищающий его от вируса [34]. Инфекция вируса 1918 г. индуцировала гораздо меньше генов IFN-α, чем обычный вирус. МРНК IFN-β либо не индуцировалась, либо подавлялась во всех образцах вирусом 1918 года. Что касается вируса птичьего гриппа, исследования in vitro также продемонстрировали надежную индукцию провоспалительных цитокинов, в частности TNF-α и IFN типа I, вирусами H5N1 по сравнению с другими вирусами h4N2 и h2N1 человека [35].Другие исследования выявили сильную корреляцию между уровнями IL-6, IFN-α и TNF-α и тяжестью симптомов заболевания. Как и при экспериментальном гриппе, симптомы и лихорадка при естественном остром гриппе коррелируют с высвобождением IL-6 [36, 37].
В сезонном вирусе многие провоспалительные цитокины и хемокины также индуцируются ниже по ходу передачи сигналов IFNAR, что может вызывать усиленный воспалительный ответ и повреждение тканей. Одно раннее исследование показало, что местная респираторная продукция IFN-α у людей коррелирует с инфекцией и тяжестью заболевания [36].Было обнаружено, что главной детерминантой этого индуцированного IFN-β вредного ответа хозяина является мощный индуцирующий апоптоз рецептор смерти 5 (DR5), который функционирует как рецептор для индуцирующего апоптоз лиганда, связанного с фактором некроза опухоли (TRAIL), в пневмоцитах легких [ 38]. Было показано, что тяжелая инфекция IAV связана с TRAIL-опосредованным апоптозом при повреждении эпителия при вирусной пневмонии у мышей и людей [39, 40] и что IFN-α / β может индуцировать экспрессию TRAIL макрофагами, инфицированными IAV, и pDC [39, 41].
Более поздняя работа Davidson et al. [42] подтвердили, что чрезмерная передача сигналов IFN типа I в ответ на острую инфекцию IAV может привести к неконтролируемому воспалению [42]. Этот эффект, вероятно, связан с индукцией гибели эпителиальных клеток, вторичной по отношению к проапоптотическим эффектам IFN типа I. Более восприимчивые линии мышей продуцируют заметно более высокие уровни IFN в ответ на инфекцию гриппа, чем устойчивые линии. Большое количество гиперреактивных pDC продуцировало избыточные количества IFN, поддерживаемые с течением времени, что, в свою очередь, вызывало неконтролируемое воспаление и повреждение эпителия легких, опосредованное взаимодействиями TRAIL-DR5 [39].Уровень индукции экспрессии гена лиганда Fas (FasL) в легких также коррелировал с тяжестью инфекции гриппа, а IFN типа I имеет решающее значение для индукции экспрессии белка FasL в легких [43]. Благодаря этому механизму чрезмерное количество IFN типа I приводит к повреждению легких и смерти при тяжелой инфекции IAV.
Различные группы населения могут иметь специфический ответ на IFN типа I. Известно, что младенцы и дети младшего возраста имеют более высокий риск неблагоприятных клинических исходов после инфицирования IAV [44].Исследования обнаружили минимальное увеличение вирусной нагрузки у очень молодых людей и отсутствие связи возраста с существующим титром антител [45–47]. Вместо этого наблюдалась гораздо более очевидная возрастная ассоциация с подмножествами цитокинов, включая IFN типа I [48]. Повышенные уровни IFN-α2 при промывании носа коррелировали с увеличением тяжести заболевания даже после учета факторов, связанных с возрастом [49]. Известно, что местные иммунные реакции дыхательных путей являются критическими детерминантами кинетики инфекции и прогрессирования заболевания.
Постинфекционное терапевтическое введение неэффективно на животных моделях и может фактически повысить летальность, несмотря на снижение титров ВГА легких [19].Длительный или усиленный ответ IFN типа I на более поздних стадиях может ухудшить воспалительный ответ при пневмонии IAV [39]. Чтобы предотвратить сильные побочные эффекты провоспалительных функций IFN, множественные негативные регуляторные механизмы включают в себя широкий спектр молекул, которые действуют во всех точках сигнального пути IFN, чтобы контролировать продукцию IFN типа I, сигнальную трансдукцию и опосредованную IFN транскрипцию и трансляцию (обзор Порритта и Герцога [50]). Отрицательные регуляторные механизмы действуют для калибровки ответа IFN, позволяя избавиться от вируса при сохранении гомеостаза.IFN типа I опосредуют повышенную регуляцию экспрессии белков, индуцирующих апоптоз, экспрессируемых негематопоэтическими соматическими клетками, опосредующими повреждение тканей. Те же молекулы, когда они индуцируются в иммунных клетках IFN, могут способствовать иммуносупрессии аналогично PDL1 и IL-10. Следовательно, IFN типа I могут усиливать или уменьшать воспаление и патологию в зависимости от условий эксперимента. При оценке воздействия индукции IFN на клетку-хозяин или клетку-мишень необходимо учитывать такие факторы, как время, величина передачи сигналов, источник клеток и отдельные изучаемые подвиды IFN.
Иммунорегуляторные функции
В отличие от их провоспалительных эффектов, все больше данных свидетельствует о том, что IFN типа I обладают иммунорегуляторными функциями, которые имеют решающее значение для ослабления иммунопатогенных механизмов и минимизации побочного ущерба от инфекции [51]. Они вносят вклад в ключевую модуляцию противовирусных функций в DC, моноцитах, нейтрофилах, NK-клетках и T-клетках (рис. 2). Провоспалительные цитокины являются положительными медиаторами местного и системного воспаления, вызывают лихорадку, инициируют разрушение тканей и модулируют адаптивный иммунный ответ на IAV.Противовоспалительные цитокины уменьшают воспаление и способствуют заживлению. Чистый эффект воспалительной реакции определяется балансом между провоспалительными и противовоспалительными цитокинами. Сообщалось о про- и противовоспалительном действии на популяции клеток дыхательных путей после перорального или системного введения IFN-α мышам и лошадям [52–55].
Рис. 2.
IFN типа I модулируют функции иммунных клеток во время инфицирования вирусом гриппа. ИФН, интерферон; NK-клетка, естественная клетка-киллер; DC, дендритная клетка; IFNAR, рецептор IFN-α / β.
DC представляют собой антигенпрезентирующие клетки (APC), расположенные на порталах проникновения патогенов, которые имеют решающее значение для активации противовирусных Т-клеток [56]. Введение IFN типа I в ДК мыши и человека способствует созреванию ДК и усиливает экспрессию костимулирующих молекул и стимуляцию ДК Т-клеток [57, 58]. Simmons et al. [59] показали, что IFN типа I управляет особой программой созревания DC, которая усиливает презентацию антигена Т-клеткам без остановки процессинга антигена, что позволяет продолжать отбор образцов антигенов для презентации [59].Это может быть полезно в ходе инфекции IAV, поскольку некоторые DC могут подвергаться воздействию IFN до того, как они столкнутся с вирусом и антигенами, экспрессируемыми вирусом, и может быть важно избежать преждевременного прекращения обработки антигена до того, как DC подвергнутся воздействию патогенов. Однако некоторые результаты определяют противоположную роль IFN типа I в DC, инфицированных IAV. Сообщается, что IFN-αβ ингибирует in vitro дифференцировку DC от предшественников CD14 +. IFN типа I подавлял дифференцировку гематопоэтических предшественников таким образом, что это приводило к снижению продукции дендритных клеток костного мозга (BMDC) [60].Эти противоречивые результаты могут быть связаны с различными эффектами IFN типа I на активацию DC в зависимости от состояния созревания DC [61].
IFN типа I действует как главный регулятор, контролирующий, какое подмножество DC будет представлять антигены во время вирусной инфекции. Оба подмножества DC легких, CD103 + DC и CD11b high , инфицируются IAV in vivo и мигрируют в MLN, но только CD103 + DC поддерживают продуктивную репликацию вируса. Феномен возникает из-за разницы в чувствительности двух популяций DC к IFN I типа [62].CD103 + DC экспрессируют низкие уровни IFNAR по сравнению с другими подтипами DC и устойчивы к IFN типа I. Ослабленная передача сигналов IFNAR с помощью CD103 + DC коррелирует с их способностью к внутренней вирусной репликации и повышенной способностью презентации антигена для наивных CD8 + Т-клеток по сравнению с CD11b high DC. Это может быть связано с большей доступностью вирусного антигена в CD103 + DC. Представление о том, что мигрирующие CD103 + DC легкого являются пермиссивными для репликации вируса IAV, а IFN типа I повышают их способность как APC к CD8 + Т-клеткам, было поставлено под сомнение в более поздних исследованиях, показывающих (i) отсутствие репликации вируса в этой подгруппе во время инфекции in vivo [63 ] и (ii) инфекция DC не требуется для презентации антигена [64].CD103 + DC приобретают и транспортируют вирусные антигены из легких в дренирующие лимфатические узлы, где они способны как к прямой, так и к перекрестной презентации вирусных антигенов. Тем не менее Helft et al. [63] также наблюдали, что устойчивость CD103 + DC к инфекции коррелирует с повышенным антивирусным состоянием в этих клетках, которое зависит от экспрессии рецептора IFN типа I [63]. Эти результаты показывают, что эффективное перекрестное праймирование мигрирующими ДК легких связано с приобретением антивирусного состояния, которое зависит от сигнального пути IFN типа I.Интересно, что недавняя работа показала, что CD103 + DCs могут полагаться на передачу сигналов IFN-λ для оптимальной активации через рецептор IFN-λ [65]. Таким образом, хотя презентация антигена DC в легких пропорциональна репликации вируса и жестко ограничивается IFN типа I, для оптимальной активации DC, напротив, может потребоваться IFN III типа.
После инфицирования IAV вирус вызывает начальное высвобождение медиаторов воспаления, что приводит к острому воспалению легких, связанному с привлечением воспалительных моноцитов и нейтрофилов в инфицированных легких [31].Проточная цитометрия и анализ экспрессии генов с участием изолированных субпопуляций клеток из инфицированных легких показали, что приток нейтрофилов в значительной степени объясняет прогностическую сигнатуру транскрипции. Уменьшение нейтрофилов предотвращало гибель хозяина от самоусиливающегося повреждающего воспаления [66]. Galani et al. [27] обнаружили, что IFN типа I являются основными индукторами нейтрофильной инфильтрации, а нейтрофилы являются основными клетками, продуцирующими провоспалительные медиаторы в ответ на инфекцию IAV [27]. IFN типа I участвуют в управляемом нейтрофилами провоспалительном каскаде в легких, который индуцируется после инфекции IAV.Параллельно IFN типа I действуют синергически с IFN-γ, подавляя нейтрофильную инфильтрацию и подавляя продукцию хемотаксических хемокинов / цитокинов нейтрофилами при инфекции IAV [67]. В таких случаях передача сигналов IFN типа I необходима, но недостаточна для предотвращения рекрутирования нейтрофилов в легкие IAV-инфицированных мышей. IFN типа I способствуют усилению регуляции хемокинов MCP-1, MCP-3 и IP-10 с усилением воспалительного / хемотаксического сигнала и дальнейшим привлечением моноцитов / макрофагов и Т-лимфоцитов к месту инфекции [68].Новое исследование раскрывает новый IFN-зависимый регуляторный механизм, предназначенный для предотвращения чрезмерной иммунопатологии при сохранении его противовирусных функций. У мышей IFNAR1 — / — развиваются значительные дефекты инфильтрации моноцитов Ly6C hi в легкие после инфекции IAV. Моноциты Ly6C hi мышей WT являются основными продуцентами MCP-1, в то время как альтернативно генерируемые моноциты Ly6C int IFNAR — / — мышей в основном продуцируют цитокины для притока нейтрофилов. Как следствие, мыши IFNAR1 — / — рекрутируют больше нейтрофилов после заражения гриппом, чем мыши WT [17].Защитная функция IFNs типа I связана не только с рекрутированием классических воспалительных моноцитов Ly6C hi в IAV-инфицированные легкие, но также с предотвращением чрезмерной активации моноцитов IFN-γ [67]. Таким образом, оказывается, что IFN типа I определяет гомеостаз гемопоэтических стволовых клеток, контролируя приток нейтрофилов в очаг воспаления и активацию моноцитов.
NK-клетки представляют собой большие гранулярные врожденные лимфоидные клетки, которые действуют как иммунные регуляторы посредством продукции цитокинов и как цитотоксические эффекторные клетки.Их основные функции во время вирусной инфекции — производство IFN-γ и сдерживание репликации вируса путем уничтожения инфицированных клеток сразу после заражения гриппом [69]. Было показано, что IFN типа I играет заметную роль в опосредованном IAV размножении и активации NK-клеток [70, 71]. IFNs типа I оказывают прямое действие на NK-клетки, усиливая эффективные ответы NK-клеток в контексте инфекции гриппа и способствуя активации сигнальных путей NK-клеток, ответственных за цитотоксическую активность и продукцию цитокинов [72].Arimori et al. [73] показали, что мыши IFNAR — / — проявляют нарушенную цитотоксическую активность, а также повышенную способность NK- и CD8 + T-клеток продуцировать IFN-γ после заражения IAV. Следовательно, передача сигналов IFN типа I играет роль не только в усилении цитотоксичности, но также в подавлении некоторых эффекторных механизмов, включая продукцию IFN-γ NK и CD8 + Т-клетками посредством продукции IL-10 [73].
IFN типа I важны для стимуляции активации и выживания вирус-специфических Т-клеток и установления иммунной памяти [74–76].IFN типа I обладают мощным костимулирующим действием на CD8 + T-клетки, усиливая пролиферацию CD8 + T-клеток при внутренней передаче сигналов IFNAR1 Т-клеткам [77]. IFN типа I играет главную роль в ответе CD8 + Т-клеток на вирусную инфекцию, и его эффекты действуют как на APC, так и на Т-клетки. Фенотип Т-клеток и время воздействия IFN имеют важное значение, поскольку IFN может ингибировать пролиферацию или индуцировать апоптоз при некоторых обстоятельствах, но в других условиях оказывать сильное стимулирующее действие. В зависимости от статуса активации Т-клетки могут изменять уровни экспрессии IFNAR и экспрессию сигнальных молекул ниже IFNAR.Во-первых, IFN активирует MHC и костимулирующие молекулы. Во-вторых, IFN способствует апоптозу предсуществующих Т-клеток памяти, которые быстро фагоцитируются CD8α + DC. В-третьих, IFN непосредственно способствует пролиферации антиген (Ag) -специфических CD8 + Т-клеток в начале ответа. В-четвертых, IFN косвенно позволяет поздно прибывшим Ag-специфическим Т-клеткам становиться непосредственными эффекторами, но напрямую ингибирует пролиферацию этих клеток [77].
Клинические наблюдения и модели болезней человека на грызунах показали, что врожденные лимфоидные клетки группы 2 (клетки ILC2) играют важную роль в аллергических воспалительных реакциях, таких как астма и воспаление легких, вызванное патогенами.Duerr et al. [78] наблюдали увеличение количества клеток ILC2 и более дерегулированный врожденный и адаптивный иммунитет типа 2 у мышей с дефицитом IFNAR, инфицированных IAV, чем у инфицированных мышей WT, что продемонстрировало, что IFN типа I являются центральными регуляторами ILC2-опосредованных неблагоприятных иммунных ответов, которые могут приводить к патология тканей [78].
Определенные эффекты IFN-β
Инфекция IAV в основном индуцирует смесь различных подтипов IFN-α и IFN-β. В течение многих лет IFN типа I назывались IFN-α / β. Однако многие исследования показали, что отдельные подтипы IFN типа I могут иметь разные эффекты, несмотря на передачу сигналов через один и тот же рецептор, что приводит к разной противовирусной функции и биологическому эффекту.
Во время исследования активности усиления подтипа IFN типа I в дифференцировке DC, анализ транскриптома показал, что уровень экспрессии 7 хемокинов и нескольких поверхностных маркеров DC различает подтипы IFN DC, IFNα-DC и IFNβ-DC [79]. Различия в противовирусной активности были также обнаружены среди всех подтипов IFN типа I, что было измерено по ингибированию репликации легочного вируса [80].
Несколько групп продемонстрировали, что существует иерархия временной экспрессии в семействе генов IFN типа I [81, 82].IFN-β является ранним ответчиком и играет важную роль в эффективной индукции всех IFN типа I после инфицирования первичных эмбриональных, а также первичных взрослых фибробластов вирусом Сендай. Исследования первичных фибробластов мышей с целевой делецией гена IFN-β в значительной степени подтвердили мнение о том, что IFN-β служит немедленным ранним IFN [83]. Продукция IFN-β не требует передачи сигналов через IFNAR [84, 85]. Кроме того, связывание IFN-β с IFNAR вызывает последующие транскрипционные ответы, приводящие к экспрессии IFN-α.IFN-β — / — мыши очень восприимчивы к инфекции вируса коровьей оспы, отчасти из-за неспособности вызвать соответствующий IFN-α ответ [86]. Во время гриппа клетки респираторного эпителия являются важными источниками IFN-β на ранней стадии, в то время как pDC действуют позже, впоследствии высвобождая высокие количества IFN-α и IFN-β [87].
Что касается регуляции экспрессии генов, оба промотора генов IFN-α и IFN-β имеют сайты связывания фактора регуляции интерферона (IRF), которые позволяют семейству факторов транскрипции IRF управлять продуцированием IFN.Однако промотор IFN-β имеет другие ответные элементы, включая сайты для NF-κB и AP-1 [88]. IFN-β может продуцироваться в более разнообразных обстоятельствах по сравнению с теми, которые приводят к продуцированию подтипов IFN-α. Это менее ограниченное производство IFN-β подразумевает функцию IFN-β, которая отличается от других IFN типа I.
Молекулярная основа гомеостаза. Роль IFN типа I
Как могут IFN типа I играть такую сложную роль в генерации множества сигналов? Механизмы могут быть обусловлены вариациями в структурах 19 IFN типа I, а также различиями в их рецепторах.В частности, распределение рецепторов и сродство связывания между IFN и рецептором также могут играть роль в дифференциальных ответах передачи сигналов IFN.
IFN типа I распознаются и передаются через гетеродимерный IFNAR, состоящий из IFNAR1 и IFNAR2. Большинство исследований роли передачи сигналов IFN типа I в регуляции восприимчивости хозяина к IAV было сосредоточено только на дефиците IFNAR1 (с использованием IFNAR1 — / — мышей). Однако отдельные субъединицы рецептора могут связывать IFN-β или IFN-α независимо друг от друга и индуцировать различную передачу сигналов.IFN-β и IFN-α, как известно, обладают разным сродством к IFNAR1 и IFNAR2 и вызывают разные профили экспрессии генов в зависимости от их концентрации и времени [50]. IFN-β имеет сродство к IFNAR1 или IFNAR2 в 20–30 раз выше, чем IFN-α2 [89]. Свойства высокого сродства IFN-β могут объяснить 40-60-кратное увеличение активности пролиферации клеток этого подтипа IFN по сравнению с IFN-α2. Дополнительный эффект этого высокого сродства к рецепторам по сравнению с другими подвидами IFN типа I может объяснить, почему только IFN-β индуцирует отрицательные иммунорегулирующие факторы IL-10 и лиганд запрограммированной смерти 1 (PDL1) [90, 91], которые подавляют T- клеточные реакции, способствующие очищению от вирусов.
Новаторская работа Thomas et al. [92] показали, что различное сродство к IFN, способное вызывать различные функциональные эффекты, по-видимому, связано с различением лигандов через различные химические процессы связывания рецептора, которые определяют соответствующую стабильность взаимодействий рецептор-лиганд [92]. Повышенная аффинность связывания с IFNAR1 или IFNAR2 сильно усиливает подавление рецепторов. Подавленные эффекты врожденного иммунитета IFN типа I требовали более высокого сродства связывания с IFNAR.Позже де Верд и др. [88] установили, что IFN-β уникально и специфично лигируется с IFNAR1 IFNAR2-независимым образом. Комплекс IFNAR1-IFN-β трансдуцировал сигналы, которые модулировали экспрессию отдельного набора генов независимо от путей Jak-STAT. Передача сигналов IFNAR1-IFN-β является патологически значимой, поскольку липополисахаридный сепсис уменьшался у мышей IFNAR1 — / -, но не у мышей IFNAR2 — / — [88].
Левин и др. [93, 94] показали, что варианты или мутанты IFN типа I индуцируют 2 различных паттерна экспрессии генов, основанные на аффинности рецептора IFN, количестве рецепторов и концентрации IFN [93, 94].Они назвали гены, экспрессируемые в первом паттерне, «устойчивыми» генами, многие из которых связаны с противовирусной активностью, тогда как гены, экспрессируемые в паттерне, чьи продукты обладают иммуномодулирующими и антипролиферативными функциями, называются «настраиваемыми» генами. Все IFNα связывают субъединицу рецептора IFNAR1 с низким сродством. Увеличение аффинности связывания усиливало антипролиферативную активность IFNα2 [95].
Jaks et al. [96] обнаружили, что образование ISGF3 и противовирусная активность очень хорошо коррелируют со сродством связывания IFN с IFNAR2.Напротив, сродство к IFNAR1 играет ключевую роль в антипролиферативной активности [96]. Недавно Shepardson et al. [97] продемонстрировали, что, несмотря на некоторую избыточность, IFNAR1 и IFNAR2 играют разные роли в регуляции иммунитета против IAV. В отличие от мышей IFNAR1 — / -, мыши IFNAR2 — / -, инфицированные IAV, демонстрировали как повышенную, так и повышенную заболеваемость и смертность по сравнению с мышами WT [97]. Обработка мышей, у которых есть функциональный IFNAR2, но не IFNAR1 (IFNAR1 — / — мыши), IFN-β защищала этих мышей от заболеваемости и увеличивала их выживаемость по сравнению с IAV-инфицированными однопометниками дикого типа.Однако обработка IFNαA мышей, дефицитных по любой из субъединиц IFNAR, не оказывала влияния на индуцированную IAV потерю массы тела по сравнению с их необработанными однопометниками. Таким образом, в отличие от IFNAR1, IFNAR2 был достаточным для создания защиты от летальной инфекции IAV при стимуляции IFN-β.
Вместе аффинности и время пребывания связывания рецептора, уровень экспрессии поверхностного рецептора и типы клеток, в которых расположены рецепторы, могут определять различные ответы среди всех подтипов IFN типа I [98].Доступны многоуровневые механизмы обратной связи для предотвращения пагубных последствий для рецептора IFN и активации последующих сигналов.
Резюме
Инфекция IAV является основной причиной инфекционной заболеваемости и смертности во всем мире [99]. Недавние исследования на мышах выявили ключевую роль IFN типа I в защите хозяина от IAV. Они быстро активируют нижестоящие сигнальные сети ISG и ограничивают вирусную репликацию. IFN типа I способствуют активации клеток врожденного иммунитета, индуцируют адаптивный иммунитет и регулируют врожденные и адаптивные ответы.Многие открытия, касающиеся эффектов IFN на моделях мышей, привели к открытию параллельных явлений у людей. Хотя они не могут полностью воспроизвести человеческое заболевание, мышиные модели позволили исследователям использовать генетические стратегии для расшифровки механизмов, которые имеют решающее значение для ответа IFN на IAV in vivo. Однако в наших знаниях о роли интерферонов типа I в инфицировании человека гриппом существуют значительные пробелы. По-прежнему необходимы дальнейшие исследования для выяснения роли IFN типа I в ответе хозяина на IAV у людей.
IFN типа I должны строго регулироваться, чтобы максимизировать вирусный клиренс при минимальном повреждении клеток-хозяев. Это особенно сложно при борьбе с инфекцией гриппа, поскольку смертность от ВГА тесно связана с вторичными бактериальными инфекциями. Вирусный клиренс должен осуществляться при быстром разрешении воспаления, вызванного первичной вирусной инфекцией, иначе произойдет инвазия патогенов и вторичная бактериальная пневмония [100]. Понимание эффектов IFN типа I даст важные практические результаты, включая возможное использование иммуносупрессивных или противовоспалительных мер в терапии гриппа.
Использование модификаторов биологической реакции при болезнях человека достигло совершеннолетия при многих заболеваниях, включая рак, аутоиммунные заболевания и некоторые вирусные инфекции. Для того чтобы ИФН типа I или другие ИФН можно было использовать в терапевтических целях при гриппозной инфекции, мы должны понимать их механизмы, чтобы их можно было использовать в качестве противовирусных супергероев, быстро излечивающих вирусную инфекцию, и не становясь иммунопатогенными злодеями, усугубляющими действие вирусов. повреждение тканей.
Благодарности
Авторы выражают благодарность Др.Джиллиан М. Эйр (OUHSC, Оклахома-Сити, Оклахома, США) за критическое чтение рукописи и полезные комментарии.
Заявление о раскрытии информации
Авторы заявляют об отсутствии конфликта интересов.
Источники финансирования
Работа была частично поддержана пилотными грантами Oklahoma Shared Clinical and Translational Resource (OSCTR) (номер гранта U54GM104938 для WW), Программой оценки заслуг Министерства по делам ветеранов (грант номер I01 BX001937 для JPM), и Национальный институт общих медицинских наук (грант номер 5P20GM103648, J.ВЕЧЕРА).
Вклад авторов
Оба W.W. и J.P.M. были вовлечены в написание рукописей.
Список литературы
- Manicassamy B, Manicassamy S, Belicha-Villanueva A, Pisanelli G, Pulendran B, García-Sastre A.Анализ динамики заражения вирусом гриппа у мышей in vivo с использованием репортерного вируса GFP. Proc Natl Acad Sci U S. A. 2010; 107 (25): 11531–6.
- Коча Е.М., Севера М., Джакомини Э., Моннерон Д., Ремоли М.Э., Юлкунен И. и др. Вирусная инфекция и агонисты Toll-подобных рецепторов индуцируют дифференциальную экспрессию интерферонов типа I и лямбда в плазматических плазматических и моноцитарных дендритных клетках человека.Eur J Immunol. 2004. 34 (3): 796–805.
- Ди Франко С., Турдо А., Тодаро М., Стасси Г. Роль интерферонов типа I и II в колоректальном раке и меланоме. Фронт Иммунол. 2017; 8: 878.
- Холл JC, Розен А.Интерфероны I типа: важнейшие участники усиления аутоиммунного заболевания. Nat Rev Rheumatol. 2010. 6 (1): 40–9.
- Secombes CJ, Zou J. Эволюция интерферонов и рецепторов интерферона. Фронт Иммунол. 2017; 8: 209.
- Линденманн Дж., Берк Д.К., Айзекс А.Исследования по производству, механизму действия и свойствам интерферона. Br J Exp Pathol. 1957. 38 (5): 551–62.
- Свецки М., Колонна М. Интерфероны типа I: разнообразие источников, пути производства и влияние на иммунные ответы. Curr Opin Virol. 2011; 1 (6): 463–75.
- Пестка S, Krause CD, Вальтер MR.Интерфероны, интерфероноподобные цитокины и их рецепторы. Immunol Rev.2004; 202; 8–32.
- Кляйн-младший, Раулет Д.Х., Пастернак М.С., Беван М.Дж. Цитотоксические Т-лимфоциты продуцируют иммунный интерферон в ответ на антиген или митоген. J Exp Med. 1982; 155 (4): 1198–203.
- Scharton TM, Скотт П.Природные клетки-киллеры являются источником гамма-интерферона, который стимулирует дифференцировку субпопуляций CD4 + Т-клеток и вызывает у мышей раннюю устойчивость к Leishmania major. J Exp Med. 1993. 178 (2): 567–77.
- Sommereyns C, Paul S, Staeheli P, Michiels T. IFN-лямбда (IFN-λ) экспрессируется тканезависимым образом и в первую очередь действует на эпителиальные клетки in vivo.PLoS Pathog. 2008; 4 (3): e1000017.
- Котенко С.В., Галлахер Г., Баурин В.В., Льюис-Антес А., Шен М., Шах Н.К. и др. IFN-лямбды опосредуют противовирусную защиту через особый рецепторный комплекс цитокинов класса II. Nat Immunol. 2003. 4 (1): 69–77.
- Миллер JL, Андерс EM.Взаимодействие вирус-клетка при индукции интерферона 1 типа вирусом гриппа в клетках селезенки мышей. J Gen Virol. 2003. 84 (Pt 1): 193–202.
- Ли С.Ф., Гонг М.Дж., Чжао Ф.Р., Шао Дж.Дж., Се Ю.Л., Чжан Ю.Г. и др. Интерфероны типа I: различные виды биологической активности и современные применения при вирусной инфекции.Cell Physiol Biochem. 2018; 51 (5): 2377–96.
- Platanias LC. Механизмы передачи сигналов, опосредованной интерфероном типа I и типа II. Nat Rev Immunol. 2005. 5 (5): 375–86.
- Чжоу А., Паранджапе Дж. М., Дер С. Д., Уильямс Б. Р., Сильверман Р. Х.Действие интерферона у мышей с тройным дефицитом показывает существование альтернативных противовирусных путей. Вирусология. 1999. 258 (2): 435–40.
- Со Су, Квон Х.Дж., Ко Х.Дж., Бьюн Й.Х., Сеонг Б.Л., Уэмацу С. и др. Передача сигналов интерферона типа I регулирует моноциты и нейтрофилы Ly6C (hi) во время острой вирусной пневмонии у мышей.PLoS Pathog. 2011; 7 (2): e1001304.
- Koerner I, Kochs G, Kalinke U, Weiss S, Staeheli P. Защитная роль бета-интерферона в защите хозяина от вируса гриппа А. J Virol. 2007. 81 (4): 2025–2030.
- Дэвидсон С., Майни М.К., Вак А.Стимулирующие заболевание эффекты интерферонов типа I при вирусных, бактериальных и коинфекциях. J Interferon Cytokine Res. 2015; 35 (4): 252–64.
- Беннетт А.Л., Смит Д.В., Камминс М.Дж., Якоби П.А., Камминз Дж.М., Бейльхарц М.В. Низкие дозы перорального интерферона альфа в качестве профилактики вирусных респираторных заболеваний: двойное слепое параллельное контролируемое исследование в год пандемии гриппа.Другие вирусы гриппа респира. 2013. 7 (5): 854–62.
- Steel J, Staeheli P, Mubareka S, García-Sastre A, Palese P, Lowen AC. Передача пандемического вируса гриппа h2N1 и влияние предшествующего контакта с сезонными штаммами или лечением интерфероном. J Virol. 2010. 84 (1): 21–6.
- Кугель Д., Кохс Г., Обойес К., Рот Дж., Кобингер Г.П., Кобаса Д. и др.Интраназальное введение альфа-интерферона снижает заболеваемость хорьками вирусом сезонного гриппа А. J Virol. 2009. 83 (8): 3843–51.
- Гарсия-Састре А., Дурбин Р.К., Чжэн Х., Палезе П., Гертнер Р., Леви Д.Е. и др. Роль интерферона в тканевом тропизме вируса гриппа. J Virol.1998. 72 (11): 8550–8.
- Прайс Г.Е., Гашевска-Мастарларц А., Москофидис Д. Роль альфа / бета- и гамма-интерферонов в развитии иммунитета к вирусу гриппа А у мышей. J Virol. 2000. 74 (9): 3996–4003.
- Crotta S, Davidson S, Mahlakoiv T, Desmet CJ, Buckwalter MR, Albert ML, et al.Интерфероны типа I и типа III управляют избыточными петлями амплификации для индукции транскрипционной сигнатуры в инфицированном гриппом эпителии дыхательных путей. PLoS Pathog. 2013; 9 (11): e1003773.
- Zanoni I, Granucci F, Broggi A. Интерферон (IFN) -λ берет на себя управление: иммуномодулирующая роль IFN типа III.Фронт Иммунол. 2017; 8: 1661.
- Galani IE, Triantafyllia V, Eleminiadou EE, Koltsida O, Stavropoulos A, Manioudaki M, et al. Интерферон-λ обеспечивает неизбыточную переднюю противовирусную защиту от заражения вирусом гриппа без ущерба для приспособленности хозяина. Иммунитет. 2017; 46 (5): 875–890.e6.
- Klinkhammer J, Schnepf D, Ye L, Schwaderlapp M, Gad HH, Hartmann R, et al. IFN-λ предотвращает распространение вируса гриппа из верхних дыхательных путей в легкие и ограничивает передачу вируса. Элиф. 2018; 7: e33354.
- Wilson EB, Yamada DH, Elsaesser H, Herskovitz J, Deng J, Cheng G и др.Блокада хронической передачи сигналов интерферона типа I для контроля стойкой инфекции LCMV. Наука. 2013. 340 (6129): 202–7.
- Тейджаро Дж. Р., Нг Си, Ли А.М., Салливан Б.М., Шихан К.С., Велч М. и др. Стойкая инфекция LCMV контролируется блокадой передачи сигналов интерферона I типа. Наука.2013. 340 (6129): 207–11.
- La Gruta NL, Kedzierska K, Stambas J, Doherty PC. Вопрос самосохранения: иммунопатология при вирусной инфекции гриппа. Immunol Cell Biol. 2007. 85 (2): 85–92.
- Tumpey TM, García-Sastre A, Taubenberger JK, Palese P, Swayne DE, Pantin-Jackwood MJ, et al.Патогенность вирусов гриппа с генами пандемического вируса 1918 года: функциональные роли альвеолярных макрофагов и нейтрофилов в ограничении репликации вируса и смертности у мышей. J Virol. 2005. 79 (23): 14933–44.
- Cillóniz C, Shinya K, Peng X, Korth MJ, Proll SC, Aicher LD, et al.Смертельная инфекция вируса гриппа у макак связана с ранним нарушением регуляции генов, связанных с воспалением. PLoS Pathog. 2009; 5 (10): e1000604.
- Кобаса Д., Джонс С.М., Шинья К., Каш Дж.С., Коппс Дж., Эбихара Х. и др. Аберрантный врожденный иммунный ответ при летальном заражении макак вирусом гриппа 1918 г.Природа. 2007. 445 (7125): 319–23.
- Cheung CY, Poon LL, Lau AS, Luk W., Lau YL, Shortridge KF и др. Индукция провоспалительных цитокинов в макрофагах человека вирусами гриппа A (H5N1): механизм необычной тяжести заболевания человека? Ланцет. 2002; 360 (9348): 1831–7.
- Хайден Ф.Г., Фриц Р., Лобо М.С., Элворд В., Стробер В., Штраус С.Е. Местные и системные цитокиновые ответы при экспериментальной инфекции вируса гриппа человека А. Связь с формированием симптомов и защитой хозяина. J Clin Invest. 1998. 101 (3): 643–9.
- Кайзер Л., Фриц Р.С., Штраус С.Е., Губарева Л., Хайден Ф.Г.Патогенез симптомов при остром гриппе: ответы на интерлейкин-6 и другие цитокины. J Med Virol. 2001. 64 (3): 262–8.
- Герольд С., Беккер С., Ридж К.М., Бюдингер Г.Р. Повреждение легких, вызванное вирусом гриппа: патогенез и значение для лечения. Eur Respir J. 2015; 45 (5): 1463–78.
- Хёгнер К., Вольф Т., Плешка С., Плог С., Грубер А.Д., Калинке У. и др. Экспрессируемый макрофагами IFN-β способствует апоптотическому повреждению альвеолярных эпителиальных клеток при тяжелой пневмонии, вызванной вирусом гриппа. PLoS Pathog. 2013; 9 (2): e1003188.
- Герольд С., Штайнмюллер М., фон Вульфен В., Чакарова Л., Пинто Р., Плешка С. и др.Апоптоз эпителия легких при пневмонии, вызванной вирусом гриппа: роль лиганда, индуцирующего апоптоз, экспрессируемого макрофагами. J Exp Med. 2008. 205 (13): 3065–77.
- Шаперо Л., Блюм А., Манчес О, Луи Дж., Анхель Дж., Моленс Дж. П. и др. Агонисты вирусов или TLR индуцируют TRAIL-опосредованную цитотоксическую активность плазматических дендритных клеток.J Immunol. 2006. 176 (1): 248–55.
- Дэвидсон С., Кротта С., МакКейб TM, Вак А. Патогенный потенциал интерферона αβ при острой инфекции гриппа. Nat Commun. 2014; 5: 3864.
- Фудзикура Д., Чиба С., Мурамацу Д., Казумата М., Накаяма Ю., Кавай Т. и др.Интерферон типа I имеет решающее значение для экспрессии FasL на клетках легких и определяет тяжесть гриппа. PLoS One. 2013; 8 (2): e55321.
- Искандер М., Буй Р., Ламберт С. Бремя гриппа у детей. Curr Opin Infect Dis. 2007. 20 (3): 259–63.
- Cowling BJ, Chan KH, Fang VJ, Lau LLH, So HC, Fung ROP и др.Сравнительная эпидемиология пандемии и сезонного гриппа А в домашних хозяйствах. N Engl J Med. 2010. 362 (23): 2175–84.
- Цинкернагель РМ. Иммунологическая память ≠ защитный иммунитет. Cell Mol Life Sci. 2012. 69 (10): 1635–40.
- Лоеб М., Сингх П.К., Фокс Дж., Рассел М.Л., Паббараджу К., Зарра Д. и др.Продольное исследование распространения молекулярных вирусов гриппа в сообществах гуттеритов. J Infect Dis. 2012. 206 (7): 1078–84.
- Коутс Б.М., Старича К.Л., Кох С.М., Ченг Й., Шумакер Д.К., Budinger GRS и др. Воспалительные моноциты вызывают повреждение легких, опосредованное вирусом гриппа А, у молодых мышей.J Immunol. 2018; 200 (7): 2391–404.
- Oshansky CM, Gartland AJ, Wong SS, Jeevan T, Wang D, Roddam PL и др. Иммунные ответы слизистых оболочек позволяют прогнозировать клинические исходы во время гриппа независимо от возраста и вирусной нагрузки. Am J Respir Crit Care Med. 2014. 189 (4): 449–62.
- Порритт Р.А., Герцог П.Дж.Динамическое управление сигнализацией IFN типа I с помощью интегрированной сети отрицательных регуляторов. Trends Immunol. 2015; 36 (3): 150–60.
- Ли А.Дж., Ашкар А.А. Двойственная природа интерферонов I и II типа. Фронт Иммунол. 2018; 9: 2061.
- Мур Б.Р., Краковка С., Камминз Дж. М., Робертсон Дж. Т..Изменения в популяции воспалительных клеток дыхательных путей у стандартных породистых скаковых лошадей после введения интерферона-альфа. Vet Immunol Immunopathol. 1996. 49 (4): 347–58.
- Гибб Д. Р., Лю Дж., Натараджан П., Сантханакришнан М., Мадрид Д. Д., Айзенбарт С. К. и др. IFN типа I необходим и достаточен для вызванной воспалением аллоиммунизации эритроцитов у мышей.J Immunol. 2017; 199 (3): 1041–50.
- Кудо Д., Уно К., Аояги Т., Акахори Ю., Исии К., Канно Е. и др. Лечение низкими дозами интерферона-α улучшает выживаемость и воспалительные реакции на мышиной модели молниеносного острого респираторного дистресс-синдрома. Воспаление. 2013; 36 (4): 812–20.
- Gold JA, Hoshino Y, Jones MB, Hoshino S, Nolan A, Weiden MD. Экзогенный интерферон-альфа и интерферон-гамма повышают летальность мышиной сибирской язвы при вдыхании. PLoS One. 2007; 2 (8): e736.
- Курче Дж. С., Халущак К., МакВильямс Дж. А., Санчес П. Дж., Кедл Р. М..IFN-зависимая активация Т-клеток типа I опосредуется IFN-зависимой экспрессией лиганда OX40 дендритных клеток и не зависит от экспрессии IFNR Т-клеток. J Immunol. 2012. 188 (2): 585–93.
- Сантини С.М., Лапента С., Логоцци М., Парлато С., Спада М., Ди Пуккио Т. и др. Интерферон типа I как мощный адъювант для развития и активности дендритных клеток, происходящих из моноцитов, in vitro и у мышей Hu-PBL-SCID.J Exp Med. 2000. 191 (10): 1777–88.
- Монтойя М., Скьявони Дж., Маттей Ф., Грессер И., Беларделли Ф., Заимствование П. и др. Интерфероны типа I, продуцируемые дендритными клетками, способствуют их фенотипической и функциональной активации. Кровь. 2002. 99 (9): 3263–71.
- Симмонс Д.П., Вирш П.А., Канадей Д.Х., Мейерсон Х.Дж., Лю Ю.К., Ван И и др.IFN типа I управляет характерным фенотипом созревания дендритных клеток, который позволяет продолжать синтез MHC класса II и процессинг антигена. J Immunol. 2012. 188 (7): 3116–26.
- Даунс Дж. Э., Маршалл-Кларк С. Врожденные иммунные стимулы модулируют продукцию дендритных клеток костного мозга in vitro с помощью зависимых от толл-подобных рецепторов и независимых механизмов.Иммунология. 2010. 131 (4): 513–24.
- Радд Б.Д., Люкер Г.Д., Люкер К.Э., Пиблз Р.С., Лукач С.З. Интерферон I типа регулирует созревание дендритных клеток, инфицированных респираторным вирусом, и выработку цитокинов. Viral Immunol. 2007. 20 (4): 531–40.
- Мольтедо Б., Ли В., Юнт Дж. С., Моран TM.Уникальные ответы интерферона типа I определяют функциональную судьбу мигрирующих дендритных клеток легких во время инфицирования вирусом гриппа. PLoS Pathog. 2011; 7 (11): e1002345.
- Хелфт Дж., Маникассами Б., Гермонпрез П., Хашимото Д., Сильвин А., Агудо Дж. И др. Кросс-презентирующие дендритные клетки CD103 + защищены от заражения вирусом гриппа.J Clin Invest. 2012. 122 (11): 4037–47.
- Langlois RA, Varble A, Chua MA, García-Sastre A, tenOever BR. Гемопоэтическое нацеливание вируса гриппа A выявляет потребности в репликации для индукции противовирусных иммунных ответов. Proc Natl Acad Sci U S. A. 2012; 109 (30): 12117–22.
- Hemann EA, Green R, Turnbull JB, Langlois RA, Savan R, Gale M Jr. Интерферон-λ модулирует дендритные клетки для облегчения Т-клеточного иммунитета во время заражения вирусом гриппа А. Nat Immunol. 2019; 20 (8): 1035–45.
- Брандес М., Клаушен Ф., Кучен С., Жермен Р.Н.Системный анализ выявляет воспалительный контур с прямой связью, ведущий к летальной инфекции гриппа. Клетка. 2013. 154 (1): 197–212.
- Стифтер С.А., Бхаттачарья Н., Пиллэй Р., Флоридо М., Трикас Дж. А., Бриттон В. Дж. И др. Функциональное взаимодействие между интерферонами типа I и II необходимо для ограничения воспаления тканей, вызванного вирусом гриппа А.PLoS Pathog. 2016; 12 (1): e1005378.
- Юлкунен И., Мелен К., Нюквист М., Пирхонен Дж., Саренева Т., Матикайнен С. Воспалительные реакции при инфекции вируса гриппа А. Вакцина. 2000; 19 (Приложение 1): S32–7.
- Шульц-Черри С.Роль NK-клеток в гриппозной инфекции. Curr Top Microbiol Immunol. 2015; 386: 109–20.
- Бирон CA, Нгуен КБ, Пьен GC, Cousens LP, Salazar-Mather TP. Естественные клетки-киллеры в противовирусной защите: функция и регуляция врожденными цитокинами. Анну Рев Иммунол. 1999; 17: 189–220.
- Нгуен КБ, Салазар-Матер Т.П., Далод М.Ю., Ван Деусен Дж.Б., Вей XQ, Лью Ф.Й. и др. Скоординированные и различные роли IFN-альфа-бета, IL-12 и IL-15 в регуляции ответов NK-клеток на вирусную инфекцию. J Immunol. 2002. 169 (8): 4279–87.
- Hwang I, Scott JM, Kakarla T., Duriancik DM, Choi S, Cho C и др.Механизмы активации естественных клеток-киллеров при заражении вирусом гриппа. PLoS One. 2012; 7 (12): e51858.
- Аримори Й., Накамура Р., Ямада Х., Шибата К., Маеда Н., Касе Т. и др. Интерферон типа I играет противоположные роли в цитотоксичности и продукции интерферона-γ естественными киллерами и CD8 T-клетками после инфицирования вирусом гриппа A у мышей.J. Врожденный иммунитет. 2014. 6 (4): 456–66.
- Хавенар-Доутон С., Колумам Г.А., Мурали-Кришна К. Передовая кромка: прямое действие IFN типа I на Т-клетки CD4 имеет решающее значение для поддержания клональной экспансии в ответ на вирусную, но не бактериальную инфекцию. J Immunol. 2006. 176 (6): 3315–9.
- Колумам Г.А., Томас С., Томпсон Л.Дж., Спрент Дж., Мурали-Кришна К. Интерфероны типа I действуют непосредственно на Т-клетки CD8, обеспечивая клональную экспансию и формирование памяти в ответ на вирусную инфекцию. J Exp Med. 2005. 202 (5): 637–50.
- Томпсон Л.Дж., Колумам Г.А., Томас С., Мурали-Кришна К.Врожденные воспалительные сигналы, индуцируемые различными патогенами, по-разному определяют зависимость Т-лимфоцитов CD8 от IFN-I в отношении клональной экспансии и формирования памяти. J Immunol. 2006. 177 (3): 1746–54.
- Валлийский RM, Bahl K, Marshall HD, Urban SL. Интерфероны 1 типа и противовирусные Т-клеточные ответы CD8.PLoS Pathog. 2012; 8 (1): e1002352.
- Duerr CU, McCarthy CD, Mindt BC, Rubio M, Meli AP, Pothlichet J, et al. Интерферон типа I ограничивает иммунопатологию 2-го типа за счет регуляции врожденных лимфоидных клеток 2-й группы. Nat Immunol. 2016; 17 (1): 65–75.
- Гарсин Дж., Бордат Ю., Чучана П., Моннерон Д., Лоу Х. К., Пилер Дж. И др.Дифференциальная активность подтипов интерферона I типа для дифференцировки дендритных клеток. PLoS One. 2013; 8 (3): e58465.
- Джеймс СМ, Абдад М.Ю., Мэнсфилд Дж. П., Якобсен Х. К., Винд А. Р., Stumbles PA и др. Дифференциальная активность подтипов альфа / бета IFN против вируса гриппа in vivo и усиление специфических иммунных ответов у мышей, вакцинированных ДНК, экспрессирующих гемагглютинин и нуклеопротеин.Вакцина. 2007. 25 (10): 1856–67.
- Марие I, Дурбин JE, Леви DE. Дифференциальная вирусная индукция отдельных генов интерферона-альфа по положительной обратной связи через фактор регуляции интерферона-7. EMBO J. 1998; 17 (22): 6660–9.
- Juang YT, Lowther W., Kellum M, Au WC, Lin R, Hiscott J, et al.Первичная активация транскрипции генов интерферона А и интерферона В фактором регуляции интерферона 3. Proc Natl Acad Sci U S. A. 1998; 95 (17): 9837–42.
- Samuelsson CV, Lienenklaus S, Müller PP, Zawatzky R, Hauser H, Weiss S. Трансформация фибробластов мыши изменяет модель индукции IFN типа I после вирусной инфекции.Biochem Biophys Res Commun. 2005. 335 (2): 584–9.
- Танигучи Т., Такаока А. Слабый сигнал для сильных ответов: пересмотр интерферона-альфа / бета. Nat Rev Mol Cell Biol. 2001. 2 (5): 378–86.
- Каваи Т., Акира С.Роль рецепторов распознавания образов в врожденном иммунитете: обновленная информация о Toll-подобных рецепторах. Nat Immunol. 2010. 11 (5): 373–84.
- Деонарайн Р., Альками А., Алексиу М., Даллман М.Дж., Геверт Д.Р., Портер А.С. Нарушение противовирусного ответа и индукции альфа / бета-интерферона у мышей, лишенных бета-интерферона.J Virol. 2000. 74 (7): 3404–9.
- Джуэлл Н.А., Вагефи Н., Мерц С.Е., Актер П., Пиблс Р.С. мл., Бакалетц Л.О. и др. Дифференциальная индукция интерферона I типа респираторно-синцитиальным вирусом и вирусом гриппа a in vivo. J Virol. 2007. 81 (18): 9790–800.
- де Верд Н.А., Вивиан Дж. П., Нгуен Т.К., Манган Н.Э., Гулд Дж.А., Бранифф С.Дж. и др.Структурная основа уникальной оси передачи сигналов интерферона-β, опосредованной рецептором IFNAR1. Nat Immunol. 2013. 14 (9): 901–7.
- Джайтин Д.А., Ройсман Л.С., Якс Э., Гавутис М., Пилер Дж., Ван дер Хейден Дж. И др. Изучение дифференциального действия интерферонов (IFN): мутант IFN-альфа2 с повышенным сродством к IFNAR1 функционально подобен IFN-бета.Mol Cell Biol. 2006; 26 (5): 1888–97.
- Сараива М., О’Гарра А. Регулирование выработки ИЛ-10 иммунными клетками. Nat Rev Immunol. 2010. 10 (3): 170–81.
- Шарп А.Х., Уэрри Э.Дж., Ахмед Р., Фриман Г.Дж.Функция запрограммированной гибели клеток 1 и ее лигандов в регулировании аутоиммунитета и инфекции. Nat Immunol. 2007. 8 (3): 239–45.
- Thomas C, Moraga I, Levin D, Krutzik PO, Podoplelova Y, Trejo A, et al. Структурная связь между дискриминацией лиганда и активацией рецептора интерферонами типа I.Клетка. 2011. 146 (4): 621–32.
- Левин Д., Харари Д., Шрайбер Г. Экспрессия стохастических рецепторов определяет судьбу клеток при лечении интерфероном. Mol Cell Biol. 2011. 31 (16): 3252–66.
- Левин Д., Шнайдер В. М., Хоффманн Х. Х., Ярден Г., Бузетто А. Г., Поместье О. и др.Многогранная активность интерферона I типа выявляется антагонистом рецепторов. Sci Signal. 2014; 7 (327): ра50.
- Kalie E, Jaitin DA, Abramovich R, Schreiber G. Мутант интерферона альфа2, оптимизированный с помощью фагового дисплея для связывания IFNAR1, обеспечивает специфически усиленную противоопухолевую активность.J Biol Chem. 2007. 282 (15): 11602–11.
- Jaks E, Gavutis M, Uzé G, Martal J, Piehler J. Дифференциальная аффинность рецепторных субъединиц интерферонов типа I регулирует активацию дифференциального сигнала. J Mol Biol. 2007. 366 (2): 525–39.
- Шепардсон К.М., Ларсон К., Джонс Л.Л., Станек К., Чо Х., Веллхэм Дж. И др.IFNAR2 необходим для противогриппозного иммунитета и изменяет восприимчивость к бактериальным суперинфекциям после гриппа. Фронт Иммунол. 2018; 9: 2589.
- Шрайбер Г. Молекулярные основы дифференциальной передачи сигналов интерферона I типа. J Biol Chem. 2017; 292 (18): 7285–94.
- Дэвис М.М., Тауберт К., Бенин А.Л., Браун Д.В., Менса Г.А., Баддур Л.М. и др.Вакцинация против гриппа как вторичная профилактика сердечно-сосудистых заболеваний: научный совет Американской кардиологической ассоциации / Американского колледжа кардиологии. J Am Coll Cardiol. 2006. 48 (7): 1498–502.
- Биондо С., Лентини Дж., Бенинати С., Тети Дж. Двойная роль врожденного иммунитета во время гриппа.Биомед Дж. 2019; 42 (1): 8–18.
Автор Контакты
Wenxin Wu
Департамент медицины
Центр медицинских наук Университета Оклахомы
800 N. Research Pkwy, комната 425, Оклахома-Сити, штат Оклахома-Сити 73104 (США)
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила в редакцию: 29 января 2020 г.
Дата принятия: 3 мая 2020 г.
Опубликована онлайн: 19 июня 2020 г.
Дата выпуска: ноябрь — декабрь
Количество страниц для печати: 11
Количество рисунков: 2
Количество столов: 0
ISSN: 1662-811X (печатный)
eISSN: 1662-8128 (онлайн)
Для дополнительной информации: https: // www.karger.com/JIN
Лицензия открытого доступа / Дозировка лекарства / Заявление об ограничении ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененных материалов требует письменного разрешения. Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Интерфероны I типа при инфекционных заболеваниях
Pestka, S., Krause, C. D. и Walter, M. R. Интерфероны, интерфероноподобные цитокины и их рецепторы. Immunol. Ред. 202 , 8–32 (2004).
CAS PubMed Google ученый
Шенборн, Дж. Р. и Уилсон, С. Б. Регулирование интерферона-γ во время врожденных и адаптивных иммунных ответов. Adv. Иммунол. 96 , 41–101 (2007).
CAS PubMed Google ученый
О’Брайен Т.Р., Прокунина-Олссон, Л. и Доннелли, Р. П. IFN-λ4: парадоксальный новый член семейства интерферонов λ. J. Interferon Cytokine Res. 34 , 829–838 (2014).
CAS PubMed PubMed Central Google ученый
Prokunina-Olsson, L. et al. Вариант перед IFNL3 ( IL28B ), создающий новый ген интерферона IFNL4 , связан с нарушением клиренса вируса гепатита С. Nature Genet. 45 , 164–171 (2013).
CAS PubMed Google ученый
Witte, K., Witte, E., Sabat, R. & Wolk, K. IL-28A, IL-28B и IL-29: многообещающие цитокины с интерфероноподобными свойствами I типа. Cytokine Growth Factor Rev. 21 , 237–251 (2010).
CAS PubMed Google ученый
Дурбин Р.К., Котенко, С. В., Дурбин, Дж. Э. Индукция и функция интерферона на поверхности слизистой оболочки. Immunol. Ред. 255 , 25–39 (2013).
PubMed PubMed Central Google ученый
Ян Н. и Чен З. Дж. Внутренний противовирусный иммунитет. Nature Immunol. 13 , 214–222 (2012).
CAS Google ученый
Губо, Д., Deddouche, S. & Reis e Sousa, C. Цитозольное зондирование вирусов. Иммунитет 38 , 855–869 (2013).
CAS PubMed Google ученый
Палудан С. Р. и Боуи А. Г. Иммунное зондирование ДНК. Иммунитет 38 , 870–880 (2013).
CAS PubMed PubMed Central Google ученый
Лебер, Дж.H. et al. Четкие TLR- и NLR-опосредованные транскрипционные ответы на внутриклеточный патоген. PLoS Pathog. 4 , e6 (2008).
PubMed PubMed Central Google ученый
Pandey, A. K. et al. NOD2, RIP2 и IRF5 играют критическую роль в ответе интерферона типа I на Mycobacterium tuberculosis . PLoS Pathog. 5 , e1000500 (2009).
PubMed PubMed Central Google ученый
Ватанабэ, Т.и другие. NOD1 участвует в защите мыши-хозяина от Helicobacter pylori посредством индукции IFN типа I и активации сигнального пути ISGF3. J. Clin. Инвестировать. 120 , 1645–1662 (2010).
CAS PubMed PubMed Central Google ученый
Морейра, Л. О. и Замбони, Д. С. Передача сигналов NOD1 и NOD2 при инфекции и воспалении. Фронт. Иммунол. 3 , 328 (2012).
PubMed PubMed Central Google ученый
Мойна, П. Н. Передача сигналов TLR и активация IRF: возвращение к старым друзьям из пути NF-κB. Trends Immunol. 26 , 469–476 (2005).
CAS PubMed Google ученый
Honda, K., Takaoka, A. & Taniguchi, T. Индукция гена интерферона типа I семейством факторов регуляции интерферона факторов транскрипции. Иммунитет 25 , 349–360 (2006).
CAS PubMed Google ученый
Тамура Т., Янаи Х., Савицкий Д. и Танигучи Т. Факторы транскрипции семейства IRF в иммунитете и онкогенезе. Annu. Rev. Immunol. 26 , 535–584 (2008).
CAS PubMed Google ученый
Ивашкив, Л. Б., Донлин, Л.T. Регуляция интерфероновых ответов типа I. Nature Rev. Immunol. 14 , 36–49 (2014). Этот обзор является прекрасной прелюдией к настоящему обзору и более подробно описывает молекулярные механизмы регуляции IFN типа I.
CAS Google ученый
Раух И., Мюллер М. и Деккер Т. Регулирование воспаления интерферонами и их STAT. ДЖАКСТАТ 2 , e23820 (2013).
PubMed PubMed Central Google ученый
Верстег, Г. А. и Гарсия-Састре, А. Вирусные уловки для блокировки системы интерферона типа I. Curr. Opin. Microbiol. 13 , 508–516 (2010).
CAS PubMed PubMed Central Google ученый
McNab, F. W., Rajsbaum, R., Stoye, J. P. & O’Garra, A. Белки с тройным мотивом и регуляция врожденного иммунитета. Curr. Opin. Иммунол. 23 , 46–56 (2011).
CAS PubMed Google ученый
Даймонд, М. С. и Шоггинс, Дж. У. Скрининг фактора ограничения хозяина: пусть вирус сделает свою работу. Клеточный микроб-хозяин 14 , 229–231 (2013).
CAS PubMed Google ученый
Muller, U. et al. Функциональная роль интерферонов типа I и типа II в противовирусной защите. Наука 264 , 1918–1921 (1994).
CAS PubMed Google ученый
Haller, O., Arnheiter, H., Gresser, I. & Lindenmann, J. Вирус-специфическое действие интерферона. Защита новорожденных носителей Mx от летального заражения вирусом гриппа. J. Exp. Med. 154 , 199–203 (1981).
CAS PubMed Google ученый
Дурбин, Дж.E. et al. IFN типа I модулирует врожденный и специфический противовирусный иммунитет. J. Immunol. 164 , 4220–4228 (2000).
CAS PubMed Google ученый
Garcia-Sastre, A. et al. Роль интерферона в тканевом тропизме вируса гриппа. J. Virol. 72 , 8550–8558 (1998).
CAS PubMed PubMed Central Google ученый
Кернер И., Kochs, G., Kalinke, U., Weiss, S. & Staeheli, P. Защитная роль β-интерферона в защите хозяина от вируса гриппа А. J. Virol. 81 , 2025–2030 (2007).
CAS PubMed Google ученый
Прайс, Г. Э., Гашевска-Мастарларц, А. и Москофидис, Д. Роль α / β и γ интерферонов в развитии иммунитета к вирусу гриппа A у мышей. J. Virol. 74 , 3996–4003 (2000).
CAS PubMed PubMed Central Google ученый
Mordstein, M. et al. λ Интерферон делает эпителиальные клетки дыхательных путей и желудочно-кишечного тракта устойчивыми к вирусным инфекциям. J. Virol. 84 , 5670–5677 (2010).
CAS PubMed PubMed Central Google ученый
Mordstein, M. et al. Интерферон-λ способствует врожденному иммунитету мышей против вируса гриппа А, но не против гепатотропных вирусов. PLoS Pathog. 4 , e1000151 (2008). Это исследование демонстрирует повторяющуюся роль IFN типа I и типа III в ответе против вируса гриппа, проясняя путаницу, возникшую из более ранней литературы, в которой сообщалось, что IFN типа I не могут учитывать потребность в передаче сигналов STAT1 для защиты от инфекции вируса гриппа.
PubMed PubMed Central Google ученый
Crotta, S.и другие. Интерфероны типа I и типа III управляют избыточными петлями амплификации для индукции транскрипционной сигнатуры в инфицированном гриппом эпителии дыхательных путей. PLoS Pathog. 9 , e1003773 (2013). Это исследование демонстрирует повторяющуюся роль передачи сигналов IFN типа I и типа III в эпителиальных клетках в ответе против вируса гриппа, проясняя путаницу, возникшую в более ранней литературе по поводу защиты от инфекции вируса гриппа.
PubMed PubMed Central Google ученый
Казанова, Дж.Л., Холланд, С. М. и Нотаранджело, Л. Д. Врожденные ошибки человеческих JAK и STAT. Иммунитет 36 , 515–528 (2012).
CAS PubMed PubMed Central Google ученый
Zhang, S. Y. et al. Врожденные ошибки опосредованного интерфероном (IFN) иммунитета у людей: понимание соответствующих ролей IFN-α / β, IFN-γ и IFN-λ в защите хозяина. Immunol. Ред. 226 , 29–40 (2008).
CAS PubMed Google ученый
Suppiah, V. et al. IL28B связан с ответом на терапию интерфероном-α хронического гепатита С и рибавирином. Nature Genet. 41 , 1100–1104 (2009).
CAS PubMed Google ученый
Tanaka, Y. et al. Полногеномная ассоциация IL28B с ответом на терапию пегилированным интерфероном-α и рибавирином при хроническом гепатите С. Nature Genet. 41 , 1105–1109 (2009).
CAS PubMed Google ученый
Ge, D. et al. Генетическая изменчивость в IL28B предсказывает вирусный клиренс, вызванный лечением гепатита С. Природа 461 , 399–401 (2009).
CAS PubMed Google ученый
Thomas, D. L. et al. Генетическая изменчивость IL28B и спонтанное избавление от вируса гепатита С. Природа 461 , 798–801 (2009).
CAS PubMed PubMed Central Google ученый
Sandler, N.G. et al. Реакция интерферона I типа у макак-резусов предотвращает инфекцию SIV и замедляет прогрессирование заболевания. Природа 511 , 601–605 (2014).
CAS PubMed PubMed Central Google ученый
Эверит, А.R. et al. IFITM3 ограничивает заболеваемость и смертность от гриппа. Природа 484 , 519–523 (2012). Это исследование предоставило первые доказательства того, что генетика хозяина ( IFITM3 ) вносит вклад в предрасположенность человека к инфекции вируса гриппа.
CAS PubMed PubMed Central Google ученый
Zhang, Y.H. et al. Интерферон-индуцированный генетический вариант трансмембранного белка-3 rs12252-C связан с тяжелым гриппом у китайцев. Nature Commun. 4 , 1418 (2013). Это исследование, продолжающееся по ссылке 38, показывающее, что IFITM3 варианты, которые влияют на тяжесть инфекции вируса гриппа, преобладают в китайском населении.
Google ученый
Staeheli, P., Grob, R., Meier, E., Sutcliffe, J. G. & Haller, O. Восприимчивые к вирусу гриппа мыши несут генов Mx с большой делецией или бессмысленной мутацией. Мол. Клетка. Биол. 8 , 4518–4523 (1988).
CAS PubMed PubMed Central Google ученый
Хорисбергер М.А., Стахели П. и Халлер О. Интерферон индуцирует уникальный белок в клетках мыши, несущих ген устойчивости к вирусу гриппа. Proc. Natl Acad. Sci. США 80 , 1910–1914 (1983).
CAS PubMed Google ученый
Хорби, П., Нгуен, Н. Ю., Данстан, С. Дж. И Бэйли, Дж. К. Роль генетики хозяина в восприимчивости к гриппу: систематический обзор. PLoS ONE 7 , e33180 (2012).
CAS PubMed PubMed Central Google ученый
Dauer, M. et al. Интерферон-α выводит из строя предшественников дендритных клеток: дендритные клетки, полученные из обработанных интерфероном-α моноцитов, имеют дефекты созревания и стимуляции Т-клеток. Иммунология 110 , 38–47 (2003).
CAS PubMed PubMed Central Google ученый
Lapenta, C. et al. Мощный иммунный ответ против ВИЧ-1 и защита от заражения вирусом у мышей hu-PBL-SCID, иммунизированных инактивированными дендритными клетками с импульсным воздействием вируса, генерированными в присутствии IFN-α. J. Exp. Med. 198 , 361–367 (2003).
CAS PubMed PubMed Central Google ученый
Сантини, С.M. et al. Интерферон типа I как мощный адъювант для развития и активности моноцитов дендритных клеток in vitro и у мышей Hu-PBL-SCID. J. Exp. Med. 191 , 1777–1788 (2000).
CAS PubMed PubMed Central Google ученый
Santodonato, L. et al. Дендритные клетки, полученные из моноцитов, полученные после кратковременного культивирования с IFN-α и гранулоцитарно-макрофагальным колониестимулирующим фактором, стимулируют мощный Т-клеточный ответ CD8 + , специфичный для вируса Эпштейна-Барра. J. Immunol. 170 , 5195–5202 (2003).
CAS PubMed Google ученый
Хам, Б., Трифило, М. Дж., Зунига, Э. И. и Олдстон, М. Б. Вирусы уклоняются от иммунной системы через опосредованную интерфероном I типа STAT2-зависимую, но независимую от STAT1 передачу сигналов. Иммунитет 22 , 247–257 (2005).
CAS PubMed Google ученый
Ито, Т.и другие. Дифференциальная регуляция субпопуляций дендритных клеток крови человека с помощью IFN. J. Immunol. 166 , 2961–2969 (2001).
CAS PubMed Google ученый
Montoya, M. et al. Интерфероны типа I, продуцируемые дендритными клетками, способствуют их фенотипической и функциональной активации. Кровь 99 , 3263–3271 (2002).
CAS PubMed Google ученый
Ле Бон, А.и другие. Перекрестное праймирование Т-клеток CD8 + , стимулированных вирус-индуцированным интерфероном I типа. Nature Immunol. 4 , 1009–1015 (2003).
CAS Google ученый
Le Bon, A. et al. Прямая стимуляция Т-клеток IFN типа I усиливает Т-клеточный ответ CD8 + во время перекрестного прайминга. J. Immunol. 176 , 4682–4689 (2006).
CAS PubMed Google ученый
Спадаро, Ф.и другие. IFN-α усиливает перекрестную презентацию в дендритных клетках человека, модулируя выживание антигена, маршрутизацию эндоцитов и процессинг. Кровь 119 , 1407–1417 (2012).
CAS PubMed Google ученый
Parlato, S. et al. Экспрессия хемокинов CCR-7, MIP-3β и Th-1 в дендритных клетках, полученных из моноцитов, индуцированных IFN типа I: важность для быстрого приобретения мощной миграционной и функциональной активности. Кровь 98 , 3022–3029 (2001).
CAS PubMed Google ученый
Rouzaut, A. et al. Дендритные клетки прикрепляются к лимфатическому эндотелию и мигрируют через него в ответ на IFN-α. Eur. J. Immunol. 40 , 3054–3063 (2010).
CAS PubMed Google ученый
Gautier, G. et al. Аутокринно-паракринная петля интерферона типа I участвует в индуцированной Toll-подобным рецептором секреции дендритными клетками интерлейкина-12p70. J. Exp. Med. 201 , 1435–1446 (2005).
CAS PubMed PubMed Central Google ученый
Cousens, L. P., Orange, J. S., Su, H. C. & Biron, C. A. Ингибирование интерфероном-α / β выработки интерлейкина 12 и интерферона-γ in vitro, и эндогенно во время вирусной инфекции. Proc. Natl Acad. Sci. USA 94 , 634–639 (1997).
CAS PubMed Google ученый
Далод, М.и другие. Ответы интерферона α / β и интерлейкина 12 на вирусные инфекции: пути регуляции экспрессии цитокинов дендритных клеток in vivo . J. Exp. Med. 195 , 517–528 (2002).
CAS PubMed PubMed Central Google ученый
Orange, J. S., Wolf, S. F. и Biron, C. A. Влияние IL-12 на реакцию и восприимчивость к экспериментальным вирусным инфекциям. J. Immunol. 152 , 1253–1264 (1994).
CAS PubMed Google ученый
Orange, J. S. et al. Механизм опосредованной интерлейкином 12 токсичности при экспериментальных вирусных инфекциях: роль фактора некроза опухоли и глюкокортикоидов. J. Exp. Med. 181 , 901–914 (1995).
CAS PubMed Google ученый
Le Bon, A. et al. Усиление ответа антител за счет прямой стимуляции В- и Т-клеток IFN типа I. J. Immunol. 176 , 2074–2078 (2006).
CAS PubMed Google ученый
Havenar-Daughton, C., Kolumam, G. A. и Murali-Krishna, K. Прямое действие IFN типа I на CD4 T-клетки имеет решающее значение для поддержания клональной экспансии в ответ на вирусную, но не бактериальную инфекцию. J. Immunol. 176 , 3315–3319 (2006).
CAS PubMed Google ученый
Бринкманн, В., Geiger, T., Alkan, S. & Heusser, C.H. Интерферон α увеличивает частоту продуцирования интерферона γ человеческими CD4 + Т-клетками. J. Exp. Med. 178 , 1655–1663 (1993).
CAS PubMed Google ученый
Hofer, M. J. et al. У мышей с дефицитом STAT1, но не STAT2 или IRF9, после инфицирования вирусом лимфоцитарного хориоменингита развивается летальное опосредованное Т-клетками CD4 + заболевание. J. Virol. 86 , 6932–6946 (2012).
CAS PubMed PubMed Central Google ученый
Lazear, H. M., Pinto, A. K., Vogt, M. R., Gale, M. Jr & Diamond, M. S. β-Интерферон контролирует инфекцию вируса Западного Нила и патогенез у мышей. J. Virol. 85 , 7186–7194 (2011).
CAS PubMed PubMed Central Google ученый
Шиоу, Л.R. et al. CD69 действует ниже интерферона-α / β, подавляя выход S1P1 и лимфоцитов из лимфоидных органов. Природа 440 , 540–544 (2006).
CAS PubMed Google ученый
Petricoin, E. F. et al. Антипролиферативное действие интерферона-α требует компонентов передачи сигналов Т-клеточного рецептора. Nature 390 , 629–632 (1997).
CAS PubMed Google ученый
Казер, А., Nagata, S. & Tilg, H. Интерферон α усиливает вызванную активацией смерть Т-клеток за счет усиления экспрессии Fas (CD95 / APO-1) и лиганда Fas. Цитокин 11 , 736–743 (1999).
CAS PubMed Google ученый
Маршалл, Х. Д., Урбан, С. Л. и Уэлш, Р. М. Индуцированное вирусом временное подавление иммунитета и ингибирование пролиферации Т-клеток интерфероном типа I. J. Virol. 85 , 5929–5939 (2011).
CAS PubMed PubMed Central Google ученый
Bromberg, J. F., Horvath, C. M., Wen, Z., Schreiber, R. D. и Darnell, J. E. Jr. Транскрипционно активный Stat1 необходим для антипролиферативного действия как интерферона α, так и интерферона γ. Proc. Natl. Акад. Sci. USA 93 , 7673–7678 (1996).
CAS PubMed Google ученый
Ли, К.K., Smith, E., Gimeno, R., Gertner, R. & Levy, D. E. STAT1 влияет на выживаемость и пролиферацию лимфоцитов, частично независимо от его роли после IFN-γ. J. Immunol. 164 , 1286–1292 (2000).
CAS PubMed Google ученый
Tanabe, Y. et al. Роль STAT1, STAT3 и STAT5 в ответах IFN-α / β в Т-лимфоцитах. J. Immunol. 174 , 609–613 (2005).
CAS PubMed Google ученый
Маррак, П., Kappler, J. & Mitchell, T. Интерфероны типа I поддерживают активность активированных Т-клеток. J. Exp. Med. 189 , 521–530 (1999).
CAS PubMed PubMed Central Google ученый
Aichele, P. et al. CD8 T-клетки, специфичные для вируса лимфоцитарного хориоменингита, требуют рецептора IFN типа I для клональной экспансии. J. Immunol. 176 , 4525–4529 (2006).
CAS PubMed Google ученый
Колумам, Г.А., Томас, С., Томпсон, Л. Дж., Спрент, Дж. И Мурали-Кришна, К. Интерфероны типа I действуют непосредственно на Т-клетки CD8, обеспечивая клональную экспансию и формирование памяти в ответ на вирусную инфекцию. J. Exp. Med. 202 , 637–650 (2005).
CAS PubMed PubMed Central Google ученый
Curtsinger, J. M., Valenzuela, J. O., Agarwal, P., Lins, D. & Mescher, M. F. IFN типа I обеспечивают третий сигнал CD8 T-клеткам для стимуляции клональной экспансии и дифференцировки. J. Immunol. 174 , 4465–4469 (2005).
CAS PubMed Google ученый
Keppler, SJ, Rosenits, K., Koegl, T., Vucikuja, S. & Aichele, P. Цитокины Signal 3 как модуляторы первичных иммунных ответов во время инфекций: взаимодействие IFN типа I и IL-12 в ответах Т-лимфоцитов CD8. PLoS ONE 7 , e40865 (2012).
CAS PubMed PubMed Central Google ученый
Гимено, Р., Lee, C.K., Schindler, C. & Levy, D. E. Stat1 и Stat2, но не Stat3, регулируют противоречивые сигналы роста, вызванные интерфероном α / β в Т-лимфоцитах. Мол. Клетка. Биол. 25 , 5456–5465 (2005).
CAS PubMed PubMed Central Google ученый
Гил, М. П., Саломон, Р., Лутен, Дж. И Бирон, С. А. Модуляция уровней белка STAT1: механизм, формирующий ответы Т-клеток CD8 in vivo . Кровь 107 , 987–993 (2006).
CAS PubMed PubMed Central Google ученый
Agarwal, P. et al. Регуляция генов и ремоделирование хроматина с помощью IL-12 и IFN типа I в программировании эффекторной функции CD8 Т-клеток и памяти. J. Immunol. 183 , 1695–1704 (2009).
CAS PubMed PubMed Central Google ученый
Маршалл, Х.Д., Принс, А. Л., Берг, Л. Дж. И Уэлш, Р. М. IFN-α / β и собственный MHC отклоняют Т-клетки CD8 на отдельный путь дифференцировки, характеризующийся быстрым приобретением эффекторных функций. J. Immunol. 185 , 1419–1428 (2010).
CAS PubMed PubMed Central Google ученый
Cousens, L.P. et al. Разошлись два пути: опосредованные интерфероном α / β и интерлейкином 12 пути стимулирования Т-клеточного ответа на интерферон γ во время вирусной инфекции. J. Exp. Med. 189 , 1315–1328 (1999).
CAS PubMed PubMed Central Google ученый
Nguyen, K. B. et al. Критическая роль активации STAT4 интерферонами 1 типа в ответе интерферона-γ на вирусную инфекцию. Наука 297 , 2063–2066 (2002).
CAS PubMed Google ученый
Нгуен, К.B. et al. Опосредованное интерфероном α / β ингибирование и продвижение интерферона γ: STAT1 разрешает парадокс. Nature Immunol. 1 , 70–76 (2000).
CAS Google ученый
Томпсон, Л. Дж., Колумам, Г. А., Томас, С. и Мурали-Кришна, К. Врожденные воспалительные сигналы, индуцируемые различными патогенами, по-разному определяют зависимость Т-лимфоцитов CD8 от IFN-I в отношении клональной экспансии и формирования памяти. Дж.Иммунол. 177 , 1746–1754 (2006).
CAS PubMed Google ученый
Pinto, A. K. et al. Временная роль передачи сигналов интерферона типа I в созревании Т-клеток CD8 + во время острой инфекции вируса Западного Нила. PLoS Pathog. 7 , e1002407 (2011).
CAS PubMed PubMed Central Google ученый
Рамос, Х.J. et al. Взаимная чувствительность к интерлейкину-12 и интерферону-α определяет человеческий эффектор CD8 + по сравнению с судьбами Т-клеток центральной памяти. Кровь 113 , 5516–5525 (2009).
CAS PubMed PubMed Central Google ученый
Кольмайер, Дж. Э., Кукенхэм, Т., Робертс, А. Д., Миллер, С. С. и Вудленд, Д. Л. Интерфероны типа I регулируют цитолитическую активность Т-клеток памяти CD8 + в дыхательных путях легких во время заражения респираторным вирусом. Иммунитет 33 , 96–105 (2010).
CAS PubMed PubMed Central Google ученый
Sung, J.H. et al. Хемокиновый контроль центральных Т-клеток памяти имеет решающее значение для ответа на антивирусные функции в лимфатических узлах. Ячейка 150 , 1249–1263 (2012).
CAS PubMed PubMed Central Google ученый
Судья, С.M., Ruiz, A. L., Marie, J. C. & Lauvau, G. Воспалительные моноциты активируют память CD8 + T и врожденные лимфоциты NK независимо от родственного антигена во время инвазии микробных патогенов. Иммунитет 37 , 549–562 (2012).
CAS PubMed PubMed Central Google ученый
Crouse, J. et al. Интерфероны типа I защищают Т-клетки от атаки NK-клеток, опосредованной активирующим рецептором NCR1. Иммунитет 40 , 961–973 (2014).
CAS PubMed Google ученый
Xu, H.C. et al. Интерферон типа I защищает противовирусные Т-клетки CD8 + от цитотоксичности NK-клеток. Иммунитет 40 , 949–960 (2014).
CAS PubMed Google ученый
Hwang, I. et al. Механизмы активации естественных клеток-киллеров при заражении вирусом гриппа. PLoS ONE 7 , e51858 (2012).
CAS PubMed PubMed Central Google ученый
Martinez, J., Huang, X. & Yang, Y. Прямое действие IFN типа I на NK-клетки необходимо для их активации в ответ на вирусную инфекцию коровьей оспы in vivo . J. Immunol. 180 , 1592–1597 (2008).
CAS PubMed Google ученый
Нгуен, К.B. et al. Скоординированные и различные роли IFN-α / β, IL-12 и IL-15 в регуляции ответов NK-клеток на вирусную инфекцию. J. Immunol. 169 , 4279–4287 (2002).
CAS PubMed Google ученый
Lucas, M., Schachterle, W., Oberle, K., Aichele, P. & Diefenbach, A. Дендритные клетки запускают естественные клетки-киллеры с помощью транс -представляющего интерлейкина 15. Иммунитет 26 2007. Т. 503–517.
CAS PubMed PubMed Central Google ученый
Сан, Дж. К., Ма, А. и Ланье, Л. Л. ИЛ-15-независимый ответ NK-клеток на инфекцию цитомегаловирусом мышей. J. Immunol. 183 , 2911–2914 (2009).
CAS PubMed PubMed Central Google ученый
Баранек Т. и др. Дифференциальные ответы иммунных клеток на интерферон I типа способствуют устойчивости хозяина к вирусной инфекции. Клеточный микроб-хозяин 12 , 571–584 (2012).
CAS PubMed Google ученый
Miyagi, T. et al. Высокий базальный STAT4, сбалансированный индукцией STAT1, для контроля эффектов интерферона 1 типа в естественных клетках-киллерах. J. Exp. Med. 204 , 2383–2396 (2007).
CAS PubMed PubMed Central Google ученый
Mack, E.А., Каллал, Л. Е., Демерс, Д. А. и Бирон, С. А. Индукция интерфероном 1 типа продукции естественных клеток-киллеров γ-интерферона для защиты во время инфицирования вирусом лимфоцитарного хориоменингита. МБио 2 , e00169-11 (2011).
PubMed PubMed Central Google ученый
Wang, J., Lin, Q., Langston, H. & Cooper, M. D. Резидентные макрофаги костного мозга продуцируют интерфероны 1 типа, которые могут избирательно ингибировать управляемый интерлейкином-7 рост клеток линии B. Иммунитет 3 , 475–484 (1995).
CAS PubMed Google ученый
Лин, К., Донг, К. и Купер, М. Д. Нарушение развития Т- и В-клеток при лечении интерфероном типа I. J. Exp. Med. 187 , 79–87 (1998).
CAS PubMed PubMed Central Google ученый
Босио, Э., Клунинг, К.L. & Beilharz, M. W. Низкие дозы интерферона I типа перорально снижают количество В-клеток селезенки у мышей. J. Interferon Cytokine Res. 21 , 721–728 (2001).
CAS PubMed Google ученый
Le Bon, A. et al. Интерфероны типа I сильно усиливают гуморальный иммунитет и могут способствовать переключению изотипа путем стимуляции дендритных клеток in vivo . Иммунитет 14 , 461–470 (2001).
CAS PubMed Google ученый
Swanson, C. L. et al. IFN типа I увеличивает вклад фолликулярных В-клеток в независимый от Т-клеток ответ антител. J. Exp. Med. 207 , 1485–1500 (2010).
CAS PubMed PubMed Central Google ученый
Coro, E. S., Chang, W. L. и Baumgarth, N. Сигналы рецептора IFN типа I непосредственно стимулируют местные B-клетки на ранней стадии после инфицирования вирусом гриппа. J. Immunol. 176 , 4343–4351 (2006).
CAS PubMed Google ученый
Chang, W. L. et al. Инфекция вируса гриппа вызывает модуляцию глобального ответа В-клеток дыхательных путей посредством сигналов врожденного иммунитета. J. Immunol. 178 , 1457–1467 (2007).
CAS PubMed Google ученый
Рау, Ф.C., Dieter, J., Luo, Z., Priest, S.O. & Baumgarth, N. B7-1 / 2 (CD80 / CD86) прямой сигнал к В-клеткам усиливает секрецию IgG. J. Immunol. 183 , 7661–7671 (2009).
CAS PubMed PubMed Central Google ученый
Heer, A. K. et al. Передача сигналов TLR точно настраивает ответы В-клеток против гриппа, не регулируя ответы эффекторных Т-клеток. J. Immunol. 178 , 2182–2191 (2007).
CAS PubMed Google ученый
Fink, K. et al. Ранние опосредованные интерфероном сигналы типа I на В-клетках специфически усиливают противовирусные гуморальные ответы. Eur. J. Immunol. 36 , 2094–2105 (2006).
CAS PubMed Google ученый
Bach, P. et al. Гликопротеин вируса везикулярного стоматита, отображающий ретровирусоподобные частицы, индуцирует зависимое от рецептора IFN типа I переключение на нейтрализующие антитела IgG. J. Immunol. 178 , 5839–5847 (2007).
CAS PubMed Google ученый
Purtha, W. E., Chachu, K. A., Virgin, H. W. & Diamond, M. S. Ранняя активация B-клеток после заражения вирусом Западного Нила требует передачи сигналов α / β-интерферона, но не антигенного рецептора. J. Virol. 82 , 10964–10974 (2008).
CAS PubMed PubMed Central Google ученый
Moseman, E.A. et al. Поддержание В-клеток макрофагов субкапсулярного синуса защищает от смертельной вирусной инфекции независимо от адаптивного иммунитета. Иммунитет 36 , 415–426 (2012).
CAS PubMed PubMed Central Google ученый
Бирон, К. А. Интерфероны α и β как иммунные регуляторы — новый взгляд. Иммунитет 14 , 661–664 (2001).
CAS PubMed Google ученый
Дэвидсон, С., Кротта, С., МакКейб, Т. М. и Вак, А. Патогенный потенциал интерферона αβ при острой гриппозной инфекции. Nature Commun. 5 , 3864 (2014). Эта основополагающая публикация показывает, что, в отличие от догмы, IFN типа I могут вызывать заболеваемость и смертность, в отличие от защиты, во время инфицирования вирусом гриппа.
CAS Google ученый
Mandl, J. N. et al. Дивергентная передача сигналов TLR7 и TLR9 и продукция интерферона типа I различают патогенные и непатогенные вирусные инфекции СПИДа. Nature Med. 14 , 1077–1087 (2008).
CAS PubMed Google ученый
Jacquelin, B. et al. Непатогенная SIV-инфекция африканских зеленых мартышек вызывает сильный, но быстро контролируемый ответ IFN типа I. J. Clin. Инвестировать. 119 , 3544–3555 (2009).
CAS PubMed PubMed Central Google ученый
Ротгер, М.и другие. Сравнительная транскриптомика экстремальных фенотипов ВИЧ-1-инфекции человека и SIV-инфекции у сажистых мангабей и макак-резус. J. Clin. Инвестировать. 121 , 2391–2400 (2011).
CAS PubMed PubMed Central Google ученый
McNally, J. M. et al. Истощение сторонних CD8 Т-клеток во время вирус-индуцированных Т-клеточных и интерфероновых ответов. J. Virol. 75 , 5965–5976 (2001).
CAS PubMed PubMed Central Google ученый
Chi, B. et al. Интерфероны α и λ вместе опосредуют подавление CD4 T-клеток, индуцированное респираторно-синцитиальным вирусом. J. Virol. 80 , 5032–5040 (2006).
CAS PubMed PubMed Central Google ученый
Gil, M. P. et al. Регулирование эффектов IFN типа 1 в T-клетках CD8 во время вирусных инфекций: изменение экспрессии STAT4 и STAT1 для функции. Кровь 120 , 3718–3728 (2012).
CAS PubMed PubMed Central Google ученый
Herbeuval, J. P. et al. Дифференциальная экспрессия IFN-α и TRAIL / DR5 в лимфоидной ткани прогрессирующих и непрогрессорных пациентов, инфицированных ВИЧ-1. Proc. Natl Acad. Sci. США 103 , 7000–7005 (2006).
CAS PubMed Google ученый
Харди, А.W., Graham, D. R., Shearer, G. M. & Herbeuval, J. P. ВИЧ превращает плазматические дендритные клетки (pDC) в экспрессирующие TRAIL киллерные pDC и подавляет корецепторы ВИЧ с помощью интерферона-α, индуцированного Toll-подобным рецептором 7. Proc. Natl Acad. Sci. США 104 , 17453–17458 (2007).
CAS PubMed Google ученый
Herbeuval, J. P. et al. CD4 + Смерть Т-клеток, индуцированная инфекционным и неинфекционным ВИЧ-1: роль интерферон-зависимого, TRAIL / DR5-опосредованного апоптоза. Кровь 106 , 3524–3531 (2005).
CAS PubMed PubMed Central Google ученый
van Grevenynghe, J. et al. Потеря В-клеток памяти во время хронической ВИЧ-инфекции вызывается Foxo3a- и TRAIL-опосредованным апоптозом. J. Clin. Инвестировать. 121 , 3877–3888 (2011).
CAS PubMed PubMed Central Google ученый
Лидтке, К., Groger, N., Manns, M.P. и Trautwein, C. Интерферон-α усиливает TRAIL-опосредованный апоптоз путем активации транскрипции каспазы-8 в клетках гепатомы человека. J. Hepatol. 44 , 342–349 (2006).
CAS PubMed Google ученый
Shigeno, M. et al. Интерферон-α сенсибилизирует клетки гепатомы человека к TRAIL-индуцированному апоптозу за счет активации DR5 и инактивации NF-κB. Онкоген 22 , 1653–1662 (2003).
CAS PubMed Google ученый
Toomey, N. L. et al. Индукция TRAIL-опосредованной программы самоубийства интерфероном α при первичной выпотной лимфоме. Онкоген 20 , 7029–7040 (2001).
CAS PubMed Google ученый
Тейджаро, Дж. Р. и др. Стойкая инфекция LCMV контролируется блокадой передачи сигналов интерферона I типа. Наука 340 , 207–211 (2013).
CAS PubMed PubMed Central Google ученый
Wilson, E. B. et al. Блокада хронической передачи сигналов интерферона типа I для контроля стойкой инфекции LCMV. Наука 340 , 202–207 (2013). Ссылки 128 и 129 были первыми, кто показал, что IFN типа I вносят вклад в патогенез, вызывая механизмы подавления при хронической инфекции LCMV.
CAS PubMed PubMed Central Google ученый
Herold, S. et al. Апоптоз эпителия легких при пневмонии, вызванной вирусом гриппа: роль лиганда, индуцирующего апоптоз, экспрессируемого макрофагами. J. Exp. Med. 205 , 3065–3077 (2008).
CAS PubMed PubMed Central Google ученый
Хогнер, К.и другие. Экспрессируемый макрофагами IFN-β способствует апоптотическому повреждению альвеолярных эпителиальных клеток при тяжелой пневмонии, вызванной вирусом гриппа. PLoS Pathog. 9 , e1003188 (2013).
PubMed PubMed Central Google ученый
Chaperot, L. et al. Агонисты вирусов или TLR индуцируют TRAIL-опосредованную цитотоксическую активность плазматических дендритных клеток. J. Immunol. 176 , 248–255 (2006).
CAS PubMed Google ученый
Фудзикура, Д.и другие. Интерферон типа I имеет решающее значение для экспрессии FasL на клетках легких и определяет тяжесть гриппа. PLoS ONE 8 , e55321 (2013).
CAS PubMed PubMed Central Google ученый
McNally, B., Ye, F., Willette, M. и Flano, E. Локальная блокада эпителиального PDL-1 в дыхательных путях усиливает функцию Т-клеток и клиренс вируса во время инфицирования вирусом гриппа. J. Virol. 87 , 12916–12924 (2013).
CAS PubMed PubMed Central Google ученый
Brincks, E. L. et al. Величина ответа Т-клеток на клинически значимую дозу вируса гриппа регулируется TRAIL. J. Immunol. 187 , 4581–4588 (2011).
CAS PubMed PubMed Central Google ученый
MacMicking, J. D. Интерферон-индуцируемые эффекторные механизмы в клеточно-автономном иммунитете. Nature Rev. Immunol. 12 , 367–382 (2012).
CAS Google ученый
Казар Дж., Гиллмор Дж. Д. и Гордон Ф. Б. Влияние интерферона и индукторов интерферона на инфекции, вызванные невирусными внутриклеточными микроорганизмами, Chlamydia trachomatis . Заражение. Иммун. 3 , 825–832 (1971).
CAS PubMed PubMed Central Google ученый
де ла Маза, Л.М., Петерсон, Э. М., Гебель, Дж. М., Фенни, К. В. и Чарнеки, С. В. Индуцированное интерфероном ингибирование Chlamydia trachomatis : диссоциация с противовирусным и антипролиферативным эффектами. Заражение. Иммун. 47 , 719–722 (1985).
CAS PubMed PubMed Central Google ученый
Ishihara, T. et al. Ингибирование роста Chlamydia trachomatis человеческим интерфероном-α: механизмы и синергетический эффект с интерфероном-γ и фактором некроза опухоли-α. Biomed. Res. 26 , 179–185 (2005).
CAS PubMed Google ученый
Rothfuchs, A. G. et al. IFN-α / β-зависимая секреция IFN-γ макрофагами, происходящими из костного мозга, контролирует внутриклеточную бактериальную инфекцию. J. Immunol. 167 , 6453–6461 (2001).
CAS PubMed Google ученый
Rothfuchs, A.G. et al. STAT1 регулирует IFN-αβ- и IFN-γ-зависимый контроль инфекции Chlamydia pneumoniae негемопоэтическими клетками. J. Immunol. 176 , 6982–6990 (2006).
CAS PubMed Google ученый
Qiu, H. et al. Интерфероны типа I повышают восприимчивость к легочной инфекции Chlamydia muridarum за счет усиления апоптоза местных макрофагов. J. Immunol. 181 , 2092–2102 (2008).
CAS PubMed Google ученый
Opitz, B. et al. Legionella pneumophila индуцирует IFNβ в эпителиальных клетках легких через IPS-1 и IRF3, которые также контролируют репликацию бактерий. J. Biol. Chem. 281 , 36173–36179 (2006).
CAS PubMed Google ученый
Plumlee, C. R. et al. Интерфероны направляют эффективный врожденный ответ на инфекцию Legionella pneumophila . J. Biol. Chem. 284 , 30058–30066 (2009).
CAS PubMed PubMed Central Google ученый
Скьявони, Г. и др. IFN типа I защищает разрешающие макрофаги от инфекции Legionella pneumophila через IFN-γ-независимый путь. J. Immunol. 173 , 1266–1275 (2004).
CAS PubMed Google ученый
Золото, Дж.A. et al. Экзогенный γ- и α / β-интерферон спасает человеческие макрофаги от гибели клеток, вызванной Bacillus anthracis . Заражение. Иммун. 72 , 1291–1297 (2004).
CAS PubMed PubMed Central Google ученый
Bukholm, G., Berdal, B.P., Haug, C. & Degre, M. Интерферон фибробластов мыши модифицирует инфекцию Salmonella typhimurium у новорожденных мышей. Заражение. Иммун. 45 , 62–66 (1984).
CAS PubMed PubMed Central Google ученый
Niesel, D. W., Hess, C. B., Cho, Y. J., Klimpel, K. D. & Klimpel, G. R. Природные и рекомбинантные интерфероны ингибируют инвазию эпителиальных клеток Shigella spp. Заражение. Иммун. 52 , 828–833 (1986).
CAS PubMed PubMed Central Google ученый
Манкузо, Г.и другие. Передача сигналов IFN типа I имеет решающее значение для устойчивости хозяина к различным видам патогенных бактерий. J. Immunol. 178 , 3126–3133 (2007).
CAS PubMed Google ученый
Parker, D. et al. Streptococcus pneumoniae ДНК инициирует передачу сигналов интерферона I типа в дыхательных путях. МБио 2 , e00016-11 (2011 г.).
PubMed PubMed Central Google ученый
Вейгент, Д.А., Хафф, Т. Л., Петерсон, Дж. У., Стэнтон, Г. Дж. И Барон, С. Роль интерферона в стрептококковой инфекции у мышей. Microb. Патог. 1 , 399–407 (1986).
CAS PubMed Google ученый
Kelly-Scumpia, K. M. et al. Передача сигналов интерферона типа I в гемопоэтических клетках необходима для выживания при полимикробном сепсисе мышей за счет регуляции CXCL10. J. Exp. Med. 207 , 319–326 (2010).
CAS PubMed PubMed Central Google ученый
Weighardt, H. et al. IFN типа I модулирует защиту хозяина и позднее гипервоспаление при септическом перитоните. J. Immunol. 177 , 5623–5630 (2006).
CAS PubMed Google ученый
Freudenberg, M.A. et al. Мышиный IL-12-независимый путь индукции IFN-γ грамотрицательными бактериями, основанный на активации STAT4 посредством передачи сигналов IFN и IL-18 типа I. J. Immunol. 169 , 1665–1668 (2002).
CAS PubMed Google ученый
Auerbuch, V., Brockstedt, D. G., Meyer-Morse, N., O’Riordan, M. & Portnoy, D. A. Мыши, лишенные рецептора интерферона типа I, устойчивы к Listeria monocytogenes . J. Exp. Med. 200 , 527–533 (2004).
CAS PubMed PubMed Central Google ученый
Карреро, Дж.A., Calderon, B. & Unanue, E.R. Интерферон I типа повышает чувствительность лимфоцитов к апоптозу и снижает устойчивость к инфекции Listeria . J. Exp. Med. 200 , 535–540 (2004).
CAS PubMed PubMed Central Google ученый
О’Коннелл, Р. М. и др. Продукция интерферона типа I увеличивает восприимчивость к инфекции Listeria monocytogenes . J. Exp. Med. 200 , 437–445 (2004). Ссылки 155–157 были первыми публикациями, демонстрирующими неблагоприятное действие IFN типа I при внутриклеточной инфекции бактериями L. monocytogenes .
CAS PubMed PubMed Central Google ученый
Карреро, Дж. А., Кальдерон, Б. и Унануэ, Е. Р. Лимфоциты вредны во время раннего врожденного иммунного ответа против Listeria monocytogenes . J. Exp. Med. 203 , 933–940 (2006).
CAS PubMed PubMed Central Google ученый
Stockinger, S. et al. Продукция IFN типа I повышает чувствительность макрофагов к гибели клеток, вызванной Listeria monocytogenes . J. Immunol. 169 , 6522–6529 (2002).
CAS PubMed Google ученый
Цваферинк, Х., Stockinger, S., Hazemi, P., Lemmens-Gruber, R. & Decker, T. IFN-β увеличивает индуцированную листериолизином O проницаемость мембран и гибель макрофагов. J. Immunol. 180 , 4116–4123 (2008).
CAS PubMed Google ученый
Zwaferink, H., Stockinger, S., Reipert, S. & Decker, T. Стимуляция индуцибельной экспрессии синтазы оксида азота β-интерфероном увеличивает некротическую гибель макрофагов при инфицировании Listeria monocytogenes . Заражение. Иммун. 76 , 1649–1656 (2008).
CAS PubMed PubMed Central Google ученый
Dresing, P., Borkens, S., Kocur, M., Kropp, S. & Scheu, S. Репортерная модель флуоресценции определяет «Tip-DC» как клеточный источник интерферона β при листериозе мышей. PLoS ONE 5 , e15567 (2010).
CAS PubMed PubMed Central Google ученый
Стокингер, С.и другие. Характеристика клеток, продуцирующих интерферон, у мышей, инфицированных Listeria monocytogenes . PLoS Pathog. 5 , e1000355 (2009).
PubMed PubMed Central Google ученый
Rayamajhi, M., Humann, J., Penheiter, K., Andreasen, K. & Lenz, L.L. Индукция IFN-α / β позволяет Listeria monocytogenes подавлять активацию макрофагов IFN-γ. Дж.Exp. Med. 207 , 327–337 (2010).
CAS PubMed PubMed Central Google ученый
Kearney, S.J. et al. IFN типа I подавляют рецептор IFN-γ миелоидных клеток, вызывая рекрутирование комплекса 3 / NGFI-A-связывающий белок 1 в ответ на ранний рост, который подавляет транскрипцию ifngr1 . J. Immunol. 191 , 3384–3392 (2013).
CAS PubMed PubMed Central Google ученый
Manca, C.и другие. Гипервирулентный штамм M. tuberculosis W / Beijing усиливает регуляцию IFN типа I и увеличивает экспрессию негативных регуляторов пути Jak-Stat. J. Interferon Cytokine Res. 25 , 694–701 (2005).
CAS PubMed Google ученый
Ordway, D. et al. Гипервирулентный штамм Mycobacterium tuberculosis HN878 вызывает мощный Th2-ответ с последующим быстрым подавлением. J. Immunol. 179 , 522–531 (2007).
CAS PubMed Google ученый
Stanley, S. A., Johndrow, J. E., Manzanillo, P. & Cox, J. S. Ответ IFN типа I на инфекцию Mycobacterium tuberculosis требует секреции, опосредованной ESX-1, и вносит свой вклад в патогенез. J. Immunol. 178 , 3143–3152 (2007).
CAS PubMed Google ученый
Manca, C.и другие. Вирулентность клинического изолята Mycobacterium tuberculosis у мышей определяется по неспособности индуцировать иммунитет типа Th2 и связана с индукцией IFN-α / β. Proc. Natl Acad. Sci. USA 98 , 5752–5757 (2001). Это исследование было первой демонстрацией IFN типа I, способствующих обострению туберкулеза на экспериментальных моделях мышей.
CAS PubMed Google ученый
Купер, А.М., Перл, Дж. Э., Брукс, Дж. В., Элерс, С. и Орм, И. М. Экспрессия гена синтазы оксида азота 2 не является существенной для ранней борьбы с Mycobacterium tuberculosis в легких мыши. Заражение. Иммун. 68 , 6879–6882 (2000).
CAS PubMed PubMed Central Google ученый
Берри М. П. и др. Интерферон-индуцируемая нейтрофильная сигнатура транскрипции крови при туберкулезе человека. Природа 466 , 973–977 (2010). Это исследование предоставило первое доказательство того, что передача сигналов, опосредованная IFN I типа, связана с активным туберкулезом у людей.
CAS PubMed PubMed Central Google ученый
Клифф, Дж. М. и др. Определенные фазы паттерна экспрессии генов в крови при лечении туберкулеза отражают модуляцию гуморального иммунного ответа. J. Infect.Дис. 207 , 18–29 (2013).
CAS PubMed Google ученый
Maertzdorf, J. et al. Профили экспрессии генов человека восприимчивости и устойчивости к туберкулезу. Genes Immun. 12 , 15–22 (2011).
CAS PubMed Google ученый
Ottenhoff, T.H. et al. Полногеномный профиль экспрессии позволяет определить пути ответа на интерферон 1 типа при активном туберкулезе. PLoS ONE 7 , e45839 (2012).
CAS PubMed PubMed Central Google ученый
Антонелли, Л. Р. и др. Интраназальное введение поли-IC обостряет туберкулез у мышей из-за рекрутирования в легкие популяции моноцитов / макрофагов, допускающих патогены. J. Clin. Инвестировать. 120 , 1674–1682 (2010).
CAS PubMed PubMed Central Google ученый
Майер-Барбер, К.D. et al. Врожденные и адаптивные интерфероны подавляют продукцию IL-1α и IL-1β различными субпопуляциями легочного миелоида во время инфекции Mycobacterium tuberculosis . Иммунитет 35 , 1023–1034 (2011).
CAS PubMed PubMed Central Google ученый
McNab, F. W. et al. Передача сигналов TPL-2-ERK1 / 2 способствует устойчивости хозяина к внутриклеточной бактериальной инфекции за счет отрицательной регуляции продукции IFN типа I. J. Immunol. 191 , 1732–1743 (2013).
CAS PubMed PubMed Central Google ученый
Redford, P. S. et al. Вирус гриппа А нарушает контроль коинфекции Mycobacterium tuberculosis через рецептор-зависимый путь I типа. J. Infect. Дис. 209 , 270–274 (2014).
CAS PubMed Google ученый
Майер-Барбер, К.D. et al. Независимая от каспазы-1 продукция IL-1β имеет решающее значение для устойчивости хозяина к Mycobacterium tuberculosis и не требует передачи сигналов TLR in vivo . J. Immunol. 184 , 3326–3330 (2010).
CAS PubMed PubMed Central Google ученый
de Paus, R.A. et al. Ингибирование иммунных ответов типа I моноцитов человека IFN-α и IFN-β. Цитокин 61 , 645–655 (2013).
CAS PubMed Google ученый
Новиков А. и др. Mycobacterium tuberculosis запускает передачу сигналов IFN типа I хозяина для регулирования продукции IL-1β в макрофагах человека. J. Immunol. 187 , 2540–2547 (2011).
CAS PubMed PubMed Central Google ученый
McNab, F. W. et al. IFN типа I индуцирует продукцию IL-10 независимым от IL-27 образом и блокирует реакцию на IFN-γ для продукции IL-12 и уничтожения бактерий в макрофагах, инфицированных Mycobacterium tuberculosis . J. Immunol. 193 , 3600–3612 (2014). Это ключевое исследование демонстрирует механизмы, лежащие в основе неблагоприятных эффектов IFN типа I при туберкулезе, включая блокирование защитного действия IFN типа II, а также блокирование продукции IL-12, IL-1 и TNF, частично через IL-10. индукция.
CAS PubMed PubMed Central Google ученый
Guarda, G. et al. Интерферон I типа подавляет выработку интерлейкина-1 и активацию инфламмасом. Иммунитет 34 , 213–223 (2011). Это было первое исследование, продемонстрировавшее ингибирование инфламмасомы IFN типа I.
CAS PubMed Google ученый
Mayer-Barber, K. D. et al. Терапия туберкулеза, направленная на хозяина, основанная на взаимодействии интерлейкина-1 и интерферона I типа. Природа 511 , 99–103 (2014). Это плодотворное исследование показывает контррегуляторную функцию IL-1 и IFN типа I в контроле исходов M.tuberculosis через эйкозаноиды.
CAS PubMed PubMed Central Google ученый
Xu, X. J., Reichner, J. S., Mastrofrancesco, B., Henry, W. L. Jr & Albina, J. E. Простагландин E2 подавляет стимулируемое липополисахаридом производство IFN-β. J. Immunol. 180 , 2125–2131 (2008). Это исследование впервые продемонстрировало, что простагландин E2 подавляет стимулируемое липополисахаридом производство IFNβ.
CAS PubMed Google ученый
Coulombe, F. et al. Нацеленное ингибирование простагландина E2 усиливает противовирусный иммунитет за счет индукции интерферона I типа и апоптоза в макрофагах. Иммунитет 40 , 554–568 (2014).
CAS PubMed Google ученый
Телес, Р. М. и др. Интерферон I типа подавляет антимикобактериальные реакции человека, вызванные интерфероном II типа. Наука 339 , 1448–1453 (2013). В этом ключевом исследовании описан механизм опосредованного IFN I типа блокирования защитной роли IFN II типа при туберкулезе.
CAS PubMed PubMed Central Google ученый
Desvignes, L., Wolf, A. J. & Ernst, J. D. Динамическая роль IFN типа I и типа II в ранней инфекции Mycobacterium tuberculosis . Дж.Иммунол. 188 , 6205–6215 (2012). Это важное исследование показывает, что IFN типа I вносят вклад в защиту от M. tuberculosis , когда передача сигналов, опосредованная IFN типа II, является аберрантной.
CAS PubMed PubMed Central Google ученый
Bogunovic, D. et al. Микобактериальные заболевания и нарушение иммунитета IFN-γ у людей с наследственным дефицитом ISG15. Наука 337 , 1684–1688 (2012).
CAS PubMed PubMed Central Google ученый
Mariotti, S. et al. Mycobacterium tuberculosis направляет индуцированную α-интерфероном дифференцировку моноцитов из дендритных клеток в иммунопривилегированные макрофагоподобные клетки-хозяева. Заражение. Иммун. 72 , 4385–4392 (2004).
CAS PubMed PubMed Central Google ученый
Фернандес-Алнемри, Т.и другие. Инфламмасома AIM2 имеет решающее значение для врожденного иммунитета к Francisella tularensis . Nature Immunol. 11 , 385–393 (2010).
CAS Google ученый
Генри, Т., Бротке, А., Вайс, Д. С., Томпсон, Л. Дж. И Монак, Д. М. Передача сигналов интерферона типа I необходима для активации воспаления во время инфекции Francisella . J. Exp. Med. 204 , 987–994 (2007).
CAS PubMed PubMed Central Google ученый
Генри Т. и др. Передача сигналов IFN типа I ограничивает секрецию IL-17A / F γδ Т-клетками во время бактериальных инфекций. J. Immunol. 184 , 3755–3767 (2010).
CAS PubMed PubMed Central Google ученый
Shah, S. et al. Mycobacterium tuberculosis , но не невирулентные микобактерии, ингибирует IFN-β и AIM2 инфламмасомозависимую продукцию IL-1β через свою систему секреции ESX-1. J. Immunol. 191 , 3514–3518 (2013).
CAS PubMed PubMed Central Google ученый
Al Moussawi, K. et al. Индукция интерферона I типа вредна при инфицировании бактерией болезни Уиппла, Tropheryma whipplei . PLoS Pathog. 6 , e1000722 (2010).
PubMed PubMed Central Google ученый
де Алмейда, Л.A. et al. Пути передачи сигналов MyD88 и STING необходимы для IRF3-опосредованной индукции IFN-β в ответ на инфекцию Brucella abortus . PLoS ONE 6 , e23135 (2011 г.).
CAS PubMed PubMed Central Google ученый
Патель, А.А., Ли-Льюис, Х., Хьюз-Хэнкс, Дж., Льюис, Калифорния, и Андерсон, Д.М. Противоположная роль регуляторного фактора 3 интерферона (IRF-3) и передачи сигналов интерферона I типа во время чумы . PLoS Pathog. 8 , e1002817 (2012).
CAS PubMed PubMed Central Google ученый
Робинсон Н. и др. Интерферон I типа вызывает некроптоз в макрофагах при инфицировании сероваром Typhimurium Salmonella enterica . Nature Immunol. 13 , 954–962 (2012).
CAS Google ученый
Ратинам, В.A. et al. TRIF лицензирует каспазо-11-зависимую активацию инфламмасом NLRP3 грамотрицательными бактериями. Ячейка 150 , 606–619 (2012).
CAS PubMed PubMed Central Google ученый
Broz, P. et al. Каспаза-11 увеличивает восприимчивость к инфекции Salmonella в отсутствие каспазы-1. Природа 490 , 288–291 (2012).
CAS PubMed PubMed Central Google ученый
Мартин, Ф.J. et al. Staphylococcus aureus активирует передачу сигналов IFN типа I у мышей и людей через повторяющиеся последовательности Xr белка A. J. Clin. Инвестировать. 119 , 1931–1939 (2009).
CAS PubMed PubMed Central Google ученый
Diefenbach, A. et al. Интерферон 1 типа (IFNα / β) и синтаза оксида азота 2 типа регулируют врожденный иммунный ответ на простейших паразитов. Иммунитет 8 , 77–87 (1998).
CAS PubMed Google ученый
Mattner, J. et al. Регулирование синтазы оксида азота типа 2 интерферонами 1 типа в макрофагах, инфицированных Leishmania major . Eur. J. Immunol. 30 , 2257–2267 (2000).
CAS PubMed Google ученый
Mattner, J. et al. Защита от прогрессирующего лейшманиоза с помощью IFN-β. J. Immunol. 172 , 7574–7582 (2004).
CAS PubMed Google ученый
Khouri, R. et al. IFN-β ухудшает уничтожение супероксид-зависимых паразитов в макрофагах человека: доказательства пагубной роли SOD1 в кожном лейшманиозе. J. Immunol. 182 , 2525–2531 (2009).
CAS PubMed Google ученый
Синь, Л.и другие. Рецептор IFN типа I регулирует функции нейтрофилов и врожденный иммунитет к паразитам Leishmania . J. Immunol. 184 , 7047–7056 (2010).
CAS PubMed PubMed Central Google ученый
Haque, A. et al. Интерфероны типа I подавляют CD4 + Т-клеточно-зависимый контроль паразитов во время инфекции Plasmodium в крови. Eur. J. Immunol. 41 , 2688–2698 (2011).
CAS PubMed Google ученый
Vigario, A. M. et al. Ингибирование малярии Plasmodium yoelii на стадии крови интерфероном α посредством ингибирования продукции его клетки-мишени, ретикулоцита. Кровь 97 , 3966–3971 (2001).
CAS PubMed Google ученый
Vigario, A. M. et al. Рекомбинантный человеческий IFN-α подавляет церебральную малярию и снижает количество паразитов у мышей. J. Immunol. 178 , 6416–6425 (2007).
CAS PubMed Google ученый
Вузин, К., Мастелик, Б., Спонаас, А. М. и Лангхорн, Дж. Классические дендритные клетки CD11c + , а не плазмацитоидные дендритные клетки, индуцируют Т-клеточные ответы на малярию Plasmodium chabaudi . Внутр. J. Parasitol. 40 , 711–719 (2010).
CAS PubMed Google ученый
Лил, П.и другие. Датчики клетки-хозяина для плазмодия активируют врожденный иммунитет против инфекции на стадии печени. Nature Med. 20 , 47–53 (2014).
CAS PubMed Google ученый
Коста, В. М. и др. Интерфероны типа I стимулируют выработку оксида азота и устойчивость к инфекции Trypanosoma cruzi . J. Immunol. 177 , 3193–3200 (2006).
CAS PubMed Google ученый
Кога, Р.и другие. TLR-зависимая индукция IFN-β опосредует защиту хозяина против Trypanosoma cruzi . J. Immunol. 177 , 7059–7066 (2006).
CAS PubMed Google ученый
Лопес, Р., Демик, К. П., Мэнсфилд, Дж. М. и Полнок, Д. М. IFN типа I играют роль в ранней устойчивости, но последующей восприимчивости к африканским трипаносомам. J. Immunol. 181 , 4908–4917 (2008).
CAS PubMed PubMed Central Google ученый
Chessler, A. D., Caradonna, K. L., Da’dara, A. & Burleigh, B.A. Интерфероны типа I повышают восприимчивость хозяина к инфекции Trypanosoma cruzi . Заражение. Иммун. 79 , 2112–2119 (2011).
CAS PubMed PubMed Central Google ученый
Уне, К., Andersson, J. & Orn, A. Роль IFN-α / β и IL-12 в активации естественных клеток-киллеров и продукции интерферона-γ во время экспериментального заражения Trypanosoma cruzi . Clin. Exp. Иммунол. 134 , 195–201 (2003).
CAS PubMed PubMed Central Google ученый
Biondo, C. et al. Передача сигналов IFN-α / β необходима для поляризации цитокиновых ответов по отношению к защитному паттерну типа 1 во время экспериментального криптококкоза. J. Immunol. 181 , 566–573 (2008).
CAS PubMed Google ученый
Biondo, C. et al. Распознавание дрожжевых нуклеиновых кислот запускает ответ на интерферон I типа, защищающий хозяина. Eur. J. Immunol. 41 , 1969–1979 (2011).
CAS PubMed Google ученый
del Fresno, C. et al. Продукция интерферона-β посредством передачи сигналов Dectin-1-Syk-IRF5 в дендритных клетках имеет решающее значение для иммунитета к C.Альбиканс . Иммунитет 38 , 1176–1186 (2013).
CAS PubMed Google ученый
Majer, O. et al. Интерфероны типа I способствуют фатальной иммунопатологии, регулируя воспалительные моноциты и нейтрофилы во время инфекций Candida . PLoS Pathog. 8 , e1002811 (2012).
CAS PubMed PubMed Central Google ученый
Буржуа, К.и другие. Обычные дендритные клетки вызывают IFN-ответ типа I против Candida spp. требуется новая фагосомная TLR7-опосредованная передача сигналов IFN-β. J. Immunol. 186 , 3104–3112 (2011).
CAS PubMed Google ученый
Инглис, Д. О., Беркес, К. А., Хокинг Мюррей, Д. Р. и Сил, А. Конидии, но не дрожжевые клетки грибкового патогена Histoplasma capsulatum запускают врожденный иммунный ответ интерферона I типа в мышиных макрофагах. Заражение. Иммун. 78 , 3871–3882 (2010).
CAS PubMed PubMed Central Google ученый
Лю Л. и др. Мутации STAT1 человека с усилением функции нарушают иммунитет к IL-17 и лежат в основе хронического кожно-слизистого кандидоза. J. Exp. Med. 208 , 1635–1648 (2011).
CAS PubMed PubMed Central Google ученый
van de Veerdonk, F.L. et al. STAT1 мутации при аутосомно-доминантном хроническом кожно-слизистом кандидозе. N. Engl. J. Med. 365 , 54–61 (2011).
CAS PubMed Google ученый
Моренс, Д. М., Таубенбергер, Дж. К. и Фаучи, А. С. Преобладающая роль бактериальной пневмонии как причины смерти при пандемическом гриппе: последствия для готовности к пандемическому гриппу. J. Infect. Дис. 198 , 962–970 (2008).
PubMed PubMed Central Google ученый
Li, W., Moltedo, B. & Moran, T. M. Индукция интерферона типа I во время инфицирования вирусом гриппа увеличивает восприимчивость к вторичной инфекции Streptococcus pneumoniae за счет отрицательной регуляции γδ Т-клеток. J. Virol. 86 , 12304–12312 (2012).
CAS PubMed PubMed Central Google ученый
Накамура, С., Davis, K. M. & Weiser, J. N. Синергетическая стимуляция интерферонов типа I во время коинфекции вирусом гриппа способствует колонизации Streptococcus pneumoniae у мышей. J. Clin. Инвестировать. 121 , 3657–3665 (2011).
CAS PubMed PubMed Central Google ученый
Шахангян А. и др. IFN типа I опосредуют развитие бактериальной пневмонии после гриппа у мышей. Дж.Clin. Инвестировать. 119 , 1910–1920 (2009).
CAS PubMed PubMed Central Google ученый
Тиан, X. et al. Поли I: C повышает восприимчивость к вторичным легочным инфекциям, вызываемым грамположительными бактериями. PLoS ONE 7 , e41879 (2012).
CAS PubMed PubMed Central Google ученый
Наварини, А.A. et al. Повышенная восприимчивость к бактериальной суперинфекции как следствие врожденных противовирусных реакций. Proc. Natl Acad. Sci. США 103 , 15535–15539 (2006).
CAS PubMed Google ученый
Kim, Y.G. et al. Вирусная инфекция усиливает передачу сигналов Nod1 / 2, чтобы усилить летальность, связанную с вторичными бактериальными инфекциями. Клеточный микроб-хозяин 9 , 496–507 (2011).
CAS PubMed PubMed Central Google ученый
Белкайд, Ю. и Хэнд, Т. В. Роль микробиоты в иммунитете и воспалении. Ячейка 157 , 121–141 (2014).
CAS PubMed PubMed Central Google ученый
Ganal, S.C. et al. Праймирование естественных клеток-киллеров неслизистыми мононуклеарными фагоцитами требует инструктивных сигналов от комменсальной микробиоты. Иммунитет 37 , 171–186 (2012).
CAS PubMed Google ученый
Abt, M.C. et al. Комменсальные бактерии калибруют порог активации врожденного противовирусного иммунитета. Иммунитет 37 , 158–170 (2012).
CAS PubMed PubMed Central Google ученый
Tschurtschenthaler, M. et al.Передача сигналов интерферона I типа в кишечном эпителии влияет на клетки Панета, микробную экологию и регенерацию эпителия. Кишечник 63 , 1921–1931 (2014).
CAS PubMed Google ученый
Kawashima, T. et al. Двухцепочечная РНК кишечных комменсалов, но не патогенных бактерий, запускает выработку защитного интерферона-β. Иммунитет 38 , 1187–1197 (2013). Это исследование показывает, что микробиота способствует первоначальному производству защитных IFN типа I.Ссылки 235 и 236 в совокупности демонстрируют новое взаимодействие между микробиотой, IFN типа I и последующей защитой от патогенов.
CAS PubMed Google ученый
Гоф Д. Дж., Мессина Н. Л., Кларк К. Дж., Джонстон Р. В. и Леви Д. Е. Конститутивный интерферон I типа модулирует гомеостатический баланс посредством тонической передачи сигналов. Иммунитет 36 , 166–174 (2012).
CAS PubMed PubMed Central Google ученый
Границы | Двойственная природа интерферонов типа I и типа II
Введение
Интерфероны типа I и II (IFN) представляют собой цитокины, продуцируемые во время вирусной инфекции, которые являются неотъемлемой частью регуляции иммунного ответа.IFN типа I хорошо известны своей способностью напрямую вызывать противовирусный ответ в инфицированных и окружающих клетках за счет активации молекул, которые могут противодействовать репликации вируса (1). Поскольку они продуцируются довольно рано во время инфекции, IFN типа I также важны для активации противовирусного врожденного иммунного ответа, такого как эффекторные функции естественных киллеров (NK) (2). IFN типа II, известный как IFN-γ, хотя и имеет номенклатуру, аналогичную IFN типа I, передает сигналы через другой рецептор и имеет эффекты, независимые от IFN типа I.Как часть врожденного иммунного ответа, они преимущественно вырабатываются естественными клетками-киллерами во время инфекции (2). IFN-γ, как и IFN типа I, способствует противовирусному иммунитету за счет своего регулирующего воздействия на врожденный иммунный ответ и действует как ключевое звено между врожденным иммунным ответом и активацией адаптивного иммунного ответа (3). Помимо их противовирусных эффектов, все больше данных свидетельствует о том, что IFN типа I и типа II обладают иммунорегуляторными функциями, которые имеют решающее значение для ослабления иммунопатогенных механизмов и минимизации побочного ущерба от инфекции.В целом, этот обзор создаст основу и предоставит доказательства, демонстрирующие, что эти два цитокина имеют решающее значение для ограничения репликации вируса и содействия положительному ограничивающему ответ вирусу, одновременно ослабляя иммунопатологию. Однако, если мы рассмотрим мир за пределами вирусных инфекций, эта фундаментальная двойственность IFN типа I и II может быть применена к многочисленным патологическим процессам, от аллергии до аутоиммунных заболеваний.
Производство IFN типов I и II и передача сигналов
IFN типа I состоят из группы структурно схожих цитокинов и включают 13–14 подтипов IFN-α вместе с IFN-β, IFN-ε, IFN-κ, IFN-ω, IFN-δ, IFN-ζ и IFN. -τ (4, 5).Как часть противовирусного ответа врожденного иммунитета, эти цитокины быстро продуцируются после стимуляции рецептора распознавания образов (PRR) (5). Текущие исследования показывают, что начальная волна IFN-β и IFN-α4 продуцируется и зависит от фосфорилирования IRF3 и активации NFκb (6-8). Первоначальная волна IFN типа I впоследствии индуцирует фосфорилирование IRF7 и приводит к петле положительной обратной связи увеличения высвобождения IFN типа I. После образования все эти цитокины передают сигнал через один и тот же рецептор, рецептор IFN типа I (IFNAR).IFNAR состоит из двух субъединиц — IFNAR1 и IFNAR2, которые при связывании с IFN типа I подвергаются эндоцитозу и активируют связанные с ними тирозинкиназы Tyk2 и Jak1 (4, 9). Классический сигнальный каскад приводит к фосфорилированию STAT2 и STAT1, которые образуют комплекс с IRF9, известный как фактор 3 гена, стимулированный IFN (ISGF3) (4). Затем ISGF3 приводит к экспрессии генов, стимулированных IFN (4). Помимо ISGF3, IFN типа I могут также индуцировать фосфорилирование и димеризацию STAT3, STAT4, STAT5 и STAT6, и было показано, что они вызывают активацию Rap1, CrkL, киназ Map, IRS-1 и -2, Vav, RAC1 и PI3-. пути передачи киназного сигнала (4, 10–14).Интересно, что IFN-β, как было показано, дополнительно передает сигнал через субъединицу IFNAR1 независимо от IFNAR2 и переносится по неканоническому сигнальному пути (15).
IFN типа II преимущественно продуцируется NK-клетками во время противовирусного врожденного иммунного ответа (16). Множество доказательств показали, что IFN, IL-12, IL-15 и IL-18 типа I способны индуцировать продукцию IFN-γ из NK-клеток (17). Производство IFN-γ NK-клеток зависит от фосфорилирования STAT4. После высвобождения IFN-γ передает сигнал через рецептор IFN-γ (IFNGR), состоящий из субъединиц IFNGR1 и IFNGR2.В классическом сигнальном пути связывание IFN-γ с IFNGR приводит к активации JAK1 и JAK2, что приводит к гомодимеризации и фосфорилированию STAT1 (18). Однако, как и IFN типа I, IFN-γ также передает сигнал через альтернативные пути, включая STAT4, Erk1 / 2, Pyk2 и CrkL, среди прочих (18).
IFN типа I: овладение противовирусным ответом
IFN типа I — один из первых цитокинов, продуцируемых во время вирусной инфекции. В контексте инфекции HSV-2, например, существует начальная волна продукции IFN-β через 12 часов после инфицирования, за которой следует продукция IFN-β и IFN-α через 48 часов после инфицирования (19, 20 ).Эта ранняя продукция IFN типа I имеет решающее значение для индукции как противовирусного ответа в инфицированных клетках, так и для клеток-мишеней, а также для активации клеток врожденного иммунитета, которые в конечном итоге будут служить для контроля репликации вируса и активации адаптивного иммунного ответа для устранения инфекции и генерировать память для быстрого реагирования на будущие инфекции (21).
IFN типа I — это хорошо известный стимулятор антивирусных генов, нацеленных против предотвращения репликации вируса из клеток-мишеней.Когда их производство стимулируется вирусной инфекцией, IFN типа I может действовать аутокринным, паракринным или системным образом. Их защитная роль во время вирусной инфекции подчеркивается повышенной смертностью, наблюдаемой у мышей с дефицитом рецептора IFN типа I ( Ifnar, — / — ) по сравнению с их контрольными аналогами при заражении вирусом (22, 23). Было показано, что при связывании со своим рецептором IFN типа I индуцирует более 300 ISG. Было обнаружено, что из этих 300 генов 51 участвует в защите хозяина, в то время как другие гены участвуют в воспалении, передаче сигналов, транскрипции и иммуномодуляции, среди прочего (24, 25).Кроме того, De Veer et al. исследовали способность определенных ISG или комбинаций ISG ингибировать репликацию вируса за счет сверхэкспрессии отдельных ISG до заражения вирусом (24). Они обнаружили, что многие ISG способны подавлять репликацию вирусов, причем некоторые действуют на широкий спектр вирусов, в то время как другие эффективны только против определенных вирусов (24). Интересно, что они обнаружили, что выбранные ISG усиливают репликацию вируса в их экспериментальной системе (24). Антивирусные ISG могут препятствовать репликации вируса с помощью нескольких механизмов.Например, протеинкиназа R подавляет трансляционные функции клеток (1). 2’5 OAS и RNaseL, с другой стороны, разрушают РНК (26, 27). Другие противовирусные активности ISG могут предотвращать высвобождение вирионов, подавлять проникновение вируса и ингибировать транскрипцию вируса (28).
Помимо индукции противовирусных ISG, IFN типа I являются ключевыми регуляторами врожденного иммунного ответа. В литературе по IFN I типа возникла тема, согласно которой продукция IFN I типа в острой форме способствует благоприятным противовирусным ответам, в то время как продукция IFN I типа при хроническом течении может оказывать подавляющее и пагубное влияние на иммунный ответ.В этом разделе мы исследуем способность IFN типа I способствовать противовирусным функциям в дендритных клетках (DC), моноцитах и NK-клетках.
Дендритные клетки имеют решающее значение для активации противовирусных Т-клеток (29). Было показано, что стимуляция IFN типа I усиливает экспрессию MHC II и презентацию антигенов, а также активирует костимуляторные молекулы и способствует созреванию DC (29–32). Дальнейшие данные свидетельствуют о том, что IFN типа I способен увеличивать дифференцировку плазматических DC в ДК, происходящие из миелоида, для увеличения активации Т-клеток (33).
Воспалительные моноциты быстро рекрутируются в места инфекции, где они затем могут стимулировать локальную и мигрирующую противовирусную функцию иммунных клеток, способствовать воспалению и дифференцироваться в макрофаги и ДК (34). В очагах воспаления IFNs типа I индуцируют продукцию CCL2 для рекрутирования воспалительных моноцитов (2, 34). IFN типа I, продуцируемый во время вагинальной инфекции HSV-1, побуждает резидентные в ткани макрофаги и DC продуцировать CCL2 для рекрутирования и начальной популяции воспалительных моноцитов, которые затем активируют петли положительной обратной связи для производства большего количества CCL2 для привлечения дополнительных воспалительных моноцитов (35).Аналогичное явление наблюдалось во время вагинальной инфекции HSV-2, инфекции гриппа и рекрутирования воспалительных моноцитов в мозг во время LPS-индуцированного системного воспаления (2, 36, 37). При инфекции гриппа отсутствие IFNAR приводило к дифференцировке промежуточного звена Ly6C. экспрессирующие моноциты, а не воспалительные моноциты Ly6C hi , которые, кроме того, имели другой фенотип (36). Кроме того, Seo et al. продемонстрировали, что в костном мозге Ifnar — / — значительно снизилась дифференцировка гемопоэтических клеток в воспалительные моноциты при наличии инфекции гриппа (38).Что касается макрофагов, IFN типа I имеет более подавляющую функцию и будет обсуждаться ниже.
IFN типа I и функциональность противовирусных NK-клеток тесно взаимосвязаны, причем IFN типа I стал ключевым регулятором NK-клеток. Как и их моноцитарные аналоги, IFN типа I участвует в привлечении NK-клеток к участкам воспаления. Во время вагинальной инфекции HSV-1 IFN типа I требовался для индукции продукции эпителием CCL3, CCL4 и CCL5 для рекрутирования NK-клеток на слизистую влагалища (35).Кроме того, IFN типа I участвует в активации противовирусных функций NK-клеток. Во время инфекции у NK-клеток есть несколько видов оружия, которые они могут использовать для борьбы с инфекцией. При активации они могут высвобождать IFN-γ, цитотоксические гранулы и вызывать гибель инфицированных клеток. IFN типа I участвует как в цитотоксичности NK-клеток, так и в продукции IFN-γ NK-клетками. Было показано, что мыши с дефицитом STAT1, ключевого фактора транскрипции, расположенного ниже рецептора IFN типа I, имеют сниженную цитотоксичность NK-клеток и повышенную вирус-индуцированную смертность по сравнению с контрольными мышами (39).В контексте продукции IFN-γ NK-клетками IFN типа I важен для этого процесса при множественных вирусных инфекциях, включая MCMV, аденовирус, вирус осповакцины и HSV (2, 40–43). Было показано, что IFN типа I действует непосредственно на NK-клетки, вызывая их высвобождение IFN-γ в контексте инфекций, вызванных аденовирусом, вирусом осповакцины и инфекциями LCMV, тогда как другие данные свидетельствуют о том, что IFN типа I стимулирует DC к транс-презентации IL-15. для активации NK-клеток при инфекции MCMV (2, 40–44). Недавно мы представили доказательства, демонстрирующие, что продукция IFN-γ NK-клетками зависит от индукции IFN типа I IL-18 из воспалительных моноцитов, а не от DC при инфекции HSV-2 слизистой оболочки (2).Наши различающиеся результаты могут быть связаны с путём заражения, когда в предыдущих доказательствах использовались системы in vitro и , или пути заражения вне слизистых оболочек.
Отрицательная регуляция IFN типа I: помимо вмешательства в инфекцию
По мере появления большего количества данных растет понимание и признание подавляющих и негативных регуляторных аспектов IFN типа I. Ранее исследования показали, что IFN типа I оказывает антипролиферативное действие на иммунные клетки и клеточные линии (45, 46).Недавно Thomas et al. элегантно продемонстрировано, что, хотя все подтипы IFN типа I способны вызывать внутриклеточный противовирусный ответ, сродство отдельного подтипа IFN типа I к рецептору IFN типа I в значительной степени определяет способность IFN типа I ингибировать клеточную пролиферацию (47). Антипролиферативный эффект IFN типа I требует более высокого сродства связывания с IFNAR (47). Помимо пролиферации, IFN типа I также может подавлять функции клеток врожденного иммунитета.
В то время как острая инфекция и активация IFN типа I полезны для усиления активации DC адаптивных функций T-клеток, было показано, что хроническая инфекция с устойчивым продуцированием IFN типа I подавляет экспансию DC и индуцирует супрессивный фенотип.При хронической инфекции LCMV стойкая сигнатура IFN типа I предотвращала дифференцировку BM и пролиферацию обычных DC (48, 49). Кроме того, стимуляция селезеночных DC с помощью IFN-β, in vivo , приводила к снижению общего числа клеток CD11c +. Было показано, что помимо уменьшения экспансии DC, сигнатура IFN хронического типа I повышает экспрессию PD-L1 и IL-10 как в DC, так и в макрофагах (50, 51).
IFN типа I в значительной степени оказывает подавляющее действие на макрофаги. В литературе в основном предполагается, что он подавляет экспрессию ими рецептора IFN-γ, делая их менее чувствительными к стимуляции IFN-γ (52).При некоторых бактериальных инфекциях, таких как francisella tularensis и mycobacterium tuberculosis , передача сигналов IFN типа I вредна для хозяина (53–56). Способность IFN типа I подавлять рецептор IFN-γ на макрофагах, вероятно, вносит свой вклад в это явление.
Как упоминалось ранее, было показано, что IFN типа I имеет решающее значение для индукции противовирусных функций NK-клеток. И наоборот, что почти парадоксально, IFN типа I также подавляет те самые функции, которые он обеспечивает.Во время заражения LCMV Teijaro et al. обнаружили, что блокирование рецептора IFN типа I спасает продукцию IFN-γ от NK-клеток (48). Кроме того, стойкая продукция IFN типа I может индуцировать экспрессию лигандов PD-L1, что является механизмом, который может подавлять противовирусную функцию NK-клеток (48). Хотя введение пегилированного IFN-α2 привело к увеличению активации NK-клеток, экспрессии TRAIL и рецептора CD107a у лиц, инфицированных HCV, наблюдалось сопутствующее снижение количества IFN-γ + NK-клеток в компартменте PBMC (57, 58).Этот противоречивый эффект IFN типа I может происходить из-за времени и величины продуцирования IFN типа I или сдвига в ассоциации фактора транскрипции с рецептором IFN типа I. При инфекции listeria monocytogenes экзогенный IFN-β, введенный в более ранний момент времени во время инфекции, был способен активировать NK-клетки и способствовать устранению инфекции, тогда как эндогенный IFN-β, продуцируемый через 24 часа после инфицирования, приводил к нарушению Ответ NK-клеток (59). Кроме того, Marshall et al.обнаружили, что стимуляция NK-клеток супернатантами от CpG-стимулированных pDC в дополнение к IFN-α подавляла высвобождение IFN-γ из NK-клеток (60). В плодотворном исследовании Miyagi et al. они продемонстрировали, что стимуляция NK-клеток IFN типа I сдвигает баланс факторов транскрипции от ассоциации STAT4 с рецептором IFN типа I, которая после фосфорилирования и ядерной транслокации приводит к начальному выбросу IFN-γ, к ассоциации STAT1, которая впоследствии привело к ингибированию продукции IFN-γ NK-клетками (61).Таким образом, по мере того, как увеличивающееся количество IFN типа I высвобождается во время инфекции, это приводит к увеличению сдвига в ассоциации между STAT1 и IFNAR и, в конечном итоге, к ингибированию продукции IFN-γ из NK-клеток.
Было показано, что IFN типа I не только способствует противовирусным функциям (и позже ограничивает те же самые функции), но и ограничивает повреждающие иммунные реакции, которые могут привести к патологии тканей и побочным повреждениям. В модели инфекции гриппа отсутствие рецептора IFN типа I привело к значительной вирусной иммунопатологии.Duerr et al. продемонстрировали, что эта патология опосредована активацией цитокинов 2 типа из нерегулируемых врожденных лимфоидных клеток 2 типа (ILC2) (62). Таким образом, IFN типа I подавляет функцию ILC2 во время вирусной инфекции. Было также обнаружено, что IFN типа I подавляет провоспалительную функцию моноцитов NOS2 + Ly6C lo (36). Более того, IFN типа I подавляет рекрутирование нейтрофилов, подавляя продукцию эпителиальных CXCL1 и CXCL2 во время вирусной инфекции (35, 38, 63). Нейтрофилы не только могут продуцировать множество молекул и протеаз, которые могут способствовать воспалению и повреждению тканей, но и вызывают обострения астмы у мышей, вызванные риновирусом (64, 65).Таблица, в которой сравнивается влияние IFN типа I на врожденный иммунный ответ, представлена в таблице 1.
Таблица 1 . Роль IFN типа I в регуляции противовирусного врожденного иммунного ответа.
Раскрытие двойственной природы IFN типа I
В литературе появляются различные темы, которые объясняют эту лежащую в основе двойную функциональность IFN типа I. Во-первых, острые вирусные инфекции и преходящая продукция IFN типа I, по-видимому, способствуют противовирусному ответу со стороны клеток врожденного иммунитета, в то время как хронические инфекции со стойкими сигнатурами IFN типа I приводят к ослаблению противовирусного ответа (66).Это особенно очевидно в случаях хронического LCMV, которое привело к ухудшению лимфоидной архитектуры и подавлению Т-клеток, опосредованному повышенной экспрессией PD-L1 на ДК (48, 49). При инфицировании вирусом иммунодефицита обезьян (SIV) раннее введение IFN типа I приводило к снижению вирусной нагрузки, в то время как постоянное введение IFN типа I приводило к повышенному уровню вируса и истощению CD4 + Т-клеток (67, 68). Во-вторых, время и величина продуцируемого IFN типа I могут приводить к различным ответам IFN типа I, как обсуждалось ранее.
Растущий объем данных показал, что отдельные подтипы IFN типа I могут иметь разные эффекты, несмотря на передачу сигналов через один и тот же рецептор. Действительно, стимуляция DC различными подтипами IFN типа I приводила к различным профилям экспрессии рецепторов и продукции цитокинов (69). Кроме того, предварительная обработка инфицированных гриппом мышей одной и той же дозой различных подтипов IFN типа I приводила к различным уровням репликации вируса, причем IFN-α5 и IFN-α6 имели наибольшее снижение вирусной нагрузки (70).Их различное сродство к рецептору IFN типа I, длина связывания рецептора, уровень экспрессии рецептора IFN типа I и врожденные клеточные различия могут лежать в основе способности этих подтипов IFN типа I вызывать разные ответы (71). Более подробно об этом говорится в обзоре Гидеона Шрайбера (71). Однако в контексте вирусной инфекции мы предполагаем, что IFN типа I оптимизирует противовирусный ответ, активируя и усиливая полезную функцию клеток врожденного иммунитета, ограничивая при этом вредные и патологические иммунные ответы, которые могут вызывать ненужное повреждение тканей.
IFN типа II: антивирусное состояние психики
IFN-γ является важным компонентом врожденного противовирусного ответа и преимущественно продуцируется NK-клетками или врожденными лимфоидными клетками 1 типа (2, 72, 73). В контексте инфекции HSV-2 отсутствие продукции IFN-γ приводит к усилению репликации вируса и снижению выживаемости (74, 75). Действительно, было показано, что IFN-γ индуцирует продукцию NO, мощного ингибитора репликации вируса, из окружающих клеток (72, 76). Кроме того, IFN-γ может индуцировать внутриклеточные противовирусные программы, включая PKR, в результате перекрытия экспрессии их генов с IFN типа I (77).Однако помимо этого было продемонстрировано, что сам IFN-γ влияет на функцию окружающих клеток врожденного иммунитета, включая макрофаги и DC.
Воздействие противовирусного IFN-γ на антигенпрезентирующие клетки (APC) заключается в усилении стимуляции адаптивного противовирусного ответа как для устранения инфекции, так и для создания памяти в качестве защиты от будущих инфекций (78, 79). Таким образом, это критический компонент реакции Th2. Стимуляция IFN-γ усиливает процесс презентации антигена во время праймирования Т-клеток.Было показано, что он увеличивает различные аспекты презентации антигена, включая эффективность, количество, качество и разнообразие пептидов, загружаемых в рецептор MHC I (80). Наряду с MHC I, IFN-γ увеличивает экспрессию MHC II и созревание DC (81). Кроме того, он индуцирует экспрессию IL-12 и костимулирующего CD80 в антигенпрезентирующих клетках, что является критическим компонентом поляризации Th2 (82–84).
Что касается макрофагов, то IFN-γ индуцированная продукция NO из этих клеток не только подавляет репликацию вируса, но также сильно расширяет сосуды кровеносных сосудов, уменьшая кровоток и обеспечивая повышенную экстравазацию рекрутированных иммунных клеток в места инфекции и воспаления (80). .Кроме того, IFN-γ, как было показано, «запускает» макрофаги для высвобождения активных форм кислорода посредством активации клеточных компонентов, необходимых для этой функции (85). IFN-γ также, по-видимому, увеличивает фагоцитоз, опосредованный рецепторами макрофагов, за счет активации рецепторов комплемента, хотя это наблюдается в большей степени при бактериальных инфекциях, чем при вирусных (86). Кроме того, IFN-γ способствует поляризации макрофагов до фенотипа M1 и заставляет эти клетки продуцировать провоспалительные цитокины IL-12, TNF-α и IL-1β (87, 88).
Отрицательное регулирование IFN типа II: новая роль
IFN-γ имеет много общих черт с IFN типа I, включая подавление иммунных ответов типа 2 и ингибирование пролиферации. Однако в контексте вирусной инфекции мы полагаем, что IFN-γ, высвобождаемый во время врожденного иммунного ответа, играет более поддерживающую роль в этом отношении, поскольку он менее эффективен по сравнению с IFN типа I. Помимо IFN типа I, IFN-γ выполняет ряд иммунорегуляторных функций, которые служат для оптимизации противовирусного ответа и ограничения чрезмерных ответов, которые могут привести к побочным повреждениям.
Оптимальный противовирусный ответ включает как активацию полезных иммунных ответов, так и одновременное подавление непрактичных и потенциально вредных реакций. В контексте вирусной инфекции IFN-γ является прототипным цитокином, стимулирующим Th2. Кроме того, данные Kang et al. демонстрирует, что IFN-γ играет критическую роль не только в поляризации макрофагов до фенотипа M1, но и активно подавляет путь поляризации M2 (87). Однако недавние данные показали, что IFN типа I способен подавлять иммунитет типа 2.Независимо и Duerr et al. и Моро и др. продемонстрировали, что, как и IFN типа I, IFN-γ способен подавлять пролиферацию ILC2 и продукцию цитокинов типа 2 (62, 89). Действительно, введение in vivo и IFN-γ сильно подавляло индуцированную IL-33 пролиферацию ILC2, которая зависела от передачи сигналов STAT1 (62). В контексте инфекции RSV, мыши Stat1 — / — , фактор транскрипции, расположенный ниже IFN типа I и типа II, приводили к усилению патологии легких из-за увеличения продукции цитокинов из ILC2 и ILC3 (90).Кроме того, на мышиной модели инфекции гриппа введение IFN-γ подавляло функцию ILC2, в то время как дефицит IFN-γ приводил к увеличению высвобождения IL-5 и амфирегулина из ILC2. Эти авторы в конечном итоге обнаружили, что подавляющее действие IFN-γ на функцию ILC2 приводит к усилению патологии легких (91).
Наряду с подавлением иммунных ответов есть данные, демонстрирующие, что IFN-γ может косвенно индуцировать иммунорегуляторные эффекты за счет активации PD-L1 и дифференцировки подавляющих клеток миелоидного происхождения.Было показано, что в сочетании с GM-CSF IFN-γ дифференцирует моноциты в супрессорные клетки миелоидного происхождения (MDSC) in vitro (92). На модели эндотоксемии на мышах IFN-γ также повышает регуляцию PD-L1 на нейтрофилах (93). Таблица, в которой сравнивается влияние IFN-γ на врожденный иммунный ответ, представлена в таблице 2.
Таблица 2 . Роль IFN-γ в регуляции противовирусного врожденного иммунного ответа.
Понимание двойственной природы IFN-γ: разгадывая парадокс
Подобно IFN типа I, IFN-γ обладает как кажущимися парадоксальными активирующими, так и подавляющими функциями в отношении врожденного противовирусного ответа.Эти функции можно разделить на части, если мы исследуем тип клеток, на которые действует IFN-γ, и включим в картину другие цитокины с IFN-γ. Если мы рассмотрим макрофаги, IFN-γ имеет дополнительные эффекты по индукции противовирусной функции макрофагов. IFN-γ индуцирует продукцию NO, усиливает антигенпредставляющую функцию макрофагов и общий фенотип M1, одновременно активно подавляя фенотип M2 (72, 80, 87). Подобно макрофагам, IFN-γ преимущественно увеличивает функцию презентации антигена DC.Кроме того, IFN-γ оказывает преимущественно подавляющее действие на клетки ILC2 (62).
IFN-γ как цитокин редко действует в одиночку, и его эффекты следует рассматривать в сочетании с другими цитокинами, присутствующими в локальном микроокружении. Комбинаторный эффект между IFN-γ и другими цитокинами, вероятно, играет роль в конечном результате стимуляции IFN-γ. В самом деле, как IFN-γ, так и TNF-α, как было показано, действуют синергично в повышении регуляции iNOS в макрофагах. Salim et al. использовали математическое моделирование, чтобы выделить роли каждого цитокина, и обнаружили, что TNF-α в значительной степени отвечает за время индукции iNOS, вызывая быстрый ответ, тогда как IFN-γ влияет на уровни и концентрации продукции NO (94).Кроме того, роль IFN-γ в процессе дифференцировки in vitro и MDSC требует первоначального примирования с помощью GM-CSF. Ribechini et al. обнаружили, что GM-CSF изменяет сигнальный путь IFN-γ, позволяя ему дифференцировать моноциты в MDSC (92). В недавней статье Zha et al. они обнаружили, что IFN-γ способен подавлять функции цитокинов gp130, в частности способность OSM, дифференцировать мезенхимальные стволовые клетки за счет активации STAT1, сопутствующего снижения активации STAT3 и интернализации рецептора gp130 (95).Таким образом, IFN-γ может как изменяться дополнительной передачей сигналов цитокинов, так и регулировать пути передачи сигналов других цитокинов.
Собираем кусочки головоломки
По мере того, как мы начинаем складывать вместе кусочки головоломки типа I и типа II IFN, мы видим, что эти два цитокина действуют согласованно друг с другом, ограничивая репликацию вируса и стимулируя противовирусный адаптивный иммунный ответ, одновременно подавляя пагубные функции других иммунных систем. клетки для ограничения патологии тканей.Используя в качестве примера вагинальную инфекцию HSV-2, мы обнаружили, что существует несколько волн продукции IFN типа I, начиная с IFN-β через 12 часов после инфицирования (20). Эта ранняя волна IFN-β, вероятно, ответственна за индукцию MCP-1-опосредованного рекрутирования воспалительных моноцитов, что в конечном итоге приводит к индуцированной IL-18 продукции IFN-γ NK-клетками (2). Отсюда мы наблюдали вторую волну продукции IFN типа I, как IFN-α, так и IFN-β, через 48 часов после инфицирования (19). Наряду с IFN типа I наблюдается резкое увеличение IFN-γ из NK-клеток через 48 часов после заражения (16).IFN-γ, высвобождаемый NK-клетками, также негативно регулируется IFN типа I, поскольку NK-клетки, лишенные IFNAR, увеличивают продукцию IFN-γ в контексте инфекции HSV-2 (2). Эта вторая волна IFN типа I и II, вероятно, работают вместе друг с другом, способствуя созреванию APC, активации костимулирующих молекул, а также процессингу и презентации антигена для усиления поляризации Th2, одновременно подавляя опосредованную ILC2 иммунопатологию (Рисунок 1).
Рисунок 1 .Роль IFNs во врожденном иммунном ответе на инфекцию HSV-2. (1) IFN-β продуцируется через 12 часов после заражения и посредством аутокринной и паракринной передачи сигналов переводит окружающие клетки в антивирусное состояние. (2) IFN-β, продуцируемый через 12 часов после инфицирования, также увеличивает продукцию CCL2 между 1 и 2 днями после инфицирования, что приводит к рекрутированию воспалительных моноцитов и участвует в рекрутировании NK-клеток. (3) Привлеченные воспалительные моноциты приводят к высвобождению IL-18, который стимулирует NK-клетки продуцировать IFN-γ через 48 часов после инфицирования.(4) Вторая волна IFN типа I, включая как IFN-α, так и IFN-β, выявляется через 48 часов после заражения. (5) И IFN-γ, и IFN типа I, продуцируемые через 48 часов после инфицирования, усиливают способность презентации антигена APC для стимуляции адаптивного иммунного ответа Th2. (6) Одновременно IFN типа I через 48 ч ингибируют ILC2-опосредованную вирус-индуцированную иммунопатологию. IFN-γ, поддерживающий негативные регуляторные эффекты IFN типа I, также подавляет опосредованную ILC2 иммунопатологию.
Без IFN типа I и, возможно, IFN типа II, происходит неконтролируемая репликация вируса в сочетании с неконтролируемым воспалением, которые работают вместе, вызывая гибель тканей.С другой стороны, хроническая сигнатура IFN типа I вредна, поскольку может привести к иммуносупрессии и усилению репликации вируса. Таким образом, мы полагаем, что для регулирования оптимального и благоприятного противовирусного врожденного иммунного ответа требуется сбалансированный и соответствующий тип I IFN-ответ.
Клинические последствия: выход за рамки инфекции
В то время как основное внимание в этом обзоре уделяется IFN типа I и II и их способности контролировать врожденный иммунный ответ, IFN участвуют в нескольких неинфекционных патологических состояниях.Некоторые аутоиммунные заболевания, наиболее заметным из которых является системная красная волчанка (СКВ), имеют высокие сигнатуры IFN I типа, связанные с их патологией (96). Антитело, нацеленное на человеческий IFNAR, недавно было разработано, чтобы блокировать эту сигнатуру с терапевтическим эффектом (97). С другой стороны, терапия IFN-β оказалась успешной в лечении рассеянного склероза (98). Действительно, концепции, обсуждаемые в этом обзоре, актуальны в контексте фармакотерапии, нацеленной на пути IFN типа I и типа II.Возникает вопрос: какова роль IFN типа I вне вирусной инфекции? Растущее количество доказательств показывает, что продукция IFN типа I не изолирована от раздражителей инфекционного заболевания, она может вырабатываться во время любого воспалительного инсульта. Таким образом, наше фундаментальное понимание врожденного иммунного ответа во время вирусной инфекции имеет важное значение для многих болезненных процессов, помимо вирусной инфекции.
Авторские взносы
AL разработал темы и идеи и написал рукопись.А.А. руководил и редактировал рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана грантом Канадского института исследований в области здравоохранения (CIHR), предоставленным Али Ашкару. Али Ашкар также является стипендиатом Канадского исследовательского центра уровня 1 CIHR.
Список литературы
1.Мерс Э., Чонг К., Галабру Дж., Томас Н.С., Керр И.М., Уильямс Б.Р. и др. Молекулярное клонирование и характеристика человеческой двухцепочечной РНК-активированной протеинкиназы, индуцированной интерфероном. Cell (1990) 62: 379–90. DOI: 10.1016 / 0092-8674 (90)
-NPubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Ли А.Дж., Чен Б., Чу М.В., Барра Н.Г., Шенуда М.М., Нхам Т. и др. Воспалительным моноцитам требуется передача сигналов рецептора интерферона I типа для активации NK-клеток через IL-18 во время вирусной инфекции слизистой оболочки. J Exp Med . (2017) 214: 1153–67. DOI: 10.1084 / jem.20160880
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Сунь Л., Ву Дж, Ду Ф, Чен Х, Чен З. Циклическая GMP-AMP-синтаза представляет собой цитозольный ДНК-сенсор, который активирует путь интерферона I типа. Наука (2013) 339: 786–91. DOI: 10.1126 / science.1232458
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Хонда К., Такаока А., Танигучи Т. Индукция гена интерферона типа I [скорректированная] семейством факторов регуляции интерферона факторов транскрипции. Иммунитет (2006) 25: 349–60. DOI: 10.1016 / j.immuni.2006.08.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Тамура Т., Янаи Х., Савицкий Д., Танигучи Т. Факторы транскрипции семейства IRF в иммунитете и онкогенезе. Annu Rev Immunol. (2008) 26: 535–84. DOI: 10.1146 / annurev.immunol.26.021607.0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Макнаб Ф., Майер-Барбер К., Шер А., Вак А., О’Гарра А. и интерфероны типа I при инфекционных заболеваниях Nat Rev Immunol .(2015) 15: 87–103. DOI: 10.1038 / nri3787
CrossRef Полный текст
9. Маркетти М., Монье М.Н., Фрадаграда А., Митчелл К., Байшелье Ф., Эйд П. и др. Стат-опосредованная передача сигналов, индуцированная интерферонами типа I и типа II (IFN), по-разному контролируется посредством ассоциации липидных микродоменов и клатрин-зависимого эндоцитоза рецепторов IFN. Mol Biol Cell (2006) 17: 2896–909. DOI: 10.1091 / mbc.e06-01-0076
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10.Уддин С., Лекмин Ф., Шарма Н., Майчжак Б., Майер И., Янг П.Р. и др. Путь митоген-активируемой протеинкиназы Rac1 / p38 необходим для интерферон-альфа-зависимой транскрипционной активации, но не фосфорилирования серина белков Stat. Дж Биол Химия . (2000) 275: 27634–40. DOI: 10.1074 / jbc.M003170200
CrossRef Полный текст | Google Scholar
11. Уддин С., Йенуш Л., Сан XJ, Sweet ME, White MF, Platanias LC. Интерферон-альфа взаимодействует с субстратом-1 рецептора инсулина для связывания с фосфатидилинозитол-3′-киназой. Дж Биол Химия . (1995) 270: 15938–41. DOI: 10.1074 / jbc.270.27.15938
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Уддин С., Майчжак Б., Вудсон Дж., Арункумар П., Алсайед Ю., Пайн Р. и др. Активация митоген-активируемой протеинкиназы p38 интерферонами I типа. Дж Биол Химия . (1999) 274: 30127–31. DOI: 10.1074 / jbc.274.42.30127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Platanias LC, Sweet ME.Интерферон альфа индуцирует быстрое фосфорилирование тирозина протоонкогенного продукта vav в гемопоэтических клетках. Дж Биол Химия . (1994) 269: 3143–6.
PubMed Аннотация | Google Scholar
14. Ахмад С., Алсайед Ю.М., Друкер Б.Дж., Платаниас Л.С. Рецептор интерферона I типа опосредует фосфорилирование тирозина адаптерного белка CrkL. Дж Биол Химия . (1997) 272: 29991–4. DOI: 10.1074 / jbc.272.48.29991
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.де Верд Н.А., Вивиан Дж. П., Нгуен Т.К., Манган Н.Э., Гулд Дж.А., Бранифф С.Дж. и др. Структурная основа уникальной оси передачи сигналов интерферона-бета, опосредованной рецептором IFNAR1. Нат Иммунол . (2013) 14: 901–7. DOI: 10.1038 / ni.2667
CrossRef Полный текст | Google Scholar
16. Гилл Н., Ченовет М.Дж., Верду Э.Ф., Ашкар А.А. NK-клеткам требуется рецептор IFN типа I для противовирусного ответа во время генитальной инфекции HSV-2. Клеточный иммунол . (2011) 269: 29–37. DOI: 10.1016 / j.Cellimm.2011.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Пеграм Х. Дж., Эндрюс Д. М., Смит М. Дж., Дарси П. К., Кершоу М. Х. Активирующие и ингибирующие рецепторы естественных клеток-киллеров. Иммунол Клетки Биол . (2011) 89: 216–24. DOI: 10.1038 / icb.2010.78
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Oh JE, Kim BC, Chang DH, Kwon M, Lee SY, Kang D, et al. Вызванный дисбиозом IL-33 способствует нарушению противовирусного иммунитета слизистой оболочки половых органов. Proc Natl Acad Sci USA . (2016) 113: E762–71. DOI: 10.1073 / pnas.1518589113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Гилл Н., Дикон П.М., Личти Б., Моссман К.Л., Ашкар А.А. Индукция врожденного иммунитета против инфекции вируса простого герпеса 2 типа посредством локальной доставки лигандов Toll-подобных рецепторов коррелирует с продукцией бета-интерферона. Дж Вирол . (2006) 80: 9943–50. DOI: 10.1128 / JVI.01036-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.Ли А.Дж., Ашкар А.А. Вирус простого герпеса-2 в слизистой оболочке половых органов: понимание реакции хозяина слизистой оболочки и разработка вакцины. Обращение к врачу . (2012) 25: 92–9. DOI: 10.1097 / QCO.0b013e32834e9a56
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Muller U, Steinhoff U, Reis LF, Hemmi S, Pavlovic J, Zinkernagel RM, et al. Функциональная роль интерферонов типа I и типа II в противовирусной защите. Science (1994) 264: 1918–21. DOI: 10.1126 / наука.8009221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. van den Broek MF, Muller U, Huang S, Zinkernagel RM, Aguet M. Иммунная защита у мышей, лишенных рецепторов интерферона типа I и / или типа II. Immunol Ред. . (1995) 148: 5–18. DOI: 10.1111 / j.1600-065X.1995.tb00090.x
CrossRef Полный текст | Google Scholar
24. де Вир MJ, Holko M, Frevel M, Walker E, Der S, Paranjape JM, et al. Функциональная классификация генов, стимулированных интерфероном, идентифицированная с помощью микрочипов. Дж Лейкок Биол . (2001) 69: 912–20. DOI: 10.1189 / jlb.69.6.912
CrossRef Полный текст | Google Scholar
25. Schoggins JW, Wilson SJ, Panis M, Murphy MY, Jones CT, Bieniasz P, et al. Различные генные продукты являются эффекторами противовирусного ответа интерферона типа I. Природа (2011) 472: 481–5. DOI: 10.1038 / nature09907
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Кэрролл С.С., Чен Э., Виконт Т., Гейб Дж., Сардана М.К., Геман Дж. И др.Расщепление олигорибонуклеотидов 2 ‘, 5’-олигоаденилат-зависимой рибонуклеазой L. J Biol Chem . (1996) 271: 4988–92. DOI: 10.1074 / jbc.271.9.4988
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Лю С.Ю., Санчес Д.Д., Ченг Г. Новые разработки в области индукционных и противовирусных эффекторов интерферона типа I. Курр Опин Иммунол . (2011) 23: 57–64. DOI: 10.1016 / j.coi.2010.11.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Курче Дж. С., Халущак К., МакВильямс Дж. А., Санчес П. Дж., Кедл Р. М.. IFN-зависимая активация Т-клеток типа I опосредуется IFN-зависимой экспрессией лиганда OX40 дендритных клеток и не зависит от экспрессии IFNR Т-клеток. Дж Иммунол . (2012) 188: 585–93. DOI: 10.4049 / jimmunol.1102550
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Симмонс Д.П., Вирш П.А., Канадей Д.Х., Мейерсон Х.Дж., Лю Ю.К., Ван И и др. IFN типа I управляет характерным фенотипом созревания дендритных клеток, который позволяет продолжать синтез MHC класса II и процессинг антигена. Дж Иммунол . (2012) 188: 3116–26. DOI: 10.4049 / jimmunol.1101313
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Монтойя М., Скьявони Дж., Маттей Ф., Грессер И., Беларделли Ф., Бэрроу П. и др. Интерфероны типа I, продуцируемые дендритными клетками, способствуют их фенотипической и функциональной активации. Кровь (2002) 99: 3263–71. DOI: 10.1182 / blood.V99.9.3263
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Хам Б., Трифило М.Дж., Зунига Е.И., Олдстон МБ.Вирусы уклоняются от иммунной системы через опосредованную интерфероном I типа STAT2-зависимую, но независимую от STAT1 передачу сигналов. Иммунитет (2005) 22: 247–57. DOI: 10.1016 / j.immuni.2005.01.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Зунига Э.И., МакГэверн ДБ, Прунэда-Пас Ж.Л., Тенг К., Олдстоун МБ. Плазмацитоидные дендритные клетки костного мозга могут дифференцироваться в миелоидные дендритные клетки при вирусной инфекции. Нат Иммунол . (2004) 5: 1227–34. DOI: 10.1038 / ni1136
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Иидзима Н., Маттеи Л. М., Ивасаки А. Привлеченные воспалительные моноциты стимулируют противовирусный иммунитет Th2 в инфицированной ткани. Proc Natl Acad Sci USA . (2011) 108: 284–9. DOI: 10.1073 / pnas.1005201108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Уянгаа Е., Ким Дж. Х., Патил А. М., Чой Дж. Й., Ким С. Б., Эо С. К.. Определенная восходящая роль передачи сигналов IFN типа I в гемопоэтических стволовых клетках и резидентных эпителиальных клетках для согласованного рекрутирования моноцитов Ly-6Chi и NK-клеток через каскад CCL2-CCL3. PLoS Pathog (2015) 11: e1005256. DOI: 10.1371 / journal.ppat.1005256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Стифтер С.А., Бхаттачарья Н., Пиллэй Р., Флоридо М., Трикас Дж. А., Бриттон В. Дж. И др. Функциональное взаимодействие между интерферонами типа I и II необходимо для ограничения воспаления тканей, вызванного вирусом гриппа А. PLoS Pathog (2016) 12: e1005378. DOI: 10.1371 / journal.ppat.1005378
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37.Перальта Рамос Дж. М., Бусси С., Гавилио Е. А., Арройо Д. С., Баез Н. С., Родригес-Галан М.С. и др. Интерфероны типа I необходимы для содействия иммунному надзору в центральной нервной системе за счет привлечения воспалительных моноцитов при системном воспалении. Фронт Иммунол . (2017) 8: 1666. DOI: 10.3389 / fimmu.2017.01666
CrossRef Полный текст | Google Scholar
38. Seo SU, Kwon HJ, Ko HJ, Byun YH, Seong BL, Uematsu S и др. Передача сигналов интерферона типа I регулирует Ly6C (hi) моноциты и нейтрофилы во время острой вирусной пневмонии у мышей. PLoS Патог . (2011) 7: e1001304. DOI: 10.1371 / journal.ppat.1001304
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Martinez J, Huang X, Yang Y. Прямое действие IFN типа I на NK-клетки необходимо для их активации в ответ на вирусную инфекцию осповакцины in vivo . Дж Иммунол . (2008) 180: 1592–7. DOI: 10.4049 / jimmunol.180.3.1592
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Чжу Дж, Хуан Х, Ян Ю.Решающая роль для IFN-зависимой активации NK-клеток типа I в элиминации аденовирусных векторов in vivo врожденным иммунитетом. Мол тер . (2008) 16: 1300–7. DOI: 10,1038 / мт.2008,88
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Лукас М., Шахтерле В., Оберле К., Айхеле П., Дифенбах А. Дендритные клетки запускают естественные клетки-киллеры путем транс-презентации интерлейкина 15. Иммунитет (2007) 26: 503–17. DOI: 10.1016 / j.immuni.2007.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Баранек Т., Манх Т.П., Александр Й., Макбул М.А., Кабеза Дж.З., Томаселло Э. и др. Дифференциальные ответы иммунных клеток на интерферон I типа способствуют устойчивости хозяина к вирусной инфекции. Клеточный микроб-хозяин . (2012) 12: 571–84. DOI: 10.1016 / j.chom.2012.09.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Mack EA, Kallal LE, Demers DA, Biron CA. Индукция интерфероном 1-го типа продукции естественных клеток-киллеров гамма-интерферона для защиты при инфицировании вирусом лимфоцитарного хориоменингита. MBio (2011) 2: e00169–11. DOI: 10.1128 / mBio.00169-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Паукер К., Кантелл К., Хенле В. Количественные исследования вирусной интерференции в суспендированных L-клетках. III. Влияние мешающих вирусов и интерферона на скорость роста клеток. Вирусология (1962) 17: 324–34. DOI: 10.1016 / 0042-6822 (62)-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Томас К., Морага И., Левин Д., Круцик П.О., Подоплелова Ю., Трехо А. и др.Структурная связь между дискриминацией лиганда и активацией рецептора интерферонами типа I. Cell (2011) 146: 621–32. DOI: 10.1016 / j.cell.2011.06.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Тейджаро Дж. Р., Нг К., Ли А. М., Салливан Б. М., Шихан К. С., Уэлч М. и др. Стойкая инфекция LCMV контролируется блокадой передачи сигналов интерферона I типа. Наука (2013) 340: 207–11. DOI: 10.1126 / science.1235214
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Wilson EB, Yamada DH, Elsaesser H, Herskovitz J, Deng J, Cheng G и др. Блокада хронической передачи сигналов интерферона типа I для контроля стойкой инфекции LCMV. Наука (2013) 340: 202–7. DOI: 10.1126 / science.1235208
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Wilson EB, Kidani Y, Elsaesser H, Barnard J, Raff L, Karp CL, et al. Появление отчетливых многоцелевых иммунорегуляторных антиген-презентирующих клеток во время персистирующей вирусной инфекции. Клеточный микроб-хозяин .(2012) 11: 481–91. DOI: 10.1016 / j.chom.2012.03.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Ng CT, Oldstone MB. Инфицированные CD8альфа-дендритные клетки являются преобладающим источником IL-10 во время развития персистирующей вирусной инфекции. Proc Natl Acad Sci USA . (2012) 109: 14116–21. DOI: 10.1073 / pnas.1211
9PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Эшлеман Э.М., Дельгадо С., Кирни С.Дж., Фридман Р.С., Ленц Л.Л.Подавляющая регуляция макрофага IFNGR1 усугубляет системную инфекцию L. monocytogenes. PLoS Патог . (2017) 13: e1006388. DOI: 10.1371 / journal.ppat.1006388
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Макнаб Ф.В., Юбанк Дж., Хоус А., Морейра-Тейшейра Л., Мартиросян А., Гиларди Н. и др. IFN типа I индуцирует продукцию IL-10 независимым от IL-27 образом и блокирует реакцию на IFN-гамма для продукции IL-12 и уничтожения бактерий в макрофагах, инфицированных Mycobacterium tuberculosis . Дж Иммунол . (2014) 193: 3600–12. DOI: 10.4049 / jimmunol.1401088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Новиков А., Кардон М., Томпсон Р., Шендеров К., Киршман К.Д., Майер-Барбер К.Д. и др. Mycobacterium tuberculosis запускает передачу сигналов IFN типа I хозяина для регулирования продукции IL-1beta в макрофагах человека. Дж Иммунол . (2011) 187: 2540–7. DOI: 10.4049 / jimmunol.1100926
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55.Генри Т., Кириманджешвара Г.С., Руби Т., Джонс Дж. У., Пэн К., Перрет М. и др. Передача сигналов IFN типа I ограничивает секрецию IL-17A / F гаммадельта-Т-клетками во время бактериальных инфекций. Дж Иммунол . (2010) 184: 3755–67. DOI: 10.4049 / jimmunol.0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Аленстиэль Дж., Эдлих Б., Хогдал Л.Дж., Ротман Ю., Нуреддин М., Фельд Дж. Дж. И др. Ранние изменения функции естественных клеток-киллеров указывают на вирусологический ответ на терапию интерфероном при гепатите С. Гастроэнтерология (2011) 141: 1231–9, 1239 e1-2. DOI: 10.1053 / j.gastro.2011.06.069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Werner JM, Serti E, Chepa-Lotrea X, Stoltzfus J, Ahlenstiel G, Noureddin M, et al. Рибавирин улучшает IFN-гамма-ответ естественных клеток-киллеров на терапию вирусом гепатита C на основе IFN. Гепатология (2014) 60: 1160–9. DOI: 10.1002 / hep.27092
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59.Понтироли Ф., Дюссургет О, Занони И., Урбано М., Беретта О, Грануччи Ф. и др. Время продукции IFNbeta влияет на ранние врожденные ответы на Listeria monocytogenes и определяет общий исход летальной инфекции. PLoS ONE (2012) 7: e43455. DOI: 10.1371 / journal.pone.0043455
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Marshall JD, Heeke DS, Abbate C, Yee P, Van Nest G. Индукция гамма-интерферона из естественных клеток-киллеров с помощью иммуностимулирующей CpG ДНК опосредуется через интерферон-альфа, продуцируемый плазматическими дендритными клетками, и фактор некроза опухоли. альфа. Иммунология (2006) 117: 38–46. DOI: 10.1111 / j.1365-2567.2005.02261.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Мияги Т., Гиль М.П., Ван X, Лутен Дж., Чу В.М., Бирон, Калифорния. Высокий базальный STAT4, сбалансированный индукцией STAT1, для контроля эффектов интерферона 1 типа в естественных клетках-киллерах. J Exp Med . (2007) 204: 2383–96. DOI: 10.1084 / jem.20070401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Duerr CU, McCarthy CD, Mindt BC, Rubio M, Meli AP, Pothlichet J, et al.Интерферон типа I ограничивает иммунопатологию 2-го типа за счет регуляции врожденных лимфоидных клеток 2-й группы. Нат Иммунол . (2016) 17: 65–75. DOI: 10.1038 / ni.3308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Приклад AT, Smith JM, Carbone FR. IFN типа I подавляет рекрутирование нейтрофилов, вызванное Cxcr2, в сенсорные ганглии во время вирусной инфекции. J Exp Med . (2014) 211: 751–9. DOI: 10.1084 / jem.20132183
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65.Туссент М., Джексон Д. Д., Свебода Д., Гедан А., Цурукцоглоу Т. Д., Чинг Ю. М. и др. ДНК хозяина, выделяемая NETosis, способствует обострению аллергической астмы 2 типа, вызванной риновирусом. Нат Мед . (2017) 23: 681–91. DOI: 10,1038 / нм 4332
CrossRef Полный текст | Google Scholar
67. Жаклин Б., Маяу В., Таргат Б., Лиоват А.С., Кункель Д., Петижан Г. и др. Непатогенная SIV-инфекция африканских зеленых мартышек вызывает сильный, но быстро контролируемый ответ IFN типа I. Дж. Клин Инвест .(2009) 119: 3544–55. DOI: 10.1172 / JCI40093
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Сандлер Н.Г., Босингер С.Е., Эстес Д.Д., Чжу Р.Т., Тарп Г.К., Бориц Э. и др. Реакция интерферона I типа у макак-резусов предотвращает инфекцию SIV и замедляет прогрессирование заболевания. Природа (2014) 511: 601–5. DOI: 10.1038 / природа13554
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Гарсин Дж., Бордат Ю., Чучана П., Моннерон Д., Лоу Х. К., Пилер Дж. И др.Дифференциальная активность подтипов интерферона I типа для дифференцировки дендритных клеток. PLoS ONE (2013) 8: e58465. DOI: 10.1371 / journal.pone.0058465
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Джеймс С.М., Абдад М.Ю., Мэнсфилд Дж. П., Якобсен Х. К., Винд А. Р., Stumbles PA и др. Дифференциальная активность подтипов альфа / бета IFN против вируса гриппа in vivo и усиление специфических иммунных ответов у мышей, вакцинированных ДНК, экспрессирующих гемагглютинин и нуклеопротеин. Vaccine (2007) 25: 1856–67. DOI: 10.1016 / j.vaccine.2006.10.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Карупиа Дж., Се К. В., Буллер Р. М., Натан К., Дуарте С., МакМикинг Дж. Д.. Подавление репликации вируса интерферон-гамма-индуцированной синтазой оксида азота. Science (1993) 261: 1445–8. DOI: 10.1126 / science.76
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Вейцман О.Е., Адамс Н.М., Шустер И.С., Кришна С., Притыкин Ю., Лау С. и др.ILC1 обеспечивает раннюю защиту хозяина на начальных участках вирусной инфекции. Cell (2017) 171: 795–808 e12. DOI: 10.1016 / j.cell.2017.09.052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Тапа М., Кузиэль В.А., Карр Дж. Восприимчивость мышей с дефицитом CCR5 к вирусу простого генитального герпеса 2 типа связана с мобилизацией NK-клеток. Дж Вирол . (2007) 81: 3704–13. DOI: 10.1128 / JVI.02626-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Ашкар А.А., Розенталь К.Л. Интерлейкин-15, естественные киллеры и NKT-клетки играют решающую роль в врожденной защите от инфекции вируса простого герпеса 2 типа. Дж Вирол . (2003) 77: 10168–71. DOI: 10.1128 / JVI.77.18.10168-10171.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Ян Ю.Л., Рейс Л.Ф., Павлович Дж., Агуцци А., Шафер Р., Кумар А. и др. Недостаточная передача сигналов у мышей, лишенных двухцепочечной РНК-зависимой протеинкиназы. EMBO J .(1995) 14: 6095–106.
PubMed Аннотация | Google Scholar
78. Goldszmid RS, Caspar P, Rivollier A, White S, Dzutsev A, Hieny S, et al. Интерферон-гамма, полученный из NK-клеток, управляет клеточной динамикой и дифференцировкой моноцитов в дендритные клетки в месте инфекции. Иммунитет (2012) 36: 1047–59. DOI: 10.1016 / j.immuni.2012.03.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Мартин-Фонтеча А., Томсен Л.Л., Бретт С., Жерар С., Липп М., Ланзавеккья А. и др.Индуцированное привлечение NK-клеток к лимфатическим узлам обеспечивает IFN-гамма для прайминга T (H) 1. Нат Иммунол . (2004) 5: 1260–5. DOI: 10.1038 / ni1138
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Steimle V, Siegrist CA, Mottet A, Lisowska-Grospierre B, Mach B. Регулирование экспрессии MHC класса II с помощью интерферона-гамма, опосредованного трансактиваторным геном CIITA. Science (1994) 265: 106–9. DOI: 10.1126 / science.8016643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82.Ёкодзэки Х., Катаяма И., Оки О, Аримура М., Такаяма К., Мацунага Т. и др. Интерферон-гамма по-разному регулирует экспрессию CD80 (B7-1) и CD86 (B7-2 / B70) на клетках Лангерганса человека. Br J Дерматол . (1997) 136: 831–7. DOI: 10.1111 / j.1365-2133.1997.tb03921.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Bauvois B, Nguyen J, Tang R, Billard C, Kolb JP. Интерфероны типов I и II активируют костимулирующую молекулу CD80 в моноцитах через регуляторный фактор-1 интерферона. Биохим Фармакол . (2009) 78: 514–22. DOI: 10.1016 / j.bcp.2009.05.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Ма Х, Чоу Дж. М., Гри Дж., Карра Дж., Героса Ф., Вольф С. Ф. и др. Промотор гена интерлейкина 12 p40 примирован интерфероном гамма в моноцитарных клетках. J Exp Med . (1996) 183: 147–57. DOI: 10.1084 / jem.183.1.147
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Древец Д.А., Линен П.Дж., Кэмпбелл П.А.Рецептор комплемента типа 3 опосредует фагоцитоз и гибель Listeria monocytogenes с помощью гибридного предшественника макрофагов, стимулированного TNF-альфа и IFN-гамма. Клеточный иммунол . (1996) 169: 1–6. DOI: 10.1006 / cimm.1996.0083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Кан К., Пак Ш., Чен Дж., Цяо Й., Джаннопулу Е., Берг К. и др. Интерферон-гамма подавляет экспрессию гена M2 в макрофагах человека, разбирая энхансеры, связанные с фактором транскрипции MAF. Иммунитет (2017) 47: 235–250 e4. DOI: 10.1016 / j.immuni.2017.07.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Ван Ф., Чжан С., Чон Р., Вукович И., Цзян Х, Лерман А. и др. Гамма-интерферон вызывает обратимое метаболическое перепрограммирование макрофагов M1 для поддержания жизнеспособности клеток и провоспалительной активности. EBioMedicine (2018) 30: 303–16. DOI: 10.1016 / j.ebiom.2018.02.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89.Моро К., Кабата Х., Танабе М., Кога С., Такено Н., Мочизуки М. и др. Интерферон и ИЛ-27 противодействуют функции врожденных лимфоидных клеток 2-й группы и врожденным иммунным ответам 2-го типа. Нат Иммунол . (2016) 17: 76–86. DOI: 10.1038 / ni.3309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Стир М.Т., Голеневска К., Цефус Дж.Й., Ньюкомб, округ Колумбия, Шерилл Т.П., Бойд К.Л. и др. STAT1 подавляет цитокин-продуцирующие врожденные лимфоидные клетки группы 2 и группы 3 во время вирусной инфекции. Дж Иммунол . (2017) 199: 510–19. DOI: 10.4049 / jimmunol.1601984
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Калифано Д., Фуруя Й., Робертс С., Аврам Д., Маккензи А.Н.Дж., Мецгер Д.В. IFN-гамма увеличивает восприимчивость к инфекции гриппа A за счет подавления врожденных лимфоидных клеток группы II. Иммунол слизистой оболочки . (2018) 11: 209–19. DOI: 10,1038 / mi.2017.41
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92.Ribechini E, Hutchinson JA, Hergovits S, Heuer M, Lucas J, Schleicher U, et al. Новые сигналы GM-CSF через IFN-gammaR / IRF-1 и лицензионные моноциты AKT / mTOR для супрессорной функции. Кровавый Совет . (2017) 1: 947–60. DOI: 10.1182 / bloodadvances.2017006858
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Langereis JD, Pickkers P, de Kleijn S, Gerretsen J, de Jonge MI, Kox M. Полученный из селезенки IFN-гамма индуцирует образование PD-L1 (+) — супрессирующих нейтрофилов во время эндотоксемии. Дж Лейкок Биол . (2017) 102: 1401–9. DOI: 10.1189 / jlb.3A0217-051RR
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Салим Т., Сершен С.Л., Мэй Э. Изучение роли активации TNF-альфа и IFN-гамма в динамике экспрессии гена iNOS в LPS-стимулированных макрофагах. PLoS ONE (2016) 11: e0153289. DOI: 10.1371 / journal.pone.0153289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Zha Z, Bucher F, Nejatfard A, Zheng T, Zhang H, Yea K, et al.Интерферон-гамма является главным регулятором контрольной точки цитокин-индуцированной дифференцировки. Proc Natl Acad Sci USA . (2017) 114: E6867–74. DOI: 10.1073 / pnas.17064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Фьюри Р., Хамашта М., Меррилл Дж. Т., Верт В. П., Калуниан К., Брохон П. и др. Анифролумаб, моноклональное антитело против рецептора интерферона-альфа, при средней и тяжелой системной красной волчанке. Arthritis Rheumatol. (2017) 69: 376–86.DOI: 10.1002 / art.39962
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. de Jong HJI, Kingwell E, Shirani A, Cohen Tervaert JW, Hupperts R, Zhao Y, et al. Оценка безопасности бета-интерферонов при РС: серия вложенных исследований случай-контроль. Неврология (2017) 88: 2310–20. DOI: 10.1212 / WNL.0000000000004037
CrossRef Полный текст | Google Scholar
Изучение его последствий при инфекционных заболеваниях
Ключевой игрок в формировании клеточного иммунитета, IFN-γ способен управлять многочисленными защитными функциями для усиления иммунных ответов при инфекциях и раках.Он может проявлять свои иммуномодулирующие эффекты, усиливая процессинг и презентацию антигена, увеличивая трафик лейкоцитов, вызывая антивирусное состояние, усиливая антимикробные функции и влияя на клеточную пролиферацию и апоптоз. Сложное взаимодействие между активностью иммунных клеток и IFN-γ посредством скоординированной интеграции сигналов от других путей с участием цитокинов и рецепторов распознавания образов (PRR), таких как интерлейкин (IL) -4, TNF-α, липополисахарид (LPS), интерфероны типа I (IFNS) и др.приводит к запуску каскада провоспалительных реакций. Данные микроматрицы раскрыли многочисленные гены, на регуляцию транскрипции которых влияет IFN-γ. Следовательно, клетки, стимулированные IFN-γ, демонстрируют измененную экспрессию многих таких генов-мишеней, которые опосредуют его последующие эффекторные функции. Важность IFN-γ дополнительно подтверждается тем фактом, что у мышей с нарушениями в гене IFN-γ или его рецепторах развивается крайняя предрасположенность к инфекционным заболеваниям и они быстро умирают от них.В этом обзоре мы пытаемся выяснить биологические функции и физиологическое значение этого универсального цитокина. Обсуждаются также функциональные последствия его биологической активности при некоторых инфекционных заболеваниях и аутоиммунных патологиях. В качестве ответной стратегии многие вирулентные патогенные виды разработали способы препятствовать иммунной защите, обеспечиваемой IFN-γ. Таким образом, опосредованные IFN-γ взаимодействия хозяин-патоген имеют решающее значение для нашего понимания механизмов заболевания, и эти аспекты также демонстрируют огромное терапевтическое значение для устранения различных инфекций и аутоиммунных состояний.
Ссылки
1 Шредер К., Герцог П.Дж., Раваси Т., Хьюм Д.А. Интерферон-γ: обзор сигналов, механизмов и функций. Журнал биологии лейкоцитов 2004; 75: 163-89. Искать в Google Scholar
2 Rothfuchs AG, Trumstedt C, Wigzell H, Rottenberg ME. Индуцированный внутриклеточной бактериальной инфекцией IFN-γ критически, но не только зависит от толл-подобного рецептора, 4-миелоидного фактора дифференцировки 88-IFN-αβ-STAT1. Журнал иммунологии 2004; 172: 6345-53. Искать в Google Scholar
3 Наглак Е.К., Моррисон С.Г., Моррисон Р.П.Гамма-интерферон необходим для оптимального опосредованного антителами иммунитета против инфекции генитального хламидиоза. Инфекция и иммунитет 2016; 84: 3232-42. Искать в Google Scholar
4 Green AM, DiFazio R, Flynn JL. IFN-γ из Т-лимфоцитов CD4 необходим для выживания хозяина и усиливает функцию Т-лимфоцитов CD8 во время инфекции Mycobacterium tuberculosis. Журнал иммунологии 2013; 190: 270-7. Искать в Google Scholar
5 Baird NL, Bowlin JL, Hotz TJ, Cohrs RJ, Gilden D. Гамма-интерферон продлевает выживаемость инфицированных вирусом ветряной оспы человеческих нейронов in vitro.Журнал вирусологии 2015; 89: 7425-7. Искать в Google Scholar
6 Kokordelis P, Krämer B, Körner C, et al. Эффективное опосредованное интерфероном гамма ингибирование репликации вируса гепатита С естественными клетками-киллерами связано со спонтанным избавлением от острого гепатита С у пациентов с положительным результатом вируса иммунодефицита человека. Гепатология 2014; 59: 814-27. Искать в Google Scholar
7 Beekhuizen H, van de Gevel JS. Гамма-интерферон придает устойчивость к инфекции Staphylococcus aureus в эндотелиальных клетках сосудов человека за счет совместной провоспалительной и усиленной внутренней антибактериальной активности.Инфекция и иммунитет 2007; 75: 5615-26. Искать в Google Scholar
8 Koo GC, Gan Y-H. Врожденный гамма-ответ интерферона мышей BALB / c и C57BL / 6 на инфекцию Burkholderia pseudomallei in vitro. BMC Immunology 2006; 7:19. Искать в Google Scholar
9 Miller CH, Maher SG, Young HA. Клиническое применение интерферона-γ. Анналы Нью-Йоркской академии наук 2009; 1182: 69-79. Искать в Google Scholar
10 Belkaid Y, Rouse BT. Природные регуляторные Т-клетки при инфекционных заболеваниях.Природная иммунология 2005; 6: 353. Искать в Google Scholar
11 Frucht DM, Fukao T, Bogdan C, Schindler H, O’Shea JJ, Koyasu S. Продукция IFN-гамма антигенпрезентирующими клетками: возникают механизмы. Trends Immunol 2001; 22: 556-60. Искать в Google Scholar
12 Boehm U, Guethlein L, Klamp T, et al. Два семейства GTPases доминируют в сложном клеточном ответе на IFN-γ. Журнал иммунологии 1998; 161: 6715-23. Искать в Google Scholar
13 Bach EA, Aguet M, Schreiber RD.Рецептор IFNγ: парадигма передачи сигналов рецептора цитокина. Ежегодный обзор иммунологии 1997; 15: 563-91. Искать в Google Scholar
14 Ramana CV, Gil MP, Schreiber RD, Stark GR. Stat1-зависимые и независимые пути в IFN-γ-зависимой передаче сигналов. Тенденции в иммунологии 2002; 23: 96-101. Искать в Google Scholar
15 Lighvani AA, Frucht DM, Jankovic D, et al. T-bet быстро индуцируется интерфероном-γ в лимфоидных и миелоидных клетках. Труды Национальной академии наук 2001; 98: 15137-42.Искать в Google Scholar
16 Djuretic IM, Levanon D, Negreanu V, Groner Y, Rao A, Ansel KM. Факторы транскрипции T-bet и Runx3 взаимодействуют, чтобы активировать Ifng и заглушить Il4 в Т-хелперных клетках 1 типа. Природная иммунология 2007; 8: 145. Искать в Google Scholar
17 Afkarian M, Sedy JR, Yang J, et al. T-bet представляет собой STAT1-индуцированный регулятор экспрессии IL-12R в наивных CD4 + Т-клетках. Природа иммунологии 2002; 3: 549. Искать в Google Scholar
18 Flannagan RS, Cosío G, Grinstein S.Антимикробные механизмы фагоцитов и стратегии уклонения от бактерий. Обзоры природы Microbiology 2009; 7: 355. Искать в Google Scholar
19 Li P, Du Q, Cao Z, et al. Гамма-интерферон вызывает аутофагию с ингибированием роста и гибелью клеток в клетках гепатоцеллюлярной карциномы человека (ГЦК) посредством интерферон-регулирующего фактора-1 (IRF-1). Письма о раке 2012; 314: 213-22. Искать в Google Scholar
20 Сингх С.Б., Дэвис А.С., Тейлор Г.А., Деретик В. Человеческий IRGM вызывает аутофагию для уничтожения внутриклеточных микобактерий.Наука 2006; 313: 1438-41. Искать в Google Scholar
21 MacMicking JD. Интерферон-индуцируемые эффекторные механизмы клеточно-автономного иммунитета. Обзоры природы Immunology 2012; 12: 367. Искать в Google Scholar
22 MacMicking JD, Taylor GA, McKinney JD. Иммунный контроль туберкулеза с помощью IFN-γ-индуцибельного LRG-47. Наука 2003; 302: 654-9. Искать в Google Scholar
23 Kim BH, Shenoy AR, Kumar P, Das R, Tiwari S, MacMicking JD. Семейство IFN-γ-индуцибельных ГТФаз 65 кДа защищает от бактериальной инфекции.Наука 2011; 332: 717-21. Искать в Google Scholar
24 Schnoor M, Betanzos A, Weber D, Parkos C. Гуанилат-связывающий белок-1 экспрессируется в плотных контактах эпителиальных клеток кишечника в ответ на интерферон-γ и регулирует барьерную функцию посредством воздействия на апоптоз. Иммунология слизистой оболочки 2009; 2: 33-42. Искать в Google Scholar
25 Murray PJ. Ауксотрофия аминокислот как узлы иммунологического контроля. Природа иммунологии 2016; 17: 132. Искать в Google Scholar
26 Day PM, Thompson CD, Lowy DR, Schiller JT.Интерферон-гамма предотвращает инфекционное проникновение вируса папилломы человека 16 через L2-зависимый механизм. Журнал вирусологии 2017; 91: e00168-17. Искать в Google Scholar
27 Feeley EM, Sims JS, John SP, et al. IFITM3 подавляет инфицирование вирусом гриппа А, предотвращая проникновение в цитозоль. Патогены PLoS 2011; 7: e1002337. Искать в Google Scholar
28 Хатакеяма С. Белки семейства TRIM: роль в аутофагии, иммунитете и канцерогенезе. Тенденции в биохимических науках, 2017 г. Поиск в Google Scholar
29 Biering SB, Choi J, Halstrom RA, et al.Комплексы репликации вирусов нацелены на индуцируемые LC3 интерферон-индуцируемые GTPases. Cell Host & Microbe 2017; 22: 74-85.e7. Искать в Google Scholar
30 Dotson D, Woodruff EA, Villalta F, Dong X. Филамин А участвует в опосредованном ВИЧ-1 Vpu уклонении от ограничения хозяина, модулируя экспрессию тетерина. Журнал биологической химии 2016; 291: 4236-46. Искать в Google Scholar
31 Fabri M, Stenger S, Shin D-M, et al. Витамин D необходим для опосредованной IFN-γ антимикробной активности макрофагов человека.Наука трансляционная медицина 2011; 3: 104ра2-ра2. Искать в Google Scholar
32 Jabado N, Jankowski A, Dougaparsad S, Picard V, Grinstein S, Gros P. Естественная устойчивость к внутриклеточным инфекциям. Журнал экспериментальной медицины 2000; 192: 1237-48. Искать в Google Scholar
33 White C, Lee J, Kambe T, Fritsche K, Petris MJ. Роль АТФ7А-транспортирующей медь АТФазы в бактерицидной активности макрофагов. Журнал биологической химии 2009; 284: 33949-56. Искать в Google Scholar
34 Deriu E, Liu JZ, Raffatellu M.13 Сальмонелла и воинство в битве за железо. Ответ на стресс у патогенных бактерий 2011; 19: 283. Искать в Google Scholar
35 Flynn JL, Chan J, Triebold KJ, Dalton DK, Stewart TA, Bloom BR. Существенная роль интерферона гамма в устойчивости к инфекции Mycobacterium tuberculosis. Журнал экспериментальной медицины 1993; 178: 2249-54. Искать в Google Scholar
36 Флинн Дж. Л., Чан Дж. Иммунология туберкулеза. Ежегодный обзор иммунологии 2001; 19: 93-129. Искать в Google Scholar
37 Altare F, Jouanguy E, Lamhamedi S, Doffinger R, Fischer A, Casanova J-L.Менделирующая предрасположенность человека к микобактериальной инфекции. Текущее мнение в иммунологии 1998; 10: 413-7. Искать в Google Scholar
38 Cheallaigh CN, Sheedy FJ, Harris J, et al. Распространенный вариант адаптера Mal регулирует передачу сигналов гамма-интерферона. Иммунитет 2016; 44: 368-79. Искать в Google Scholar
39 MacMicking JD. Клеточно-автономные эффекторные механизмы против Mycobacterium tuberculosis. Перспективы Колд-Спринг-Харбор в медицине, 2014; 4: a018507. Искать в Google Scholar
40 Herbst S, Schaible UE, Schneider BE.Макрофаги, активируемые интерфероном гамма, убивают микобактерии за счет апоптоза, вызванного оксидом азота. PloS one 2011; 6: e19105. Искать в Google Scholar
41 Shin DM, Yuk JM, Lee HM, et al. Липопротеин микобактерий активирует аутофагию посредством TLR2 / 1 / CD14 и функциональной передачи сигналов рецептора витамина D. Клеточная микробиология 2010; 12: 1648-65. Искать в Google Scholar
42 Yuk J-M, Yoshimori T, Jo E-K. Аутофагия и бактериальные инфекционные заболевания. Экспериментальная и молекулярная медицина 2012; 44: 99.Искать в Google Scholar
43 Harding CV, Boom WH. Регуляция презентации антигена Mycobacterium tuberculosis: роль Toll-подобных рецепторов. Обзоры природы Microbiology 2010; 8: 296. Искать в Google Scholar
44 Pennini ME, Pai RK, Schultz DC, Boom WH, Harding CV. Липопротеин Mycobacterium tuberculosis 19 кДа ингибирует IFN-γ-индуцированное ремоделирование хроматина MHC2TA с помощью передачи сигналов TLR2 и MAPK. Журнал иммунологии 2006; 176: 4323-30. Искать в Google Scholar
45 Pai RK, Pennini ME, Tobian AA, Canaday DH, Boom WH, Harding CV.Длительная передача сигналов толл-подобного рецептора Mycobacterium tuberculosis и ее липопротеин 19 килодальтон подавляют индуцированную гамма-интерфероном регуляцию выбранных генов в макрофагах. Инфекция и иммунитет 2004; 72: 6603-14. Искать в Google Scholar
46 Kincaid EZ, Ernst JD. Mycobacterium tuberculosis оказывает ген-селективное ингибирование транскрипционных ответов на IFN-гамма без подавления функции STAT1. Журнал иммунологии (Балтимор, Мэриленд: 1950) 2003; 171: 2042-9. Искать в Google Scholar
47 Олиас П., Этеридж Р.Д., Чжан И, Хольцман М.Дж., Сибли Л.Д.Эффектор токсоплазмы рекрутирует комплекс Mi-2 / NuRD для репрессии транскрипции STAT1 и блокирования IFN-γ-зависимой экспрессии гена. Клетка-хозяин и микроб 2016; 20: 72-82. Искать в Google Scholar
48 Alvarez GR, Zwilling BS, Lafuse WP. Ингибирование Mycobacterium avium передачи сигналов IFN-γ в макрофагах мыши: стимуляция toll-подобного рецептора 2 увеличивает экспрессию доминантно-отрицательного STAT1β за счет стабилизации мРНК. Журнал иммунологии 2003; 171: 6766-73. Искать в Google Scholar
49 Sugawara I, Yamada H, Mizuno S.Мыши с нокаутом STAT1 очень восприимчивы к легочной микобактериальной инфекции. Журнал экспериментальной медицины Тохоку 2004; 202: 41-50. Искать в Google Scholar
50 Bao S, Beagley KW, France MP, Shen J, Husband AJ. Интерферонгамма играет решающую роль в иммунитете кишечника против инфекции Salmonella typhimurium. Иммунология 2000; 99: 464-72. Искать в Google Scholar
51 Muotiala A, Makela PH. Роль IFN-гамма в инфицировании мышей Salmonella typhimurium. Микробный патогенез 1990; 8: 135-41.Искать в Google Scholar
52 Gilchrist JJ, MacLennan CA, Hill AV. Генетическая предрасположенность к инвазивной сальмонеллезной болезни. Обзоры природы Immunology 2015; 15: 452. Искать в Google Scholar
53 Jouanguy E, Döffinger R, Dupuis S, Pallier A, Altare F, Casanova J-L. IL-12 и IFN-γ в защите хозяина от микобактерий и сальмонелл у мышей и мужчин. Текущее мнение в иммунологии 1999; 11: 346-51. Искать в Google Scholar
54 Netea MG, Fantuzzi G, Kullberg BJ, et al. Нейтрализация IL-18 снижает накопление нейтрофилов в тканях и защищает мышей от смертельной эндотоксемии Escherichia coli и Salmonella typhimurium .Журнал иммунологии 2000; 164: 2644-9. Искать в Google Scholar
55 Rosenberger CM, Scott MG, Gold MR, Hancock RE, Finlay BB. Инфекция Salmonella typhimurium и стимуляция липополисахаридами вызывают аналогичные изменения в экспрессии генов макрофагов. Журнал иммунологии 2000; 164: 5894-904. Искать в Google Scholar
56 Gordon MA, Jack DL, Dockrell DH, Lee ME, Read RC. Гамма-интерферон усиливает интернализацию и раннее неокислительное уничтожение серовара Typhimurium Salmonella enterica человеческими макрофагами и изменяет цитокиновые ответы.Инфекция и иммунитет 2005; 73: 3445-52. Искать в Google Scholar
57 Nairz M, Fritsche G, Brunner P, Talasz H, Hantke K, Weiss G. Гамма-интерферон ограничивает доступность железа для интмакрофага Salmonella typhimurium. Eur J Immunol 2008; 38: 1923-36. Искать в Google Scholar
58 Mitterstiller AM, Haschka D, Dichtl S, et al. Гемоксигеназа 1 контролирует ранний врожденный иммунный ответ макрофагов на инфекцию Salmonella Typhimurium. Cell Microbiol 2016; 18: 1374-89. Искать в Google Scholar
59 Brown DE, Nick HJ, McCoy MW, et al.Повышенная экспрессия ферропортина-1 и быстрая потеря железа в селезенке возникают при анемии, вызванной инфекцией Salmonella enterica Serovar Typhimurium у мышей. Инфекция и иммунитет 2015; 83: 2290-9. Искать в Google Scholar
60 Зеневич Л.А., Шен Х. Врожденные и адаптивные иммунные ответы на Listeria monocytogenes: краткий обзор. Микробы и инфекции 2007; 9: 1208-15. Искать в Google Scholar
61 Kernbauer E, Maier V, Stoiber D, et al. Условная абляция Stat1 показывает важность передачи сигналов интерферона для иммунитета к инфекции Listeria monocytogenes.Патогены PLoS 2012; 8: e1002763. Искать в Google Scholar
62 Reynders A, Yessaad N, Vu Manh TP, et al. Идентичность, регуляция и функция in vivo кишечных NKp46 + RORgammat + и NKp46 + RORgammat-лимфоидных клеток. Embo j 2011; 30: 2934-47. Искать в Google Scholar
63 Sonoda J, Laganière J, Mehl IR, et al. Ядерный рецептор ERRα и коактиватор PGC-1β являются эффекторами IFN-γ-индуцированной защиты хозяина. Гены и развитие 2007; 21: 1909-20. Искать в Google Scholar
64 Попов А., Абдулла З., Викенхаузер С. и др.Дендритные клетки, экспрессирующие индолеамин-2,3-диоксигеназу, образуют гнойные гранулемы после инфицирования Listeria monocytogenes. Журнал клинических исследований 2006; 116: 3160. Искать в Google Scholar
65 Ma F, Xu S, Liu X, et al. МикроРНК miR-29 контролирует врожденный и адаптивный иммунный ответ на внутриклеточную бактериальную инфекцию путем нацеливания на интерферон-гамма .. Nature Immunology 2011; 12: 861-9. Искать в Google Scholar
66 Ван М., Чжоу Ю., Чжу Ю. Подрыв функций макрофагов токсинами и эффекторами бактериальных белков.Актуальные вопросы молекулярной биологии 2017; 25: 61-80. Искать в Google Scholar
67 Lebreton A, Job V, Ragon M, et al. Структурная основа ингибирования репрессора хроматина BAHD1 бактериальным нуклеомодулином LntA. MBio 2014; 5: e00775-13. Искать в Google Scholar
68 Lebreton A, Lakisic G, Job V, et al. Бактериальный белок нацелен на комплекс хроматина BAHD1, чтобы стимулировать интерфероновый ответ типа III. Наука 2011; 331: 1319-21. Искать в Google Scholar
69 Rayamajhi M, Humann J, Kearney S, Hill KK, Lenz LL.Антагонистическое взаимодействие между интерферонами I и II типа и повышенная восприимчивость хозяина к бактериальным инфекциям. Вирулентность 2010; 1: 418-22. Искать в Google Scholar
70 Muller K, van Zandbergen G, Hansen B, et al. Хемокины, естественные клетки-киллеры и гранулоциты в раннем течении основной инфекции Leishmania у мышей. Медицинская микробиология и иммунология 2001; 190: 73-6. Искать в Google Scholar
71 душ Сантуш PL, de Oliveira FA, Santos MLB, et al. Тяжесть висцерального лейшманиоза коррелирует с повышенными уровнями сывороточного IL-6, IL-27 и sCD14.PLoS игнорирует тропические болезни 2016; 10: e0004375. Искать в Google Scholar
72 Singh N, Kumar R, Engwerda C, Sacks D, Nylen S, Sundar S. Альфа-нейтрализация фактора некроза опухоли не оказывает прямого влияния на бремя паразитов, но вызывает нарушение выработки IFN-γ клетками селезенки человека. пациенты с висцеральным лейшманиозом. Цитокин 2016; 85: 184-90. Искать в Google Scholar
73 Карнейро М.Б., де Моура Лопес, ME, Romano A, et al. Привлечение воспалительных моноцитов, опосредованное IFN-гамма, нейтрализует iNOS-зависимое уничтожение паразитов за счет увеличения пермиссивного резервуара клеток-хозяев во время ранней инфекции Leishmania amazonensis.Am Assoc Immnol; 2016. Поиск в Google Scholar
74 Wanasen N, MacLeod CL, Ellies LG, Soong L. L-аргинин и переносчик катионных аминокислот 2B регулируют рост и выживание амастигот Leishmania amazonensis в макрофагах. Инфекция и иммунитет 2007; 75: 2802-10. Искать в Google Scholar
75 Gupta G, Oghumu S, Satoskar AR. Механизмы иммунного уклонения при лейшманиозе. Успехи прикладной микробиологии 2013; 82: 155-84. Искать в Google Scholar
76 Ardolino M, Raulet DH.Цитокиновая терапия восстанавливает противоопухолевые ответы NK-клеток, ставших анергическими в опухолях с дефицитом MHC I. Онкоиммунология 2016; 5: e1002725. Искать в Google Scholar
77 Bhutiani N, Li Q, Anderson CD, Gu T, Egilmez NK. Комбинированная пероральная цитокиновая терапия эффективно лечит рак толстой кишки на мышиной модели. AACR; 2017. Поиск в Google Scholar
78 Ян П-М, Чжоу Ц.-Дж, Ценг С.-Х, Хунг Ц-Ф. Биоинформатика и экспериментальные анализы in vitro определяют избирательный терапевтический потенциал гамма-интерферона и апигенина против плоскоклеточного рака шейки матки и аденокарциномы.Oncotarget 2017; 8: 46145. Искать в Google Scholar
79 Brar K, Leung DY. Последние соображения по использованию рекомбинантного гамма-интерферона для биологической терапии атопического дерматита. Мнение экспертов по биологической терапии 2016; 16: 507-14. Искать в Google Scholar
80 Leiding JW, Holland SM. Хроническая гранулематозная болезнь. 2016. Поиск в Google Scholar
81 Рейн Б.А., Пауэрс Л.С., Роджерс К. и др. Интерферон-γ подавляет заражение вирусом Эбола. Патогены PLoS 2015; 11: e1005263.Искать в Google Scholar
82 Delsing CE, Gresnigt MS, Leentjens J, et al. Интерферон-гамма как дополнительная иммунотерапия при инвазивных грибковых инфекциях: серия случаев. BMC Инфекционные болезни 2014; 14: 166. Искать в Google Scholar
83 Segal BH, Walsh TJ. Современные подходы к диагностике и лечению инвазивного аспергиллеза. Американский журнал респираторной медицины и реанимации, 2006 г .; 173: 707-17. Искать в Google Scholar
84 Мальмвалл Б.Е., Фоллин П. Успешная терапия гамма-интерфероном у пациента с хронической гранулематозной болезнью (ХГБ), страдающего абсцессом печени Staphylococcus aureus и инвазивной инфекцией Candida albicans.Скандинавский журнал инфекционных болезней 1993; 25: 61-6. Искать в Google Scholar
85 Skerrett SJ, Martin TR. Интратрахеальный гамма-интерферон усиливает легочную защиту при экспериментальном легионеллезе. Am J Respir Crit Care Med 1994; 149: 50-8. Искать в Google Scholar
86 Коэльо К., Касадеваль А. Криптококковая терапия и лекарственные препараты: старые, новые и многообещающие. Клеточная микробиология 2016; 18: 792-9. Искать в Google Scholar
87 Marciano BE, Spalding C, Fitzgerald A, et al.Общие тяжелые инфекции при хронической гранулематозной болезни. Клинические инфекционные болезни 2014; 60: 1176-83. Искать в Google Scholar
88 Seger RA. Современное лечение хронической гранулематозной болезни. Британский журнал гематологии 2008; 140: 255-66. Искать в Google Scholar
89 Hashemi H, Mohebbi M, Mehravaran S, Mazloumi M, Jahanbani-Ardakani H, Abtahi S-H. Синдром гипериммуноглобулина Е: генетика, иммунопатогенез, клинические данные и методы лечения. Журнал исследований в области медицинских наук: Официальный журнал Исфаханского университета медицинских наук 2017; 22: 53.Искать в Google Scholar
90 Badaro R, Falcoff E, Badaro FS, et al. Лечение висцерального лейшманиоза пятивалентной сурьмой и гамма-интерфероном. Медицинский журнал Новой Англии 1990; 322: 16-21. Искать в Google Scholar
91 Holland SM. Иммунотерапия микобактериальных инфекций. Семинары по респираторным инфекциям; 2001. с. 47-59. Искать в Google Scholar
92 Condos R, Rom WN, Schluger NW. Лечение туберкулеза легких с множественной лекарственной устойчивостью с помощью аэрозольного гамма-интерферона.Ланцет 1997; 349: 1513-5. Искать в Google Scholar
93 Milanés-Virelles MT, García-García I, Santos-Herrera Y, et al. Адъювантный гамма-интерферон у пациентов с легочным атипичным микобактериозом: рандомизированное двойное слепое плацебо-контролируемое исследование. BMC инфекционные болезни 2008; 8: 17. Искать в Google Scholar
94 Vincent J-L, Sun Q, Dubois M-J. Клинические испытания иммуномодулирующих препаратов при тяжелом сепсисе и септическом шоке. Клинические инфекционные болезни 2002; 34: 1084-93. Искать в Google Scholar
95 Raghu G, Brown KK, Bradford WZ, et al.Плацебо-контролируемое исследование интерферона гамма-1b у пациентов с идиопатическим фиброзом легких. Медицинский журнал Новой Англии 2004; 350: 125-33. Искать в Google Scholar
96 Singhal J, Agrawal N, Vashishta M, et al. Подавление опосредованных дендритными клетками ответов генами кальциевых и цистеиновых протеазных путей во время инфекции Mycobacterium tuberculosis. Журнал биологической химии 2012; 287: 11108-21. Искать в Google Scholar
97 Green DS, Nunes AT, Annunziata CM, Zoon KC.Терапия на основе моноцитов и интерферона для лечения рака яичников. Cytokine & growth factor reviews 2016; 29: 109-15. Искать в Google Scholar
98 Windbichler G, Hausmaninger H, Stummvoll W, et al. Интерферон-гамма в терапии первой линии рака яичников: рандомизированное исследование III фазы. Британский журнал рака 2000; 82: 1138-44. Искать в Google Scholar
99 Bosserhoff A, Kortylewski M, Komyod W., Kauffmann M-E, Heinrich PC, Behrmann I. Интерферон-γ-опосредованная регуляция роста клеток меланомы: участие STAT1-зависимых и STAT1-независимых сигналов.Журнал следственной дерматологии 2004; 122: 414-22. Искать в Google Scholar
100 McCabe A, Zhang Y, Thai V, Jones M, Jordan MB, MacNamara KC. Клетки макрофагального происхождения негативно регулируют пул гемопоэтических стволовых клеток в ответ на гамма-интерферон в устойчивом состоянии и во время инфекции. Стволовые клетки 2015; 33: 2294-305. Искать в Google Scholar
101 George PM, Badiger R, Alazawi W, Foster GR, Mitchell JA. Фармакология и терапевтический потенциал интерферонов. Фармакология и терапия 2012; 135: 44-53.Искать в Google Scholar
102 Moss JW, Ramji DP. Интерферон-гамма: многообещающая терапевтическая мишень при атеросклерозе. Всемирный журнал экспериментальной медицины 2015; 5: 154-9. Искать в Google Scholar
103 Cheng X, Ding Y, Xia C, et al. Аторвастатин модулирует ответ Th2 / Th3 у пациентов с хронической сердечной недостаточностью. Журнал сердечной недостаточности 2009; 15: 158-62. Искать в Google Scholar
104 Forster O, Hilfiker-Kleiner D, Ansari AA, et al. Обратное изменение уровней IFN-гамма, oxLDL и пролактина в сыворотке коррелирует с клиническим улучшением у пациентов с перипартальной кардиомиопатией.Европейский журнал сердечной недостаточности 2008; 10: 861-8. Искать в Google Scholar
105 Лю Дж., Гао Л., Занг Д. Повышенные уровни IFN-γ в спинномозговой жидкости и сыворотке крови пациентов с боковым амиотрофическим склерозом. PloS one 2015; 10: e0136937. Искать в Google Scholar
106 Mount MP, Lira A, Grimes D, et al. Участие интерферона-γ в опосредованной микроглией потере дофаминергических нейронов. Журнал неврологии 2007; 27: 3328-37. Искать в Google Scholar
107 Gallardo E, de Andres I, Illa I.Катепсины активируются IFN-гамма / STAT1 в мышечной культуре человека: возможный активный фактор при дерматомиозите. Журнал невропатологии и экспериментальной неврологии 2001; 60: 847-55. Искать в Google Scholar
108 Джерати П., Грин К.М., О’Махони М., О’Нил С.Дж., Таггарт С.К., МакЭлвейни Н.Г. Ингибитор секреторной лейкоцитарной протеазы подавляет экспрессию катепсина, индуцированную интерфероном-γ. Журнал биологической химии 2007; 282: 33389-95. Искать в Google Scholar
109 Giroux M, Schmidt M, Descoteaux A.IFN-γ-индуцированная экспрессия MHC класса II: трансактивация трансактиваторного промотора IV класса II регуляторным фактором-1 IFN регулируется протеинкиназой C-α. Журнал иммунологии 2003; 171: 4187-94. Искать в Google Scholar
110 Angell TE, Lechner MG, Jang JK, LoPresti JS, Epstein AL. Потеря MHC класса I является частым механизмом выхода из иммунитета при папиллярном раке щитовидной железы, который устраняется лечением интерфероном и селуметинибом in vitro. Клинические исследования рака 2014; 20: 6034-44. Искать в Google Scholar
111 Saric T, Chang S-C, Hattori A, et al.Индуцированная IFN-γ аминопептидаза в ER, ERAP1, урезает предшественники пептидов, представленных MHC класса I. Природа иммунологии 2002; 3: 1169-76. Искать в Google Scholar
112 Wang D, Quan Y, Yan Q, Morales JE, Wetsel RA. Направленное нарушение гена β2-микроглобулина сводит к минимуму иммуногенность эмбриональных стволовых клеток человека. Трансляционная медицина стволовых клеток 2015; 4: 1234-45. Искать в Google Scholar
113 Chang JH, Kim YJ, Han SH, Kang CY. Сигнал IFN-γ-STAT1 регулирует дифференцировку индуцибельного Treg: потенциальная роль в апоптозе, опосредованном ROS.Европейский журнал иммунологии 2009; 39: 1241-51. Искать в Google Scholar
114 Lambeth JD. Ферменты NOX и биология реактивного кислорода. Нат Рев Иммунол 2004; 4: 181-9. Искать в Google Scholar
115 Rovetta AI, Pena D, Hernandez Del Pino RE, et al. IFNG-опосредованные иммунные ответы усиливают аутофагию против антигенов Mycobacterium tuberculosis у пациентов с активным туберкулезом. Аутофагия 2014; 10: 2109-21. Искать в Google Scholar
116 Tu SP, Quante M, Bhagat G, et al.Интерферон-γ подавляет канцерогенез желудка, вызывая аутофагию эпителиальных клеток и апоптоз Т-клеток. Исследования рака 2011; 71: 4247-59. Искать в Google Scholar
117 Kim WH, Lee JW, Gao B, Jung MH. Синергетическая активация JNK / SAPK, индуцированная TNF-α и IFN-γ: апоптоз β-клеток поджелудочной железы через путь p53 и ROS. Передача сигналов в клетке 2005; 17: 1516-32. Искать в Google Scholar
118 Watanabe Y, Suzuki O, Haruyama T, Akaike T. Интерферон-γ индуцирует активные формы кислорода и стресс эндоплазматического ретикулума при апоптозе печени.Журнал клеточной биохимии 2003; 89: 244-53. Искать в Google Scholar
119 Gil MP, Bohn E, O’Guin AK, et al. Биологические последствия Stat1-независимой передачи сигналов IFN. Труды Национальной академии наук 2001; 98: 6680-5. Искать в Google Scholar
120 McNab FW, Rajsbaum R, Stoye JP, O’Garra A. Трехкомпонентные белки и регуляция врожденного иммунитета. Текущее мнение в иммунологии 2011; 23: 46-56. Искать в Google Scholar
121 Jutras I, Houde M, Currier N, et al.Модуляция протеома фагосомы интерфероном-гамма. Молекулярная и клеточная протеомика: MCP 2008; 7: 697-715. Искать в Google Scholar
122 Ghigo E, Capo C, Tung C-H, Raoult D, Gorvel J-P, Mege J-L. Выживание Coxiella burnetii в моноцитах THP-1 связано с нарушением созревания фагосом: IFN-γ опосредует его восстановление и уничтожение бактерий. Журнал иммунологии 2002; 169: 4488-95. Искать в Google Scholar
123 Santic M, Molmeret M, Abu Kwaik Y. Модуляция биогенеза Francisella tularensis subsp.novicida-содержащая фагосома в покоящихся макрофагах человека и ее созревание в фаголизосому при активации IFN-γ. Клеточная микробиология 2005; 7: 957-67. Искать в Google Scholar
124 Pei G, Bronietzki M, Gutierrez MG. Иммунная регуляция экспрессии белков Rab и внутриклеточного транспорта. Журнал биологии лейкоцитов 2012; 92: 41-50. Искать в Google Scholar
125 Huang Y, Kerin PM, Winston BW. Характеристика регуляции IFN-гамма гена фактора комплемента B в макрофагах.Eur J Immunol 2001; 31: 3676-86. Искать в Google Scholar
126 Gasque P, Dean YD, McGreal EP, VanBeek J, Morgan BP. Компоненты дополнения врожденной иммунной системы при здоровье и заболеваниях ЦНС. Иммунофармакология 2000; 49: 171-86. Искать в Google Scholar
127 Carroll MC. Система комплемента в регуляции адаптивного иммунитета. Природа иммунологии 2004; 5: 981-6. Искать в Google Scholar
128 Pearse RN, Feinman R, Shuai K, Darnell JE, Ravetch JV. Интерферон-гамма-индуцированная транскрипция высокоаффинного рецептора Fc для IgG требует сборки комплекса, который включает 91 кДа субъединицу фактора транскрипции ISGF3.Слушания Национальной академии наук 1993; 90: 4314-8. Искать в Google Scholar
129 Nimmerjahn F, Ravetch JV. Дивергентная активность подкласса иммуноглобулинов g за счет избирательного связывания рецептора Fc. Наука 2005; 310: 1510-2. Искать в Google Scholar
130 Klug-Micu GM, Stenger S, Sommer A, et al. Лиганд CD40 и интерферон-γ вызывают антимикробный ответ против Mycobacterium tuberculosis в моноцитах человека. Иммунология 2013; 139: 121-8. Искать в Google Scholar
131 Albanesi C, Fairchild HR, Madonna S, et al.IL-4 и IL-13 негативно регулируют TNF-α- и IFN-β-индуцированную экспрессию γ-дефенсина посредством STAT-6, супрессора передачи сигналов цитокинов (SOCS) -1 и SOCS-3. Журнал иммунологии 2007; 179: 984-92. Искать в Google Scholar
132 Taylor MW, Feng G. Связь между гамма-интерфероном, индоламином 2, 3-диоксигеназой и катаболизмом триптофана. Журнал FASEB 1991; 5: 2516-22. Искать в Google Scholar
IFN типа I расположен в эндосомах
Abstract
IFN типа I (IFN-I), как полагают, быстро усваивается и распадается после связывания с его рецептором и инициации передачи сигналов.Однако во многих исследованиях сообщается о стойких эффектах, опосредованных IFN-I в течение нескольких дней или даже недель, как ex vivo, так и in vivo. Эти длительные эффекты приписываются последующим сигнальным молекулам или индуцированным эффекторам, имеющим длительный период полужизни, особенно в определенных типах клеток. Здесь мы описываем механизм, объясняющий долгосрочные эффекты IFN-I. После связывания рецептора IFN-I распределяется по эндосомным компартментам. Эти внутриклеточные «силосы» IFN сохраняются в течение нескольких дней и могут быть визуализированы с помощью флуоресценции и электронной микроскопии.Однако функционально они в значительной степени неактивны из-за индуцированных IFN-I негативных регуляторов. Напротив, у людей, лишенных этих негативных регуляторов, таких как ISG15 или USP18, этот изолированный IFN-I может продолжать передавать сигналы изнутри эндосомы. Этот механизм может лежать в основе долгосрочных эффектов терапии IFN-I и может вносить вклад в патофизиологию интерферонопатий I типа.
IFN типа I (IFN-I) представляет собой мощный противовирусный и воспалительный цитокин с относительно коротким периодом полувыведения (1).Исчезает из плазмы через несколько часов после внутримышечного введения (2). Даже пегилированный IFN-I имеет период полувыведения всего 2 дня у человека (3). Тем не менее, IFN-I имеет долгосрочные функциональные эффекты. Например, экспрессия OAS1 , IFN-стимулированного гена (ISG), остается близкой к пиковым уровням в течение 1 недели у людей, получавших пегилированный IFN-I (4). Точно так же после заражения гриппом и разрешения у мышей лейкоциты костного мозга экспрессируют противовирусные гены и становятся устойчивыми к инфекции гриппа, несмотря на отсутствие обнаружения IFN-I в костном мозге или сыворотке в иммуноферментном анализе (5).Аналогичным образом, люди, у которых отсутствуют ISG15 или USP18, оба ключевых негативных регулятора IFN-I, как и ожидалось, имеют высокие уровни ISG в мононуклеарных клетках периферической крови (PBMC), но циркулирующий IFN-I выявляется только у половины лиц с дефицитом ISG15 ( 6), подчеркивая эффективность IFN-I. Здесь мы исследуем клеточные механизмы, управляющие этим фенотипом человека.
Результаты / Обсуждение
Только половина пациентов с дефицитом ISG15 имеет определяемый циркулирующий IFN-I, но у всех наблюдается высокий уровень ISG в их PBMC (6), что характерно для всех интерферонопатий I типа (7).Мы исследовали этот феномен путем количественной оценки информационной РНК (мРНК) ISG после 12 часов примирования IFN-I и 36 часов отдыха в фибробластах, иммортализованных hTert. В конце этого 48-часового периода уровни мРНК ISG были значительно выше в ISG15- и USP18-дефицитных клетках, чем в контрольных клетках (рис. 1 A ). Эти высокие уровни мРНК ISG сохранялись до 5 дней после прайминга IFN-I (в основном, следовательно, в отсутствие цитокина) в ISG15-дефицитных клетках, но возвращались к значениям до прайминга в контрольных клетках через 24 часа (8).Учитывая сохранение ISG в течение нескольких дней после удаления IFN-I, мы исследовали, накапливались ли ISG из-за отсутствия подавления регуляции во время первоначального воздействия IFN-I или из-за активной транскрипции после удаления цитокина. RT-qPCR на растущих транскриптах РНК, выделенных через 36-60 часов после удаления IFN-I, выявила активную транскрипцию ISG в ISG15- и USP18-дефицитных клетках, но не в контрольных клетках (рис. 1 B ). Таким образом, транскрипция происходит спустя долгое время после элиминации IFN-I в ISG15- и USP18-дефицитных клетках.
Рис. 1.Постоянство передачи сигналов IFN-I в ISG15- и USP18-дефицитных клетках. ( A ) Контрольным фибробластам, фибробластам с дефицитом ISG15 или USP18 вводили 0,197 нМ (1000 ед / мл) IFNα2b в течение 12 часов, промывали и отдыхали в течение 36 часов во всех экспериментах. Относительные единицы мРНК MX1 определяли количественно с помощью qPCR. ( B ) После A добавляли EU на 24 часа, выделяли РНК, содержащую EU (возникающая РНК), и проводили кПЦР. ( C и D ) Вестерн-блоттинг или IF для фосфо-STAT1, фосфо-STAT2 и общего STAT2 согласно A .Полосная денситометрия pSTAT1 относительно тубулина для C . (Увеличение в D : 40 ×.) ( E ) Клетки инкубировали с 10 мкМ Cerdulatinib (Cerd) или носителем (диметилсульфоксид [DMSO]) в течение 4 часов после A и проводили вестерн-блоттинг. ( F и G ) Клетки были примированы и оставлены присутствующими антителами, и был проведен ( F ) кПЦР или ( G ) вестерн-блоттинг. ( H ) КПЦР для мРНК IFNB после протокола первичного покоя или полиинозиновая: полицитидиловая кислота (поли I: C).( I ) Клетки подвергали первичному отдыху согласно A , и супернатанты помещали на наивные контрольные клетки на 8 часов (NT) или с анти-IFNα. Контрольные клетки, которым вводили 0,197 нМ IFN-I (8 ч), служили положительным контролем, и количественно определяли мРНК RSAD2 . СЭМ представлены непарные тесты Стьюдента t : * P <0,05, ** P <0,01, *** P <0,001, **** P <0,0001. ns = не имеет значения.
Мы исследовали молекулы, действующие дальше вверх по течению, и обнаружили pSTAT1 и pSTAT2 (медиаторы проксимальной передачи сигналов IFN-I) (9) в клетках с дефицитом ISG15 и USP18, но не в контрольных клетках (рис.1 C ), что соответствует инициации транскрипции. Иммунофлуоресцентное окрашивание (IF) для общего STAT2 в этот момент времени подтвердило его ядерную локализацию (фиг. 1 D ). В присутствии Cerdulatinib, ингибитора киназы Janus (JAK), pSTAT1 и pSTAT2 были отменены, что указывает на то, что JAK все еще были активны через 36 часов после удаления IFN-I (рис. 1 E ). Мы убедились, что бесконечно малое количество остаточного растворимого цитокина не вызывает эту позднюю транскрипцию, путем инкубации клеток с антителом против IFN-I (рис.1 F и G ) и подтвердили, что IFN-I не транскрибируется в клетках (фиг. 1 H ). Мы действительно обнаружили незначительные количества IFN-I в супернатанте, но он был полностью заблокирован антителом IFN-I (рис. 1 I ). Вместе эти результаты демонстрируют, что передача сигналов, опосредованная IFN-I, может происходить в отсутствие растворимого цитокина.
Эти результаты означают, что либо существует «бесситокиновая» передача сигналов, либо цитокин присутствует в клетках. Мы проверили эти гипотезы, выполнив объемную флуоресцентную визуализацию после обработки флуоресцентно меченным IFN-I.Клетки HeLa стимулировали IFN-I в течение 17 часов, промывали, оставляли в покое в течение 25 часов, а затем отображали с помощью микроскопии на решетчатых световых пластинах (LLSM). Мы обнаружили IFN-I, колокализованный с Rab5, ранним эндосомальным маркером, демонстрируя, что IFN-I удерживался в том, что мы называем «силосами IFN» (рис. 2 A ), ранее недооцененными участками хранения IFN-I. Мы обнаружили эти бункеры во всех генетических фонах (рис. 2 B ). Хотя известно, что рецептор IFN-I (IFNAR) подвергается эндоцитозу (10), это документальное подтверждение того, что IFN-I присутствовал эндосомно после прекращения передачи сигнала.Мы демонстрируем, что IFNAR необходим для образования активных силосов IFN-I (рис. 2 C ). Используя массив одиночных молекул (SiMoA) (фиг. 2 D ) и электронную микроскопию (EM), мы подтвердили внутриклеточное удерживание IFN-I (фиг. 2 E ). Наконец, в то время как ингибитор эндоцитоза минимально влияет на проксимальную передачу сигналов, он полностью меняет фенотип в клетках, лишенных негативной регуляции (Fig. 2 F ).
Рис. 2.IFN-I удерживается внутриклеточно. ( A ) Клетки HeLa, экспрессирующие Rab5-mNeonGreen (зеленый), инкубировали с 5 нМ DY647 IFNα2 (пурпурный) в течение 17 часов, промывали, отдыхали в течение 25 часов и визуализировали с помощью LLSM ( Top ).Необработанные клетки демонстрируют фоновую автофлуоресценцию ( Нижний ). Z-выступы состоят из пяти секций (общая толщина 0,52 мкм). График в виде прямоугольников показывает коэффициенты корреляции для совместной локализации IFNα2 и Rab5 ( n = 10 клеток). ( B ) Контрольным клеткам, клеткам с дефицитом ISG15 и USP18 давали DY647 IFNα2 в течение 17 часов и визуализировали или оставляли в покое в течение 24 часов и определяли количество везикул IFN-I. ( C ) ЭМ контрольных или IFNAR2-дефицитных клеток, которым вводили 0,5 нМ биотина IFN-I в течение 15 мин.Желтые стрелки обозначают положительную иммунореактивность. ( D ) Прайм-покоя клетки оценивали с помощью SiMoA, P = 0,0093. ( E ) ЭМ контрольных клеток, которым вводили 0,5 нМ биотина IFN-I в течение 12 часов, промывали и помещали в среду, содержащую 0,2 мкг / мл анти-IFNa или носитель (овечья сыворотка), в течение 36 часов. Типичный пример отрицательного контроля ( 1 ) без биотина IFN-I; ( 2 ) IFN-I биотин 12 ч, отдых 36 ч; ( 3 ) IFN-I, биотин, 12 часов, анти-IFNα в течение 36 часов отдыха; и ( 4 ) IFN-I биотин, 12 часов, овечья сыворотка в течение 36 часов отдыха.Звездочкой обозначены немеченые эндосомы; стрелка обозначает положительную иммунореактивность внутри эндосомы; n = 50 ячеек на условие. ( F ) Клетки примировали-покоя в ДМСО или 100 мкМ PitStop2, и проводили qPCR. Клетки, которым вводили IFN-I с ДМСО или PitStop2 в течение 6 часов, служили контролем. СЭМ представлены непарные тесты Стьюдента t : * P <0,05, **** P <0,0001.
Представленные здесь данные помогают разрешить парадокс долгосрочных эффектов цитокина после того, как он больше не обнаруживается.Этот феномен объясняется удержанием IFN-I в эндосомах Rab5 + после передачи сигнала, при этом продолжение передачи сигналов в значительной степени предотвращается с помощью USP18 в клетках дикого типа. Таким образом, передача сигналов отменяется не устранением цитокина, а действием негативных регуляторов. Взаимосвязь между оборотом USP18 и скоростью деградации IFN-I в эндосоме может оставлять место для низких уровней передачи сигналов IFN-I в некоторых типах клеток, что потенциально объясняет долгосрочные эффекты терапии IFN-I in vivo. .Будет очень интересно определить, способствует ли удержание IFN-I в эндосомах воспалению при заболеваниях, для которых характерны сигнатуры IFN-I, таких как системная красная волчанка (11), при которой цитокин не может быть легко обнаружен. но ISG есть.
Материалы и методы
Клетки представляли собой иммортализованные hTert дермальные фибробласты от контрольных пациентов, пациентов с дефицитом ISG15 и USP18. ОТ-КПЦР выполняли, как описано ранее (8). Для захвата зарождающейся РНК этинил уридин (EU) инкубировали в течение 24 часов.МРНК, содержащая EU, была выделена для RT-qPCR (12). Вестерн-блоттинг выполняли, как описано ранее (8). Для конфокальной микроскопии клетки окрашивали на DAPI и STAT2 (sc-476; 1: 100). Для анализа использовались микроскоп Leica SP5 DMI и Cell Profiler. Для блокирования IFN-I использовали антитело против IFNα человека (PBL 31110–1) в концентрации 0,2 мкг / мл с овечьей сывороткой (Millipore S3772, 1: 3 для эквивалентной концентрации) в качестве носителя. Сайт-специфическое мечение IFN выполняли, как описано ранее (13, 14).Для флуоресцентной микроскопии клетки трансфицировали фосфатом кальция с помощью pSEMS Rab5 mNeonGreen (pSEMS-26m Covalys) и обрабатывали DY647 IFNα2 в течение 17 часов, промывали и оставляли в покое в течение 25 часов. Визуализацию живых клеток выполняли с помощью LLSM (15). Для EM клетки стимулировали 0,5 нМ биотинилированного IFN-I в течение 15 минут или 12 часов, затем инкубировали с антителом против IFNα или носителем в течение 36 часов. Для SiMoA лизаты с примированным IFN-I прогоняли на SiMoA HD-1 или SR-X.
Доступность данных.
Все подтверждающие данные включены в рукопись.
Благодарности
Мы благодарим Эллисон Сова и Билла Янссена из центра микроскопии Mount Sinai, а также Людовика Дебюра и доктора Томаса Вишневски из Нью-Йоркского университета за их помощь с SiMoA (гранты AG08051 и R01AF058267). Источники финансирования следующие: Deutsche Forschungsgemeinschaft для J.P. (гранты PI 405/10 и PI 405/14), Национальный институт аллергии и инфекционных заболеваний для D.B. (Grant R01AI127372) и грант на обучение взаимодействию вирусов с хостом для J.B.A. (Грант 5T32AI007647-17).
Сноски
Вклад авторов: J.B.A., C.N.G., J.P. и D.B. спланированное исследование; J.B.A., J.T., T.W. и M.H. проведенное исследование; J.P. предоставил новые реагенты / аналитические инструменты; J.B.A., J.T., T.W., C.N.G., M.H. и D.B. проанализированные данные; и J.B.A. и Д. написал газету.
Авторы заявляют об отсутствии конкурирующей заинтересованности.
- Copyright © 2020 Автор (ы). Опубликовано PNAS.
Путь интерферона при СКВ: один ключ к разгадке тайны болезни
Введение
СКВ на протяжении многих лет была проблемой для клиницистов и загадкой для фундаментальных ученых из-за сложной клинической картины и сбивающего с толку множества факторов. различные отклонения в иммунной системе.Постепенно ряд наблюдений в нескольких исследовательских группах раскрыл важные механизмы, лежащие в основе многих клинических и лабораторных данных, которые теперь используются в новых методах лечения. Однако несколько клинических испытаний потерпели неудачу, и этому есть ряд причин. Одна из причин заключается в том, что мы до сих пор не знаем, как генетическая установка, факторы окружающей среды и случайные события способствуют возникновению заболевания и непрерывному аутоиммунному процессу. Очевидно, что необходимо более подробно изучить несколько ключевых элементов СКВ, чтобы полностью раскрыть секрет этого заболевания.Среди ключевых открытий при СКВ — заметная экспрессия регулируемых интерфероном (IFN) генов, сигнатуры IFN, в крови и тканях.1–4 Это наблюдение было сообщено несколькими группами еще в 2003 году и инициировало интенсивную активность среди исследователей, пытающихся объяснить находка. Одновременно коллеги начали исследовать, может ли сигнатура IFN быть связана с клиническим фенотипом, активностью заболевания, сопутствующими заболеваниями, эффектами лечения и прогнозом. Несмотря на то, что за последние 16 лет было накоплено много знаний о системе IFN при СКВ, многое все еще остается неясным или неизвестным.Например, какова причина или спусковой механизм подписи IFN? В какой мере вносят вклад IFN типа II и типа III, помимо IFN типа I, в сигнатуру IFN? Какие клетки продуцируют IFN, и разные клетки ответственны за продукцию IFN на разных этапах заболевания? Должны ли мы блокировать систему IFN при СКВ, и если да, то какая цель является наиболее подходящей? Мы хотим выделить некоторые аспекты, которые важны не по крайней мере для понимания того, как стратифицировать пациентов при выборе линии терапии.
Интерфероны
IFN составляют фундаментальную часть защиты от вирусных инфекций и изначально определялись их способностью «мешать» репликации вируса.5 Во время вирусных инфекций вырабатываются большие количества IFN, активируя противовирусный механизм в IFN- экспонированные клетки, что приводит к подавлению репликации вируса. Вирусы пытаются обойти этот врожденный защитный механизм, и одним из ярких примеров является «испанский» грипп, который может блокировать экспрессию нескольких генов, стимулированных IFN, что, вероятно, способствовало высокой смертности во время пандемии 1918 года.6
Существует три различных типа IFN (I – III), и IFN типа I являются самым большим семейством. Его можно разделить на пять классов (IFN-α, β, ε, κ и ω), из которых IFN-α можно разделить на 12 подтипов.7 Большинство клеток могут продуцировать небольшие количества IFN типа I, но основной тип I IFN-продуцирующая клетка представляет собой плазматическую дендритную клетку (pDC), первоначально называемую естественной IFN-продуцирующей клеткой.8 9 IFN типа I обычно индуцируются вирусами, бактериями или микробными нуклеиновыми кислотами, когда они воспринимаются локализованными рецепторами распознавания образов (PRR). в цитозоле или в эндосоме.Эти PRRS включают Toll-подобные рецепторы (TLR), рецепторы, подобные индуцибельному гену 1 (RIG-I) ретиноевой кислоты (RLR) и рецепторы, подобные домену олигомеризации нуклеотидов (NLR) 10. Все IFN типа I связываются с одним и тем же повсеместно экспрессируемым типом. I IFN-рецептор (IFNAR), который состоит из двух полипептидных цепей IFNAR1 и IFNAR2. Последующий сигнальный путь включает активацию янус-киназы (JAK) 1 и тирозинкиназы (TYK) 2 и образование комплекса генного фактора 3, стимулированного интерфероном (IGSF3), включая сигнальный преобразователь и активатор транскрипции (STAT) 1, STAT2 и регуляторный фактор интерферона (IRF) 9.IGSF3 связывается со стимулированными интерфероном элементами ответа в промоторах IFN-регулируемых генов11 (рисунок 1).
Рисунок 1Рецепторы интерферона и передача сигналов. Интерфероны подразделяются на три типа, которые связываются с разными рецепторами. Это вызывает активацию перекрывающихся путей, что приводит к экспрессии разных генов. ГАЗ, последовательность, активированная гамма-интерфероном; ИФН, интерферон; IFNAR, рецептор интерферона альфа; IFNGR, рецептор интерферона гамма; IFN-λR1, лямбда-рецептор интерферона 1; IL-10Rβ, рецептор интерлейкина-10 β; IRF — регуляторный фактор интерферона; ISGF3, фактор 3 гена, стимулированного интерфероном; ISRE, элементы ответа, стимулированные интерфероном; JAK, киназа Януса; STAT, преобразователь сигнала и активатор транскрипции; TYK2, тирозинкиназа 2.
IFN типа II состоит только из одного члена, и многие разные клетки продуцируют IFN-γ, включая естественные киллеры (NK) и Т-клетки.12 IFN-γ связывается с рецептором IFN-γ (IFNGR), который экспрессируется в большинстве клеток. . Посредством активации JAK1 и JAK2 лигирование IFNGR приводит к фосфорилированию гомодимеров STAT1 и связыванию с IFN-γ-активированными сайтами (GAS) и последующей экспрессии гена11 (фиг.1). Этот сигнальный путь также может использоваться IFNAR, и поэтому существует большое перекрытие между генами, индуцированными типом I и II.13
IFN типа III включают четыре недавно идентифицированных лямбда IFN: IFNλ1 / IL29, IFNλ2 / IL28A, IFNλ3 / IL28B и IFNλ4 (IFNL4) .14 IFN-λ наиболее распространены на поверхностях барьеров, включая дыхательные и желудочно-кишечные тракты, и вырабатываются эпителиальными клетками и клетками эпителиального происхождения, включая гепатоциты и некоторые иммунные клетки (макрофаги и DC). IFNs типа III передают сигнал через рецепторный комплекс (IFNLR1 / IL10Rβ), который в первую очередь экспрессируется на эпителиальных клетках (желудочно-кишечных, респираторных и мочеполовых), гепатоцитах и некоторых иммунных клетках, включая нейтрофилы и DC 14 (рисунок 1).
Интерферон в СКВ
Повышенные уровни ИФН в сыворотке у пациентов с СКВ уже были описаны 40 лет назад15 и позже были идентифицированы как ИФН типа I. 16 Обсервационные исследования показали, что у пациентов, леченных от злокачественных новообразований с помощью ИФН-альфа, может развиться волчанка. как болезнь с аутоантителами к ядерным антигенам, предполагая, что IFN типа I может нарушить толерантность и вызвать аутоиммунное заболевание.17 18 Когда стал доступен анализ экспрессии всего генома, несколько групп показали, что 50–75% взрослых пациентов и до 90 % детей с СКВ демонстрируют повышенную экспрессию IFN-регулируемых генов I типа (подпись IFN).1–4 Более молодые пациенты имеют более выраженную активность IFN по сравнению с пациентами старшего возраста, 19 и активность заболевания СКВ коррелирует с уровнями IFN-α и силой сигнатуры IFN2. генерируют относительно стабильный паттерн транскриптов IFN-I с течением времени, в то время как другие кластеры генов могут отражать индукцию IFN-β или IFN-γ и представлять более вариабельный паттерн.23 Таким образом, сигнатура IFN, наблюдаемая у пациентов с СКВ, вероятно, соответствует большему количеству Типы IFN, чем просто IFN-α, хотя IFN типа I кажется наиболее важным.
Важно отметить, что очень большое количество генов регулируется IFN, а конкретные экспрессируемые гены зависят от типа клеток, экспрессируемых рецепторов, типа стимулов и времени отбора проб. Недавние исследования показали, что, возможно, 10% наших генов регулируются IFN, но IFN типа III индуцирует ограниченное количество генов, и уникальные транскрипты не определены.24 Исследования сигнатуры IFN при СКВ включали различные составы клеток, часто лейкоциты цельной крови или периферической крови, а количество исследованных генов варьировалось от нескольких до больших панелей.Существует также значительное перекрытие между генами, индуцированными IFN типа I, II и III, поэтому было трудно дифференцировать IFN, вносящие вклад в сигнатуру. Результаты были непоследовательными, и иногда их было сложно интерпретировать, поскольку на сегодняшний день не существует единого мнения о том, как измерять балл. Однако все три IFN, по-видимому, вносят вклад в сигнатуру 23, 25, 26. Возможно, неудивительно, что при сравнении сигнатуры IFN у пациентов с вирусной инфекцией и СКВ пациенты с СКВ демонстрируют более сложный паттерн экспрессии генов.27 Исследования экспрессии IFN в тканях добавили дополнительную сложность в эту область, поскольку ранее игнорировавшиеся IFN могут быть важны в конкретных органах, таких как IFN-κ при кожной волчанке.28
Триггеры производства интерферона в SLE
В течение последнего лет был описан ряд возможных механизмов, объясняющих стойкую продукцию IFN типа I при СКВ, и на фиг. 2 показаны несколько возможных индукторов продукции IFN. Важный механизм индукции IFN-α опосредуется интерферогенными IC, которые состоят из аутоантител и белков, связывающих нуклеиновые кислоты.29–31 ICs подвергаются эндоцитозу через FcγRIIa на pDC, транспортируются в эндосому, где нуклеиновая кислота, входящая в состав IC, связывает TLR7 или TLR9 с последующей активацией факторов транскрипции и продуцированием IFN-α32 (рис. 3). Этот путь индукции IFN был продемонстрирован in vitro, сочетая очищенный SLE IgG и апоптотический или некротический клеточный материал, а также малые ядерные рибонуклеопротеины (snRNP), что актуально с учетом повышенного апоптоза и снижения клиренса апоптотического мусора, наблюдаемого у пациентов с SLE.33 34
Рисунок 2Индукторы и регуляторы продукции IFN-α плазматической дендритной клеткой. APC, антигенпрезентирующая клетка; GM-CSF, гранулоцитарно-макрофагальный колониестимулирующий фактор; IC, иммунный комплекс; ИФН, интерферон; ИЛ-3, интерлейкин 3; LFA1, антиген 1, связанный с функцией лимфоцитов; MIP-1β, воспалительный белок макрофага-1β; NET, внеклеточные ловушки нейтрофилов; PECAM-1, молекула адгезии тромбоцитов и эндотелиальных клеток 1; АФК, активные формы кислорода.
Рисунок 3Схематическое изображение продукции интерферона типа I и различных сенсоров нуклеиновых кислот.цГАМФ, циклический GMP-AMP; cGAS, циклическая GMP-AMP-синтаза; DAI, ДНК-зависимый активатор IFN-регуляторных факторов; DDX41, геликаза DEAD-box 41; ДНК-PKcs, ДНК-зависимая протеинкиназа; ER, эндоплазматический ретикулум; FCGRIIA, Fc-гамма рецептор II A; IC, иммунный комплекс; IFI16, индуцируемый гамма-интерфероном белок 16; IRAK, киназа, ассоциированная с рецептором интерлейкина-1; IRF — регуляторный фактор интерферона; MAVS, митохондриальный антивирусный сигнальный белок; MDA5, белок 5, связанный с дифференцировкой меланомы; MyD88, первичный ответ миелоидной дифференцировки 88; NET, внеклеточные ловушки нейтрофилов; RIG-I, ген I, индуцируемый ретиноевой кислотой; СТИНГ, стимулятор генов интерферона; TLR, Toll-подобный рецептор; TRAF6, факторы, связанные с рецептором TNF; TREX1, три экзонуклеазы первичной репарации 1.
Образование NET — это путь гибели клеток, при котором нейтрофилы вытесняют ядерный материал, такой как гистоны, деконденсированный хроматин и цитоплазматические белки, в виде паутины. Пациенты с СКВ имеют повышенное образование NET и сниженную способность расщеплять NET из-за снижения функции внеклеточной ДНКазы I.35 36 Это увеличивает воздействие нуклеиновых кислот и белков на аутореактивные B-клетки и аутоантитела, и было показано, что NET активируют pDC для продуцируют высокие уровни IFN-α TLR9-зависимым образом36, 37 (рисунок 2).Недавно было показано, что нейтрофилы СКВ выделяют высокие уровни окисленной митохондриальной ДНК, которая может индуцировать продукцию IFN-α через путь cGAS-стимулятора генов интерферона (STING) .38 Кроме того, комплексы катионного антимикробного пептида LL37-ДНК, полученные из NET, расширяются самостоятельно. реактивные В-клетки памяти для продуцирования антител против LL37 Ag-зависимым образом.39 Подчеркивая важность воздействия аутоантигенов на иммунную систему для образования IC и индукции IFN, другие описанные самовоспроизводящиеся индукторы IFN включают хромосомный белок группового бокса с высокой подвижностью. и белок теплового шока 90.40–42
Мобильные элементы (ТА) — это последовательности ДНК, которые могут изменять положение в геноме и составляют более половины ДНК человека.43 Они представляют собой потенциально значительный источник стимулирующей собственной нуклеиновой кислоты. Длинный вкрапленный ядерный элемент-1 (L1) является ТА класса I, и считается, что 80–100 L1 остаются активными у любого конкретного человека.43 Гипометилирование L1 наблюдается при СКВ и связано с повышенной экспрессией L1.44 45 В почках При биопсии пациентов с СКВ-нефритом наблюдалась повышенная экспрессия L1, которая коррелирует с экспрессией IFN типа I.45 L1 запускает продукцию IFN pDC через TLR7, но также и моноцитами через цитоплазматический RIG-I. 45
Инфекции могут вызвать начало СКВ или вспышку заболевания, и, хотя многие вирусы участвуют в этиологии СКВ, специфического вируса нет. или были выявлены бактерии, вызывающие заболевание. Микробиота кишечника может активировать STING и индуцировать IFN типа I, 46 и недавно было показано, что грамположительные бактерии Enterococcus gallinatum перемещаются через кишечный барьер и индуцируют клетки Th27 и Tfh, а также пути врожденного иммунитета, включая ось pDC / IFN. .47 Лечение мышей F1 с предрасположенностью к волчанке (NZW × BXSB) антибиотиками подавляло выработку аутоантител и облегчало течение болезни. Учитывая нарушение функции кишечного барьера, наблюдаемое при СКВ, эти данные подчеркивают возможность того, что микробиом кишечника может иметь этиопатогенетическое значение, по крайней мере, для подгруппы пациентов с СКВ.
В заключение, существует большое количество возможных индукторов продукции IFN при СКВ, и, вероятно, разные индукторы наиболее важны для разных пациентов.Более глубокое понимание соответствующих триггеров и путей, опосредующих продукцию IFN у отдельных пациентов, будет большим подспорьем для разработки точных методов лечения, нацеленных на конкретные индукторы IFN, вызывающие стойкую продукцию IFN.
Интерферон-продуцирующие клетки при СКВ
У пациентов с СКВ в кровообращении снижается количество пДК, но их можно обнаружить в воспаленных тканях, таких как кожа48, 49 и почки, где они, по-видимому, активируются50. данные свидетельствуют о том, что pDC в значительной степени ответственны за продолжающееся производство IFN при СКВ.Таким образом, на мышиных моделях волчанки истощение pDC ослабляет течение болезни51, а генетически нарушенная функция pDC улучшает течение болезни.52 Недавнее исследование также показало, что нацеливание на pDC у пациентов с СКВ снижает экспрессию генов ответа IFN в крови, снижает кожные иммунные клетки. инфильтрирует и смягчает кожные поражения.53 Несмотря на эти наблюдения, роль других IFN-продуцирующих клеток при СКВ требует уточнения, поскольку ряд исследований предполагает, что несколько других типов клеток участвуют в продукции IFN.Среди них кератиноциты, которые могут продуцировать как IFN-κ28, так и IFN-λ26, так и моноциты, которые участвуют в генерации сигнатуры IFN.54 Моноциты в основном ответственны за продукцию IFN в модели мышиной волчанки, индуцированной пристаином, которая характеризуется выраженной сигнатурой IFN, и макрофаги, происходящие из моноцитов человека, трансфицированные небольшой некодирующей Y-РНК или стимулированные иммунными комплексами, экспрессируют мРНК IFN-α и IFN-β.55 Однако точная роль IFN-продуцирующих моноцитов в человеческая СКВ в настоящее время не решена и требует дальнейшего изучения.Нейтрофилы обладают способностью продуцировать IFN56 типа I, а нейтрофилы костного мозга у пациентов с СКВ продуцируют IFN-α.57 Выработанный IFN, по-видимому, способствует изменениям в развитии B-клеток с уменьшением доли про / пре-B-клеток, предполагая подавление раннего развития В-клеток и рост В-клеток на переходной стадии. Это вполне могло быть ранним событием в нарушении толерантности и развитии аутоиммунитета с производством аутоантител. Помимо клеток, продуцирующих IFN I типа, активированные NK-клетки при СКВ имеют повышенную продукцию IFN-γ.58 Кроме того, детектируемые транскрипты IFN-λ были отмечены в лейкоцитах периферической крови пациентов с SLE, 59 но точный источник IFN-λ у пациентов с SLE в настоящее время неясен.
Важным наблюдением является то, что несколько типов клеток после активации могут стимулировать pDC к увеличению продукции IFN. Таким образом, NK-клетки, B-клетки и T-клетки могут усиливать продукцию IFN, когда pDC подвергаются воздействию иммунных комплексов, содержащих нуклеиновые кислоты 60–62 (рисунок 2). Актуальность этих результатов in vivo еще предстоит установить, но предполагает, что при СКВ существует обширная перекрестная связь между различными иммунными клетками и pDC, которая способствует продолжающемуся производству IFN и устойчивому аутоиммунному процессу.
Таким образом, несколько типов клеток могут вносить вклад в сигнатуру IFN, наблюдаемую у пациентов с СКВ, и хотя pDC, скорее всего, является основным источником IFN, кажется возможным, что в подгруппе пациентов другие типы клеток являются важными продуцентами IFN. которые необходимо нацелить, чтобы полностью контролировать активированную систему IFN.
Генетические факторы, влияющие на систему IFN в SLE
Сегодня более 100 локусов генетического риска связаны с SLE63, и более половины идентифицированных генов чувствительности к SLE кодируют белки, функции которых прямо или косвенно связаны с выработкой IFN типа I или ответами .64 65 К ним относятся гены, участвующие в активации Toll-подобных рецепторов и их сигнальные молекулы, расположенные ниже по течению. Для большинства вариантов гена риска механизм, с помощью которого ген риска влияет на восприимчивость или тяжесть заболевания, неизвестен, но недавние исследования пролили некоторый свет на этот вопрос. Одним из наиболее сильных локусов риска СКВ за пределами области HLA является сигнальный преобразователь и активатор транскрипции (STAT) 4, который более 10 лет известен как локус риска СКВ.66 Интронные SLE-ассоциированные с СКВ STAT4 SNP связаны друг с другом. к фенотипу заболевания с более ранним началом и повышенным риском инсульта и нефрита с тяжелой почечной недостаточностью.67–69 Недавно мы показали, что активированные Т-клетки от носителей аллеля риска STAT4 с СКВ имеют повышенные уровни белка STAT4, что приводит к более фосфорилированному STAT4 в ответ на IL-12 и IFN-α, а также к усилению индуцированного IL-12 Продукция IFN-γ.70 Напротив, активированные Т-клетки здоровых людей, несущих аллель риска STAT4, демонстрировали пониженный ответ. Это открытие может иметь важное значение в отношении того, почему у большинства носителей аллеля риска не развивается болезнь, и предполагает, что аллель риска STAT4 должен взаимодействовать с другим хозяином или факторами окружающей среды, чтобы быть патогенным.Поскольку предварительная инкубация здоровых донорских клеток с IFN-α избирательно усиливала ответ IL-12 у носителей аллеля риска STAT4, вполне возможно, что носители STAT4 аллеля риска имеют риск развития СКВ во время длительной продукции IFN типа I. результаты также связывают локус чувствительности к СКВ с системами IFN как типа I, так и типа II, и можно предположить, что эти результаты, по крайней мере частично, могут объяснить хороший терапевтический ответ на анти-IL-12 / IL-23 mAb устекинумаб в пропорции больных СКВ.72
Интерферонопатии включают группу редких моногенных заболеваний с конститутивной избыточной продукцией IFN типа I, вызванной мутациями в генах, ответственных за обработку нуклеиновых кислот.73 Таким образом, у этих пациентов наблюдаются различные нарушения внутриклеточного метаболизма нуклеиновых кислот или цитозольных нуклеиновых кислот. кислоточувствительные пути, вызывающие аутоиммунное или аутовоспалительное заболевание. Пациенты имеют заметную подпись IFN, но демонстрируют заметную фенотипическую гетерогенность, которая указывает на то, что другие гены и факторы окружающей среды изменяют воспалительный ответ.Некоторые пациенты имеют явный фенотип СКВ, и возможно, что гены, ответственные за интерферонопатии, также способствуют развитию заболевания у части пациентов с СКВ, обычно встречающихся в отделении ревматологии. Фактически, недавнее исследование полногеномного секвенирования пациентов с СКВ показывает, что ультра-редкий кодирующий гетерозиготный вариант, связанный с разнообразным спектром интерферонопатий, чрезмерно представлен среди пациентов с СКВ.74
Эпигенетические изменения заметны в клетках и клетках. тканей пациентов с СКВ, а недавний всесторонний обзор суммирует исследования метилирования ДНК при СКВ.75 У пациентов с СКВ уровень метилирования снижен в большом количестве сайтов CpG, а наиболее сильно гипометилированные гены регулируются IFN.76 Кроме того, в исследовании близнецов, дискордантных по SLE, была выявлена более высокая степень гипометилирования IFN-регулируемых генов среди близнецы, у которых в течение последних 2 лет произошел обострение, что связывает эпигенетическую сигнатуру IFN с более активным заболеванием.77 Поскольку некоторые эпигенетические изменения являются митотически наследуемыми и относительно стабильными, возможно, что некоторые из деметилированных сайтов в IFN-регулируемых генах гипометилированы уже в утробе матери или получены от одного из родителей, хотя воздействие IFN во время обострения болезни кажется наиболее вероятным.
В совокупности генетические исследования демонстрируют, что генетический риск развития СКВ тесно связан с вариантами генов в сигнальном пути ИФН и изменениями в регулируемых ИФН генах. Механизмы, с помощью которых эти изменения участвуют в развитии СКВ, интенсивно изучаются, но результаты пока подтверждают предположение, что генетическая установка напрямую способствует аутоиммунному процессу, управляемому IFN.
Связь между системой IFN и другими иммунными клетками
Как упоминалось выше, ряд клеток иммунной системы может взаимодействовать с pDC и усиливать ответ IFN.Возможно, даже более важным является влияние продуцируемого IFN на большинство клеток как врожденной, так и адаптивной иммунной системы (обзор Eloranta et al. 8). IFN типа I действует как иммунный адъювант, и одним из механизмов усиления иммунного ответа с помощью IFN типа I является повышенная экспрессия молекул MHC I, 78 что облегчает перекрестную презентацию экзогенных антигенов, а также обнаружение инфицированных вирусом клеток цитотоксическими методами. Т-клетки. IFN также способствует экспрессии ряда других молекул, важных для иммунного ответа, таких как MHC II, CD40, CD80 и CD86, а также экспрессии хемокинов и их родственных рецепторов, таких как CXCL10 и CXCR3.ДК, стимулированные IFN, созревают и достигают молекулярного репертуара, который делает их очень сильными в качестве антигенпрезентирующих клеток и способными индуцировать дифференцировку наивных CD4 + Т-клеток, а также развитие CD8 + Т-клеток памяти. IFN типа I увеличивает дифференцировку клеток Th27 и подавляет функции Treg, что может привести к увеличению аутореактивных Т-клеток79
IFN типа I влияют на функцию B-клеток посредством различных механизмов, которые приводят к продлению выживания и активации, включая дифференцировку и рекомбинация с переключением классов, вызывающая повышенную продукцию антител (обзор Kiefer et al. 80).IFN типа I увеличивают продукцию фактора активации B-клеток в моноцитах и посредством этого механизма стимулируют продукцию антител. 81 NK-клетки считаются важными, по крайней мере, для подгруппы пациентов с SLE82 и IFN типа I, повышающие цитотоксичность и продукцию IFN-γ в организме. NK-клетки, связывающие системы IFN как типа I, так и типа II.83
IFN типа I также имеют эффекты за пределами иммунной системы, такие как нарушение эндотелий-зависимой вазорелаксации и функции эндотелиальных клеток-предшественников, которые замедляют развитие процесс восстановления поврежденного эндотелия.84–86 Кроме того, IFN-α подавляет экспрессию eNOS и снижает инсулино-опосредованную продукцию оксида азота в эндотелиальных клетках, 87 усиливает образование пенистых клеток88 и изменяет функцию тромбоцитов.89 Эти наблюдения могут быть связаны с неожиданно высокой распространенностью атеросклероза и сердечно-сосудистых заболеваний в Пациенты с СКВ. 90 В более общем плане очевидно, что существует несколько пагубных эффектов на клетки и ткани, которые подвергаются воздействию IFN в течение длительного периода времени. 91 Рисунок 4 суммирует влияние различных IFN на разные типы клеток.14 25 92 93
Рисунок 4Влияние интерферонов (IFN) на разные типы клеток. NET, внеклеточные ловушки нейтрофилов.
Болезнь в SLE
Многие результаты, касающиеся системы IFN у пациентов с СКВ, могут быть объединены в этиопатогенную модель СКВ, которая была рассмотрена в другом месте.94 Например, первоначальная инфекция вирусом может вызвать тип I Продукция IFN и высвобождение клеточного материала из умирающих клеток. Также существует несколько других триггеров продукции IFN, как обсуждалось выше.Внеклеточные аутоантигены из апоптотических и некротических клеток, а также NET из гранулоцитов затем запускают B-клетки для выработки аутоантител против РНК и ДНК-связывающих белков у людей, склонных к аутоиммунным реакциям. Будут образовываться IC, которые действуют как эндогенные индукторы IFN I типа, вызывая длительную стимуляцию продукции IFN I типа pDC. Чрезмерное высвобождение эндогенной ДНК / РНК в сочетании с нарушенным клиренсом апоптотического клеточного материала будет способствовать продукции IFN рядом типов клеток.Это приведет к хронической активации системы IFN, которая будет запускать аутоиммунный процесс, приводящий к хроническому воспалению и повреждению тканей по замкнутому кругу.
Система IFN и проявления болезни
Ряд признаков и симптомов у пациентов с СКВ связаны с повышенной выработкой IFN. Общие симптомы острых вирусных инфекций, такие как боль в мышцах и суставах, головная боль, плеврит, утомляемость и лихорадка, связаны с IFN I типа. 20 IFN также оказывает подавляющее действие на костный мозг, приводя к анемии, нейтропении, лимфопении и тромбоцитопении, 95 и следовательно, высокий показатель подписи IFN был связан с гематологическими критериями Американского колледжа ревматологии.2 Наличие анти-дцДНК, анти-SSA и анти-РНП связано с высокой активностью IFN-α96 и антителами к РНК с сильной сигнатурой IFN, 21 подчеркивая связь между IFN и созреванием B-клеток и производством аутоантител.
Кожа
Пациенты с наследственными интерферонопатиями часто проявляют кожные проявления, включая малярную сыпь и алопецию.97 При СКВ сигнатура ИФН коррелирует с активностью кожного заболевания, 98 и регулируемые ИФН гены экспрессируются в эпидермисе и дерме кожных поражений.28 99 Повышенная экспрессия IFN-λ126 и IFNκ28 наблюдалась в коже пациентов с кожной СКВ, и было высказано предположение, что IFN типа I ингибирует ADAM17 в клетках Лангерганса, тем самым усиливая апоптоз кератиноцитов, индуцированный УФ-В. 100 101 Недавние исследования фазы I – II в СКВ, блокирующей передачу сигналов IFN через pDC, 53 IFNAR102 или путь JAK / STAT103 улучшили кожные проявления, а ингибирование JAK также улучшило кожные проявления у пациентов с интерферонопатиями.104 Таким образом, передача сигналов IFN, по-видимому, играет ключевую роль в патологии кожи даже при СКВ. хотя точное взаимодействие между различными IFN, кератиноцитами и pDC требует дальнейшего изучения.
Артрит
Синовиальная ткань пациентов с волчанкой и воспалительным артритом демонстрирует повышенную экспрессию IFN-индуцированных генов, 105 и недавние данные предполагают, что сигнатуры IFN, индуцированные IFN-β1 и IFN-α2, являются наиболее важными.106 Источник IFN в синовиальная оболочка не ясна, но было высказано предположение, что продуцирующий фибробласты IFN-β, богатый этой тканью, 106 107 Результаты исследования Anifrolumab, блокирующие IFNAR, показывают значительное улучшение состояния суставов у пациентов с волчанкой с изначально сильным Сигнатура IFN, указывающая на важную роль IFN в волчаночном артрите.102
Почки
Что касается нефрита с СКВ, исследования показали связь между сильной сигнатурой ИФН и нефритом2 21 в анамнезе и активным нефритом. 22 Биопсия почек у пациентов с СКВ показывает повышенную экспрессию IFN-индуцируемых генов 108–110 и pDC. накапливаются в клубочках пациентов с активным заболеванием.50 Более сильная сигнатура IFN наблюдается в клубочках и почечных канальцах у пациентов с наивной иммуносупрессивной СКВ с нефритом по сравнению с пациентами с СКВ-нефритом, получавшими иммуносупрессивное лечение.111 В ткани почек IFN-β может вызывать гибель клеток подоцитов и увеличивать проницаемость, тогда как IFN-α и IFN-β подавляют дифференцировку почечных клеток-предшественников в зрелые подоциты, 112 что приводит к потере подоцитов, протеинурии и нарушению репарации клубочков. Взятые вместе, эти наблюдения показывают, что IFN играет важную роль как в воспалительном процессе, так и в развитии повреждений при СКВ-нефрите.
Центральная нервная система
Повышенные уровни IFN типа I были продемонстрированы в спинномозговой жидкости пациентов с СКВ с нейропсихиатрическими проявлениями, 113 включая волчаночный психоз114, а также в центральной нервной системе (ЦНС) при вскрытии.114 Это интригует, учитывая наблюдаемые неблагоприятные нейропсихиатрические эффекты после лечения IFN-α.115 Местно продуцируемые аутоантитела спинномозговой жидкости у пациентов с волчанкой в ЦНС могут образовывать IC и стимулировать производство IFN-α pDC116, а IFN типа I стимулирует микроглию, чтобы она стала реактивной и поглотила нейроны. и синаптический материал у мышей, склонных к волчанке.117 Таким образом, возможно, что интерферогенные IC и IFN типа I могут иметь значение для нейропсихиатрических проявлений (NP), часто наблюдаемых при SLE, и NP-SLE может быть одним из проявлений заболевания, подходящим для Ингибирование IFN.
Нацеленность на систему IFN
После открытия сигнатуры IFN был разработан ряд различных стратегий для подавления регуляции системы IFN у пациентов с СКВ. До сих пор терапевтический эффект был скромным, и его трудно воспроизвести в более крупных исследованиях фазы III.118 Для этого есть несколько причин, но есть ряд факторов, которые необходимо учитывать перед выбором терапевтической мишени у пациента с СКВ. . Некоторые из них обсуждались выше, а некоторые кратко изложены в таблице 1.
Таблица 1Факторы, которые следует учитывать перед выбором терапевтической мишени у пациента с СКВ
В недавних клинических испытаниях пациенты стратифицировались по клиническим проявлениям, включая нефрит или кожные и суставные проявления. К сожалению, несколько испытаний потерпели неудачу, поэтому при отборе пациентов необходимо также учитывать молекулярные пути, активированные у одного пациента. В этом контексте важно отметить, что система IFN типа I может иметь наиболее важное значение на ранних этапах процесса заболевания2 18, 119, 120 и при возникновении обострений.20 На более позднем этапе развития болезни другие подтипы IFN могут играть более важную роль, по крайней мере, у некоторых пациентов.72 Следовательно, определение важности IFN и активации путей для отдельных пациентов будет необходимо. Этот анализ также включает множество путей, связанных с системой IFN. Были предприняты попытки уточнить сигнатуру IFN с помощью факторного анализа и путем связывания экспрессии ISG с подтипом IFN.23, 121 Другие применяли секвенирование одноклеточной РНК в биоптатах почек волчанки, идентифицируя высокую сигнатуру ответа IFN в канальцевых клетках как негативный прогностический маркер. волчаночного нефрита.122 Дальнейшие исследования того, как определенные клетки и типы клеток способствуют развитию болезни и органам, могут показать, как персонализировать лечение пациентов, а также на клеточном уровне.
Генетическое профилирование также поможет определить основной механизм заболевания у одиноких пациентов. Лица с редкой моногенной СКВ, включая пациентов с редкими вариантами генов, связанных с интерферонопатиями, 74 или с дефицитом генетического комплемента, могут получить пользу от индивидуального лечения.Как обсуждалось выше, пациенты с вариантами гена риска, связанными с передачей сигналов IFN-γ, включая STAT4 и IL12 , могут получить пользу от ингибирования этого пути. В будущем, возможно, будет важно учитывать совокупный генетический риск, определяемый шкалой генетического риска, при выборе терапии, поскольку это может предсказать исход болезни.
