Производство белковых кормовых дрожжей — Справочник химика 21
Попытки микробиологического получения белка предпринимались давно, а производство кормовых дрожжей широко практиковалось еще до второй мировой войны. Но в настоящее время промышленный микробиологический синтез белка переживает второе рождение, определяемое возросшим уровнем знаний и технических возможностей общества. В исследованиях по изысканию сырья для микробиологического производства белковых веществ прослеживаются две противоположные тенденции. [c.568]Ценным белковым кормом являются кормовые гидролизные и сульфидные дрожжи — биологически полноценный концентрат, хороший источник белка, витаминов и минеральных веществ. Кормовые дрожжи содержат 45—52% белка, 2—3% жира, 6—8% минеральных веществ, 25—35% углеводов и комплекс витаминов- В. В состав белка кормовых дрожжей входят все необходимые аминокислоты.
В настоящее время техническая микробиология изучает новые биохимические методы производства самых разнообразных химических продуктов. Уже сейчас осуществлены на практике микробиологические синтезы антибиотиков, витаминов, гормонов. Особенно важное значение имеет использование биохимических методов для синтеза пищевых продуктов, в частности белков (см. гл. I). Известно, что в мире ощущается недостаток белковых продуктов и одним из основных путей расширения пищевых ресурсов — реализация производства белков биохимическими методами с помощью микроорганизмов. В промышленности давно используется ряд биохимических процессов — биологический синтез белковых кормовых дрожжей, различные формы брожения с получением спиртов и кислот, биологическая очистка сточных вод и т. п.
Производство триптофана. Триптофан достаточно часто является лимитирующим фактором питания, так как его содержание в традиционных продуктах (рыба, молоко, кормовые дрожжи) в 3 раза ниже, чем в стандартном белке. [c.48]
[c.48]
Приведен краткий обзор методов количественного апределения белка в различных объектах. Фотометрический метод, базирующийся на реакции Лоури, является наиболее перспективным для анализа растворов. Предложен способ перевода белка в раствор из твердых биопрепаратов (кормовых дрожжей, премиксов, комбикормов и т. д.) с дальнейшим фотометрическим определением белка по реакции Лоури. В частности, предлагаемая методика может быть использована для контроля содержания белка в кормовых дрожжах. В сравнении с существующей на производстве методикой повышается достоверность результатов определений белка и в 4 раза сокращается продолжительность анализа. Табл. 1. Библ. 7 назв.
Целесообразно увеличить темпы производства кормовых гидролизных дрожжей, которые содержат 45—52% белка, 2—3% жира, 6—8 /о минеральных веществ, 25— 35% углеводов и комплекс витаминов В. В состав белка кормовых дрожжей входят все необходимые аминокисло-  310]
310]
В нашей стране имеются значительные запасы углеводородного сырья, использование которого в качестве источника углерода при промышленном производстве микробного кормового белка обладает рядом преимуществ, прежде всего, за счет его большей стабильности, транспортабельности и технологичности. Предприятия по производству микробного кормового белка размещаются вблизи нефтеперерабатывающих заводов. Это создает благоприятные условия для их ускоренного строительства и надежной эксплуатации. В качестве исходного сырья для производства кормовых дрожжей могут быть
Недостаток (даже небольшой) в среде азота приводит к ожирению клеток, т. е. повышению содержания в них липидов за счет уменьшения белковой и аминокислотной фракций. Поэтому изменение соотношения в питательной среде углерода и азота, а также замена восстановленных форм азота окисленными, более трудно усвояемыми микроорганизмами, могут привести к значительным нежелательным изменениям в составе биомассы микроорганизма. На производстве, особенно при получении полноценных, обогащенных белком кормовых дрожжей, постоянно следят за тем, чтобы в среде не было недостатка азота.
На производстве, особенно при получении полноценных, обогащенных белком кормовых дрожжей, постоянно следят за тем, чтобы в среде не было недостатка азота.
Ланные, полученные на пилотной установке, были положены в основу расчетов для создания относительно крупномасштабной заводской установки для ферментативного гидролиза целлюлозосодержащих отходов мощностью около 100 т моносахаридов в день (в настоящее время испытывается демонстрационная установка мощностью 25 т/день). Количество требуемого при этом исходного сырья составляет 280 т соломы, 170 т бумажной макулатуры в день. Ожидается, что подобная установка будет производить ежедневно 80 тыс. л этанола (26,4 млн л этанола в год) и 25 т дрожжевого белка. При стоимости исходного целлюлозного сырья 1100 австрийских шиллингов за 1 т ожидаемые затраты на производство этанола составляют 8 шиллингов за 1 л и кормовых дрожжей — 8 тыс. шиллингов за 1 т.
Масштабы действующих цехов гидратации этилена явно недостаточны для удовлетворения быстрорастущей потребности производства кормовых дрожжей.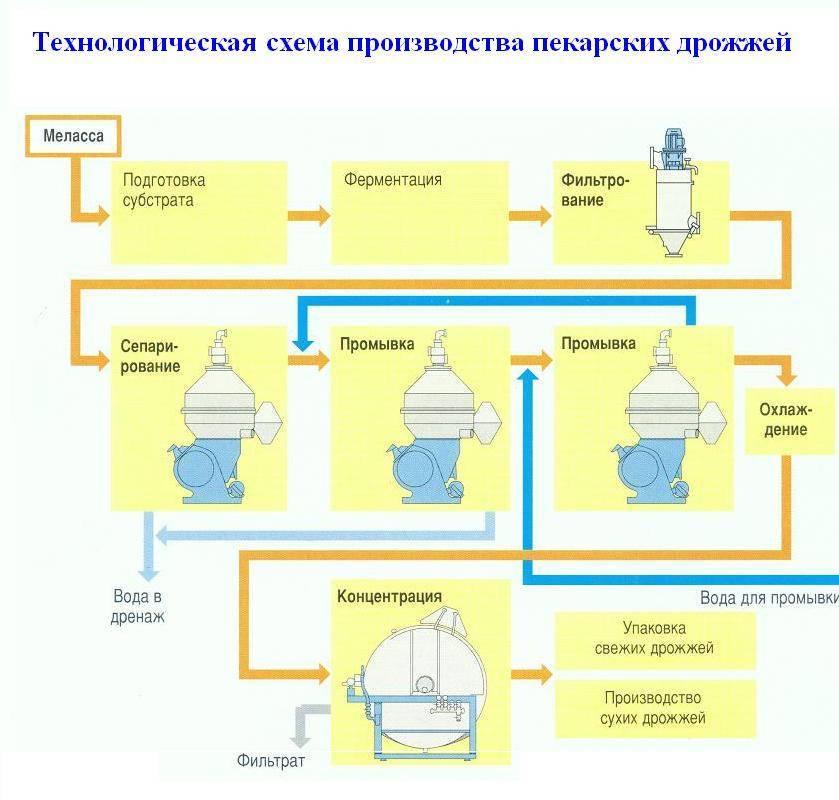 Доказано, что и коренная реконструкция этих морально и физически устаревших установок. для переориентации направления использования этанола неэффективна. Наиболее целесообразным признано создание крупномасштабных установок. Такие установки по производству синтетического этанола характеризуются технико-экономическими показателями, обеспечивающими их эффективность в производстве кормового белка. Реконструкция и техническое перевооружение действующих установок по производству этанола может стать эффективным мероприятием для перевода их в дальнейшем на выпуск не менее дефицитного растворителя — изопропанола прямой гидратацией пропилена.
Доказано, что и коренная реконструкция этих морально и физически устаревших установок. для переориентации направления использования этанола неэффективна. Наиболее целесообразным признано создание крупномасштабных установок. Такие установки по производству синтетического этанола характеризуются технико-экономическими показателями, обеспечивающими их эффективность в производстве кормового белка. Реконструкция и техническое перевооружение действующих установок по производству этанола может стать эффективным мероприятием для перевода их в дальнейшем на выпуск не менее дефицитного растворителя — изопропанола прямой гидратацией пропилена.
Неограниченные сырьевые источники для производства кормовых дрожжей (например, использования для нх выращивания парафинов нефти), их высокая продуктивность — за одни сутки 1 т (10 кг) дрожжей может дать до 100 т (10 кг) потомства, высокое содержание и качество белка в биомассе привлекают к этому методу самое пристальное внимание исследователей.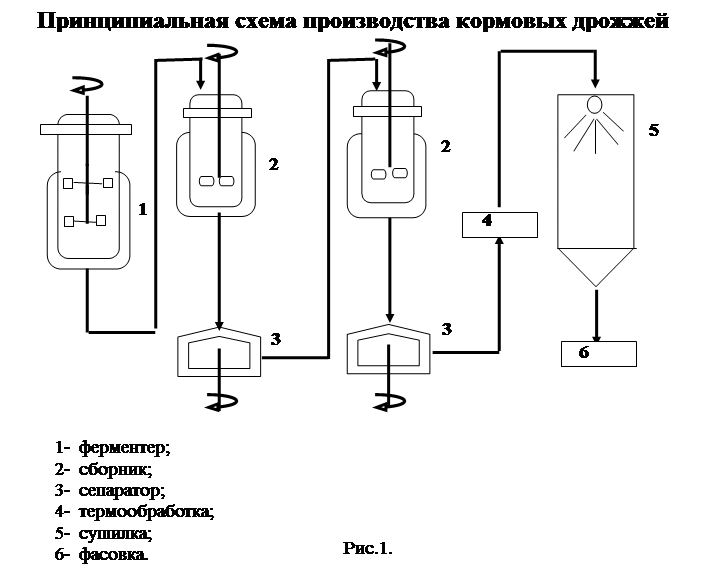
Очистка сахаросодержащих растворов (гидролизатов древесины) производство кормовых дрожжей получение фуражных концентратов, пищевого белка, аминокислот очистка продуктов гидролиза белков и др. [c.254]
В Молдавском научно-исследовательском институте почвоведения и агрохимии в качестве удобрений испытаны шламы производства кормовых дрожжей. Прибавка урожая зерна кукурузы возросла более чем вдвое, содержание белка в зерне увеличилось на 20% [58]. Положительные результаты получены при использовании сточных вод гидролизно-дрожжевого производства для полива кукурузных полей. Прибавка урожая зерна при расходе на полив 1200 м /га сточных вод составила 10 ц/га [59].
Для получения спирта (этанола) путем брожения используют отходы производства сахара (мелассу) или картофель. Большие количества дешевого спирта получают также из гидролизатов древесины лиственных пород или из сульфитных щелоков-отходов бумажных фабрик. В гидролизатах древесины сбраживаются до этанола только гексозы. Остающиеся после этого пентозы используют для выращивания кормовых дрожжей Endomy es la tis и видов Torula), для которых они служат источником углерода эти дрожжи, богатые белками, добавляют в корм скоту.
В гидролизатах древесины сбраживаются до этанола только гексозы. Остающиеся после этого пентозы используют для выращивания кормовых дрожжей Endomy es la tis и видов Torula), для которых они служат источником углерода эти дрожжи, богатые белками, добавляют в корм скоту.
В настоящее время из-за высоких затрат на сырье и энергию производство кормового белка не является рентабельным, поэтому в качестве субсфатов для биосинтеза кормовых дрожжей вновь рассматривается возобновляемое растительное сырье как источник углеводов. Кормовые белковые продукты могут быть получены методом глубинного гетерофазного культивирования дрожжей, а для выделения целевого продукта предлагается использовать фильтрацию. [c.177]
Исследования показали, что применение кормовых дрожжей для сбалансирования рационов по белку и в качестве витаминов позволяет уменьшить расход кормов на производство мяса, молока, яиц и намного увеличить выход этих продуктов. [c.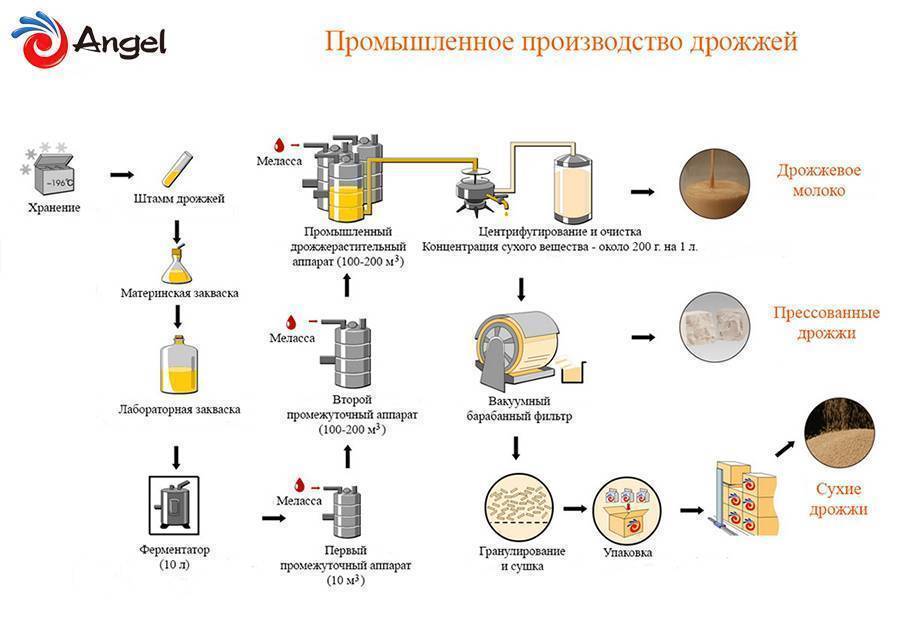
В производстве, гле главным. ТТРЛРНММ прпдук тп>т ап. ляются микробные липиды, микроорганизмы выращиваются при минимальном азотистом питании. В этом случае они накапливают значительные количества (до 20% от массы клетки) липидов, состав которых зависит от используемого источника углерода. В липидную фракцию входят фосфолипиды, стерины, свободные жирные кислоты, MOHO-, дп- и триглицериды, стериновые эфиры и воски. Липиды извлекают экстракцией, а оставшуюся биомассу используют как белковую добавку в корма животных, однако содержание белка в ней в 1,5—2,0 раза меньше, чем в обычных кормовых дрожжах.
В последние десятилетия усилился интерес к микроорганизмам как источнику кормового и пищевого белка. И это не случайно, так как по качеству белка, содержанию витаминов и микроэлементов кормовые дрожжи и некоторые другие микроорганизмы значительно превосходят традиционные растительные корма. Широкое применение кормовых продуктов микробиологического синтеза сократит расход ценных пищевых продуктов (молока, зерна) на нужды животноводства. Добавка продуктов микробиологического производства к обычно применяемым растительным кормам позволит сбалансировать их аминокислотный состав, что значительно повысит коэффициент полезного действия кормов. [c.3]
Широкое применение кормовых продуктов микробиологического синтеза сократит расход ценных пищевых продуктов (молока, зерна) на нужды животноводства. Добавка продуктов микробиологического производства к обычно применяемым растительным кормам позволит сбалансировать их аминокислотный состав, что значительно повысит коэффициент полезного действия кормов. [c.3]
Производство кормовых дрожжей на углеводородном сырье — более молодая отрасль микробиологической промышленности СССР. Наибольшее развитие получила в 70-е годы. В настоящее время действует несколько заводов мощностью от 70 до 240 тыс. т в год. Сырьем служат жидкие очищенные парафины, выделяемые из депа-)афинизата дизельного топлива (Быков и др., 1987). высокий выход биомассы (до 100% массы субстрата) обеспечивается большим содержанием углерода, качество продукта— степенью чистоты парафинов. Однако даже незначительное присутствие остаточного субстрата в дрожжах связано с большим риском их использования. Поэтому в настоящее время задача заключается в постепенном переводе производства кормового белка с углеводородов типа парафинов на метанол, метан, природный газ и отходы промышленности (Виестур и др.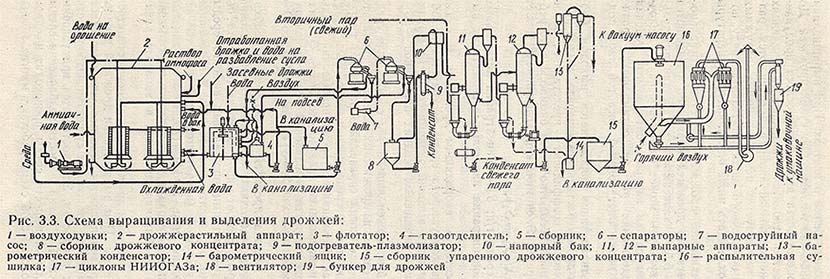 , 1985 Хри-стозова, 1986). [c.31]
, 1985 Хри-стозова, 1986). [c.31]
Эффективное развитие сельского хозяйства невозможно без повышения продуктивности животноводства, птицеводства и растениеводства, которые находятся в прямой зависимости от количества и качества кормов, удобрений, средств защиты растений. Биотехнология производства протеина направлена на создание биологически полноценных кормовых и пищевых продуктов микробного синтеза — естественных концентратов белка и витаминов. Биотехнологическое решение проблемы дефицита микробного белка в СССР в основном сводится к выращиванию кормовых дрожжей. Широкое использование этих микроорганизмов как продуцентов протеина обусловлено значительной скоростью роста, высоким содержанием белка, относительной простотой культивирования. Периодически отбираются более продуктивные штаммы, усиленно разрабатываются биотехнологические процессы, по-новому решающие традиционные задачи производства. В ряде случаев они оказываются не только более экономически эффективными, но и более экологически чистыми. [c.4]
[c.4]
Кормовые дрожжи используют при производстве комбикормов, а также в качестве добавки в корма сельскохозяйственным животным, птице, пушным зверям и рьбе. В состав белка дрожжей входят все жизненно необходимые аминокислоты. Белок дрожжей усваивается животным организмом полнее, чем белок растительного происхождения. По питательное кормовые дрожжи приравниваются к кормам животного происхождения, мясокостной и рыбной муке. По содержанию витаминов группы В кормовые дрожжи, полученные из зерно-картофельной барды, превосходят рыбную и мясокостную муку. На комбикормовых заводах сухие кормовые дрожжи используют как источник витаминов и полноценного белка. Для удовлетворения полной потребности животных в витаминах достаточно в рационы кормов вводить 3—5% сухих дрожжей. [c.237]
В зависимости от метода последующей переработки получаемые гемицеллюлозные гидролизаты отбираются отдельно или одновременно с продуктами гидролиза трудногидролизуемых полисахаридов. Так, длй производства этилового спирта, кормовых дрожжей все моносахариды, образующиеся из легко- и трудногидролизуемых полисахаридов, собираются вместе. Никакой предваретельной обработки растительного сырья не производится. Наоборот, при получении чистых пентозных гидролизатов для выделения кристаллической ксилозы и ее переработки в пятиатомный спирт ксилит растительное сырье, богатое пентозанами, вначале подвергается обработке горячей водой для удаления белков, дубильных веществ, пектинов и части минеральных веществ. Последние остатки растворимых катионов удаляются промыванием сырья теплой разбавленной серной кислотой. Эта обработка носит название облагораживания сырья. Только после этого производится пентозный гидролиз в условиях, исключающих одновременный гидролиз целлюлозы. Для этого используют большую разницу коэффициентов б для гемицеллюлоз и целлюлозы. Например, при получении пентозных гидролизатов из хлопковой шелухи водную обработку ведут 1—2 ч при 120° С, после чего остаток тщательно отмывают и подвергают кисловке 0,1 %-ной серной кислотой для удаления зольных элементов.
Так, длй производства этилового спирта, кормовых дрожжей все моносахариды, образующиеся из легко- и трудногидролизуемых полисахаридов, собираются вместе. Никакой предваретельной обработки растительного сырья не производится. Наоборот, при получении чистых пентозных гидролизатов для выделения кристаллической ксилозы и ее переработки в пятиатомный спирт ксилит растительное сырье, богатое пентозанами, вначале подвергается обработке горячей водой для удаления белков, дубильных веществ, пектинов и части минеральных веществ. Последние остатки растворимых катионов удаляются промыванием сырья теплой разбавленной серной кислотой. Эта обработка носит название облагораживания сырья. Только после этого производится пентозный гидролиз в условиях, исключающих одновременный гидролиз целлюлозы. Для этого используют большую разницу коэффициентов б для гемицеллюлоз и целлюлозы. Например, при получении пентозных гидролизатов из хлопковой шелухи водную обработку ведут 1—2 ч при 120° С, после чего остаток тщательно отмывают и подвергают кисловке 0,1 %-ной серной кислотой для удаления зольных элементов. Иногда эти обе обработки совмещают. Затем производится пентоз-ныи гидролиз 1—2 ч при 125° С с 0,57о-ной серной кислотой. [c.409]
Иногда эти обе обработки совмещают. Затем производится пентоз-ныи гидролиз 1—2 ч при 125° С с 0,57о-ной серной кислотой. [c.409]
Благодаря такому химическому составу кормовые дрожжи при добавлении к основному корму животных и птиц в количестве 1—6% к сухому веществу резко повышают продуктивность звероводческих совхозов, молочных ферм, евино- и птицеферм. При введении кормовых дрожжей в рацион уменьшается падеж птицы, поросят, телят, ускоряется их рост, повышается яйценоскость птиц, увеличиваются надои молока у коров, улучшается качество меха, выпускаемого зверосовхозами, и т. д. Во время мировых войн сухие дрожжи в различных странах из-за недостатка животного белка широко использовались для питания людей. Производство пищевых дрожжей на древесных гидролизатах было, например, организовано в Ленинграде во время его блокады в 1941 —1943 гг. [c.336]
Образование при производстве целлюлозы щелоков, содержащих нентозы, послужило новым стимулом к бо.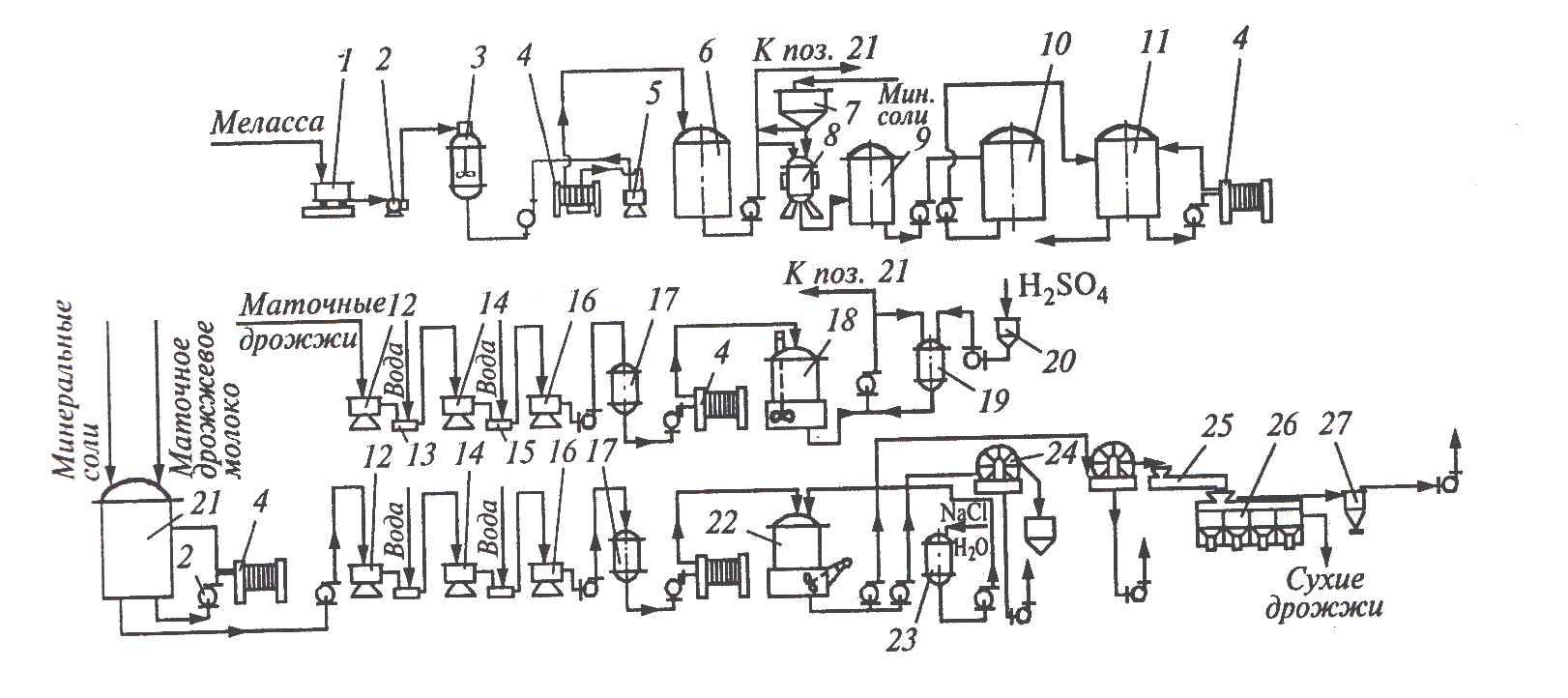 тее интенсивным исследованиям в области промышленных методов получения белков. Такое постоянно действующее производство крупного масштаба было впервые организовано на заводе в Вольфене. Сначала нентозы не находили применения, так как не удавалось культивировать кормовые дрожжи на содержащем пентозы субстрате. В те времена даже крупные ученые еще придерживались мнения, что дрожжи не способны перерабатывать пентозы. [c.342]
тее интенсивным исследованиям в области промышленных методов получения белков. Такое постоянно действующее производство крупного масштаба было впервые организовано на заводе в Вольфене. Сначала нентозы не находили применения, так как не удавалось культивировать кормовые дрожжи на содержащем пентозы субстрате. В те времена даже крупные ученые еще придерживались мнения, что дрожжи не способны перерабатывать пентозы. [c.342]
В условиях интенсивно развивающегося животноводства крайне важна задача создания сбалансированных кормов. Одним из альтернативных путей ее достижения является биотехнологическое производство клеточных белков, полноценных по набору незаменимых аминокислот. Производство кормового белка [синонимы БВК, кормовые дрожжи, в зарубежной литературе — белок одноклеточных (8СР) ] основано на культивировании четырех категорий микроорганизмов бактерий, грибов, дрожжей и микроводорослей, используюших в качестве субстрата источников питания углеводы отходов сельскохозяйственной продукции, целлюлозно-бумажного производства, углеводороды нефти, простейшие спирты, газы (СО2, метан) и др. В настоящее время производство кормовых дрожжей только в СССР превысило 1 млн.т/год и характеризуется тенденцией неуклонного роста в прёдстоящее десятилетие. [c.119]
В настоящее время производство кормовых дрожжей только в СССР превысило 1 млн.т/год и характеризуется тенденцией неуклонного роста в прёдстоящее десятилетие. [c.119]
Более рациональным использованием барды является использование ее в качестве сырья для выращивания кормовых дрожжей. Дрожжи выращивают на грубом фильтрате барды. После выращивания дрожжи выделяются на сепараторах, а фугат смешивается с дробиной от фильтрации барды и представляет так называемую вторичную барду, количество которой составляет 60—62% от исходной, и она является также хорошим кормовым средством. Состав сухого вещества вторичной барды (в % на сухое вещество) белки — 20, жир — 2—8, углеводы — 30—32, клетчатка — 30—31, зола — 9—10%. Так как температура вторичной барды 60—65°С, то целесообразно при передаче на откормочный пункт или бардораздаточную станцию ее подогревать, используя для этого отходящее тепло спиртового производства (горячая вода, лютерная вода и др.). [c.160]
Кормовые дрожжи. Дрожжи впервые стали использовать как источник белка для человека и животных в Германии во время первой мировой войны, когда была разработана промышленная технология культивирования пивных дрожжей (Sa haromy es erevisiae), предназначенных для добавления в продукты питания. В нашей стране первый завод по производству кормовых дрожжей был пущен в 1935 г. Дрожжи выращивали на гидролизатах из отходов древесины и другого целлюлозосодержащего растительного сырья, которые при гидролизе образуют легкоусвояемые для микроорганизмов формы углеводов. В настоящее время нашей биотехнологической промышленностью на основе гидролиза растительного сырья производится значительный объем кормовых дрожжей для сельского хозяйства. [c.261]
Дрожжи впервые стали использовать как источник белка для человека и животных в Германии во время первой мировой войны, когда была разработана промышленная технология культивирования пивных дрожжей (Sa haromy es erevisiae), предназначенных для добавления в продукты питания. В нашей стране первый завод по производству кормовых дрожжей был пущен в 1935 г. Дрожжи выращивали на гидролизатах из отходов древесины и другого целлюлозосодержащего растительного сырья, которые при гидролизе образуют легкоусвояемые для микроорганизмов формы углеводов. В настоящее время нашей биотехнологической промышленностью на основе гидролиза растительного сырья производится значительный объем кормовых дрожжей для сельского хозяйства. [c.261]
Для получения 1 т белка нужно засеять 4 га земельной площади бобовыми культурами (горохом), доводя срок вегетации д о трех месяцев. Столько же белка в виде говяжьего мяса могут дать 40 голов молодняка крупного рогатого скота за 15—18 месяцев откорма. В промышленных условиях 1 т белка в виде кормовых дрожжей может быть выращена за сутки в ферментере объемом 300 м (С. В. Чепиго). Вот почему при планировании кормовой базы и определении Мероприятий по увеличению производства протеина в конкретных хозяйствах и по зонам страны очень важно знать экономическую эффективность его производства за счет различных кормов и азотсодержащих веществ химического и микробиологического синтеза. [c.319]
В промышленных условиях 1 т белка в виде кормовых дрожжей может быть выращена за сутки в ферментере объемом 300 м (С. В. Чепиго). Вот почему при планировании кормовой базы и определении Мероприятий по увеличению производства протеина в конкретных хозяйствах и по зонам страны очень важно знать экономическую эффективность его производства за счет различных кормов и азотсодержащих веществ химического и микробиологического синтеза. [c.319]
М0Ж1Н0СТИ паподнеяия ресурсов кормового белка и оказания промышленностью действенной помош и сельскому шзяйспву в подъеме животноводства. Объем. производства кормовых дрожжей с каждым годом будет возрастать к 1970 г. их выпуск намечается довести до 2 млн. т, в том числе из углеводо родо з нефти — 1 млн. т. [c.152]
Организация производства БВК не предполагает замены или сокращения производства растительного и животаюго белка или кормовых дрожжей из растительных отходов, а является дополнительным источником получения белковых веществ для добавки в корма. [c.160]
[c.160]
Для повышения продуктивностн животных путем дачи полноценного корма, микробиологическая промышленность в настоящее время выпускает кормовые белки на базе различных микроорганизмов-бактерий, грибов, дрожжей, водорослей. Богатая белковая биомасса одноклеточных усваивается сельскохозяйственными животными. Так, 1 т кормовых дрожжей позволяет получить 0,4—0,6 т свинины, до 1,5 т мяса птиц, 25—30 тыс. яиц и сэкономить 5—7 т зерна. Это имеет большое народнохозяйственное значение, поскольку 30 % площадей сельскохозяйствен-н ых угодий в мире отводятся для производства корма скоту и птице. [c.252]
Для получения целевых продуктов многие отрасли промышленности используют растворы, содержаш,ие белки, аминокислоты, углеводы, жиры, витамины, неорганические соли и т. д. Это имеет место, напрпмер, при производстве лекарственных препаратов, пекарских и кормовых дрожжей, сахара. Присутствие этих веш,еств, а также некоторых других органических и неорганических соединений в растворе обусловливает его поверхностно-активные свойства, которые при соот-ветствуюш,их условиях (барботирование, перемешивание, нагревание) проявляются в интенсивном вспенивании. Так, одной пз причин обильного пенообразования сахарного сиропа является повышенное содержание в нем сапонина. Кроме того, пенообразованию сахарных сиропов способствуют такие вещества, как гуминовая кислота, бетаин и продукты распада белков — амины, амиды и аминокислоты. Стабильность пены продуктов бродильного производства, например, пива, солодовых напитков, определяется в основном наличием альбумина, желатины, солодового экстракта, таншша п др. Повышенное содержание азотистых веш,еств вызывает также обильное пенообразование плодово-ягодного варенья и экстрактов чайного листа. [c.197]
Так, одной пз причин обильного пенообразования сахарного сиропа является повышенное содержание в нем сапонина. Кроме того, пенообразованию сахарных сиропов способствуют такие вещества, как гуминовая кислота, бетаин и продукты распада белков — амины, амиды и аминокислоты. Стабильность пены продуктов бродильного производства, например, пива, солодовых напитков, определяется в основном наличием альбумина, желатины, солодового экстракта, таншша п др. Повышенное содержание азотистых веш,еств вызывает также обильное пенообразование плодово-ягодного варенья и экстрактов чайного листа. [c.197]
В 60-е годы внимание исследователей привлекала возможность использования углеводородов нефти как сырья для получения кормовых дрожжей. В мире добываются громадные количества нефти, которая в основном используется как топливо. Между тем еще начиная с 20-х годов советский ученый В. О. Таусон показал возможность выращивания различных микроорганизмов на компонентах нефти. В 60-х годах французский ученый Шампанья рекламировал получение богатых белком дрожжей на углеводородах нефти рекомендовал выращивать дрожжи на средах с дизельным топливом.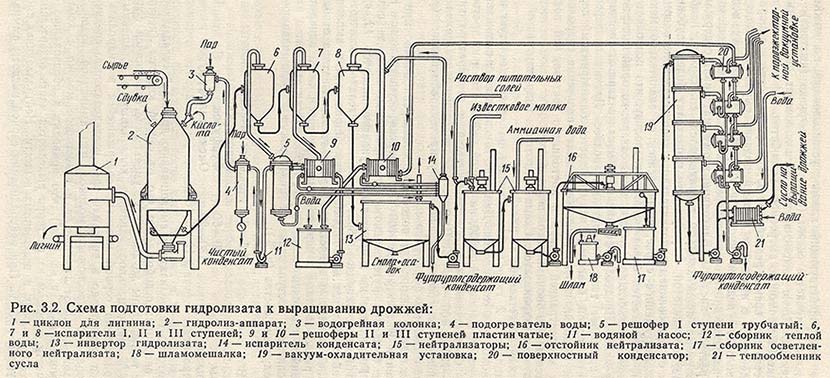 При этом дрожжи потребляли фракцию н-алканов, что позволяло получать низко застывающее дизельное топливо и биомассу. Одиако потребность в таком топливе сравнительно невелика, а очистка биомассы, полученной па дизельном топливе, оказалась весьма сложной и дорогостоящей. Тем не менее в ограниченном масштабе промышленное производство кормовых дрожжей на средах с дизельным топливом было организовано в ГДР. [c.549]
При этом дрожжи потребляли фракцию н-алканов, что позволяло получать низко застывающее дизельное топливо и биомассу. Одиако потребность в таком топливе сравнительно невелика, а очистка биомассы, полученной па дизельном топливе, оказалась весьма сложной и дорогостоящей. Тем не менее в ограниченном масштабе промышленное производство кормовых дрожжей на средах с дизельным топливом было организовано в ГДР. [c.549]
При всестороннем исследовании микробной биомассы была выявлена ее чрезвычайно высокая технологическая и экономическая эффективность для мясного и молочного животноводства, птицеводства и целого ряда других направлений народного хозяйства. Кормовые дрожжи содержат в 5 раз больше белка (в том числе лизина в 10, метиона в 5 и триптофана в 3 раза больше), чем ячмень или овес. Кроме того, в сухих дрожжах имеются практически все витамины группы В и целый ряд ростовых факторов. В результате этого 1 т кормовых дрожжей, добавленных в корма сельскохозяйственных животных, обеспечивает экономию до 7 т зерна и дополнительное производство 0,8 т свинины, 5 т мяса птицы или до 15 тыс. шт. яиц. Включение 1 т дрожжей в рацион телят и поросят высвобождает для питания населения 6 т цельного или 1,5 т сухого обезжиренного молока. [c.8]
шт. яиц. Включение 1 т дрожжей в рацион телят и поросят высвобождает для питания населения 6 т цельного или 1,5 т сухого обезжиренного молока. [c.8]
Дрожжи используются человеком в хозяйственной деятельности (хлебопечении, виноделии, пивоварении) с доисторических времен, особенно вид Sa har. erevisiae (пекарские дрожжи). В настоящее время помимо традиционных областей промышленности дрожжи рода andida нашли применение в микробиологическом синтезе белка (кормовой белок). В СССР создана промышленность по производству белка с помощью дрожжей из нормальных парафинов нефти и гидролизатов древесины и некоторых сельскохозяйственных отходов. Весьма перспективным сырьем для производства дрожжевой биомассы являются низшие спирты — этанол и метанол. [c.175]
Производство кормовых дрожжей — Справочник химика 21
Производство кормовых дрожжей от отходов древесины и сельского хозяйства (подсолнечной лузги, кукурузной кочерыжки, соломы др.
 ) методом гидролиза. [c.235]
) методом гидролиза. [c.235]Технологическая схема производства кормовых дрожжей [c.243]
Рассчитать производительность труда по гидролизно-дрожжевому заводу за отчетный год трудовым и ценностным методами, если объем производства за отчетный год составил 105 тыс. т. Трудоемкость производства кормовых дрожжей массой 1 т 25 чел.-ч, оптовая цена 1 т продукта 500 р., численность, занятых в производстве 1570 чел. [c.287]Основные и вспомогательные материалы для производства кормовых дрожжей [c.237]
Экономически выгодной является комплексная переработка древесины. В настоящее время самая низкая себестоимость производства кормовых дрожжей достигнута в целлюлозной промышленности, где из древесины получают различные продукты. Схема комплексной переработки приведена ниже. [c.117]
Для современного биохимического производства кормовых дрожжей из н-парафинов нефти мощностью 100 тыс. т биомассы в год общее количество выделяемого при биосинтезе тепла составит порядка 325.10 кДж/ч. Проблема использования этого тепла на сегодняшний день остается нерешенной. Сложность задачи заключается также в сравнительно низких рабочих температурах процесса биосинтеза (32—36°С),что приводит к значительным расходам охлаждающей воды в теплообменных устройствах. [c.31]
т биомассы в год общее количество выделяемого при биосинтезе тепла составит порядка 325.10 кДж/ч. Проблема использования этого тепла на сегодняшний день остается нерешенной. Сложность задачи заключается также в сравнительно низких рабочих температурах процесса биосинтеза (32—36°С),что приводит к значительным расходам охлаждающей воды в теплообменных устройствах. [c.31]
Производство кормовых дрожжей и фурфурола из древесины и сельскохозяйственных отходов методом гидролиза. [c.234]
КОНТРОЛЬ ПРОИЗВОДСТВА КОРМОВЫХ ДРОЖЖЕЙ [c.342]
В нашей стране этанол до 1934 г. получали исключительно из пищевого сырья. В 1934 г. было освоено производство гидролизного этанола и в 1935 г. построен первый гидролизный завод в Ленинграде. На основе работ по сернокислотной гидратации этилена в 1936 г. был пущен первый завод в Баку. После освоения метода прямой гидратации этилена в 1952 г. в Сумгаите, в период с 1953 по 1958 г. были введены в строй аналогичные заводы в Саратове, Уфе, Грозном и Самаре. В результате к 1960 г. доля синтетического этанола в общем объеме его производства достигла 25%. С 1964 г. в стране было полностью прекращено использование пищевого этанола для технических целей. В настоящее время перевод производства бутадиена с этанольного на углеводородное сырье высвобождает значительное количество синтетического этанола. Его предполагается использовать как сырье для экологически чистого производства кормовых дрожжей. В то же время, в связи с переориентацией гидролизных заводов также на производство кормовых дрожжей, производство гидролизного этанола прекращается. [c.273]
В результате к 1960 г. доля синтетического этанола в общем объеме его производства достигла 25%. С 1964 г. в стране было полностью прекращено использование пищевого этанола для технических целей. В настоящее время перевод производства бутадиена с этанольного на углеводородное сырье высвобождает значительное количество синтетического этанола. Его предполагается использовать как сырье для экологически чистого производства кормовых дрожжей. В то же время, в связи с переориентацией гидролизных заводов также на производство кормовых дрожжей, производство гидролизного этанола прекращается. [c.273]
ГО спирта. Установка для централизованной переработки ГФ (рис. 128) включает колонну для разгонки ГФ, эпюрационную, спиртовую и метанольную колонны. Последнюю предусматривают в том случае, когда перерабатывают ГФ, содержащую метанол. При переработке ГФ получают следующие продукты (в дал на 100 дал безводной части исходной ГФ) ректификованного спирта 90—94, эфиро-альдегидного концентрата 4—7 потери при разгонке 2—3, Выход ректификованного сппрта зависит от содержания примесей в исходной ГФ.
 Расход пара на переработку 1 дал ГФ составляет 60—70 кг, воды 0,6—0,7 м1 Концентрат ГФ служит углеродным питанием в производстве кормовых дрожжей. При фракционировании из него могут быть выделены ценные органические продукты уксусный альдегид, этилацетатный растворитель. [c.345]
Расход пара на переработку 1 дал ГФ составляет 60—70 кг, воды 0,6—0,7 м1 Концентрат ГФ служит углеродным питанием в производстве кормовых дрожжей. При фракционировании из него могут быть выделены ценные органические продукты уксусный альдегид, этилацетатный растворитель. [c.345]На спиртовых заводах работает 48 цехов по производству кормовых дрожжей, в том числе 19 —на зерно-картофельных заводах. Выход кормовых дрожжей составляет 2,5—3 кг на 1 дал спирта, выработанного из мелассы, 1,5 кг — из картофеля и 2,5—3,5 кг — из зерна. [c.369]
Количество отработавшей воды зависит от схемы производства спирта и хладагента, применяемого иа той нли другой технологической операции. В спиртовом производстве образуется больше отработавшей воды при охлаждении разваренной массы в осахаривателе, чем при вакуум-охлаждении. В производстве кормовых дрожжей образуется меньше отработавшей воды при охлаждении барды после-дрожжевым фугатом, чем прн охлаждении водой. [c.209]
[c.209]
Целесообразность аэробной стабилизации активного нла решает-отдельно в зависимости от мощности сооружений и наличия на оде цеха по производству кормовых дрожжей. Прн образовании ой биомассы избыточного активного ила около 10% от выработки шовых дрожжей ставится вопрос об экономической целесообраз- ти выработки кормовых дрожжей. [c.225]
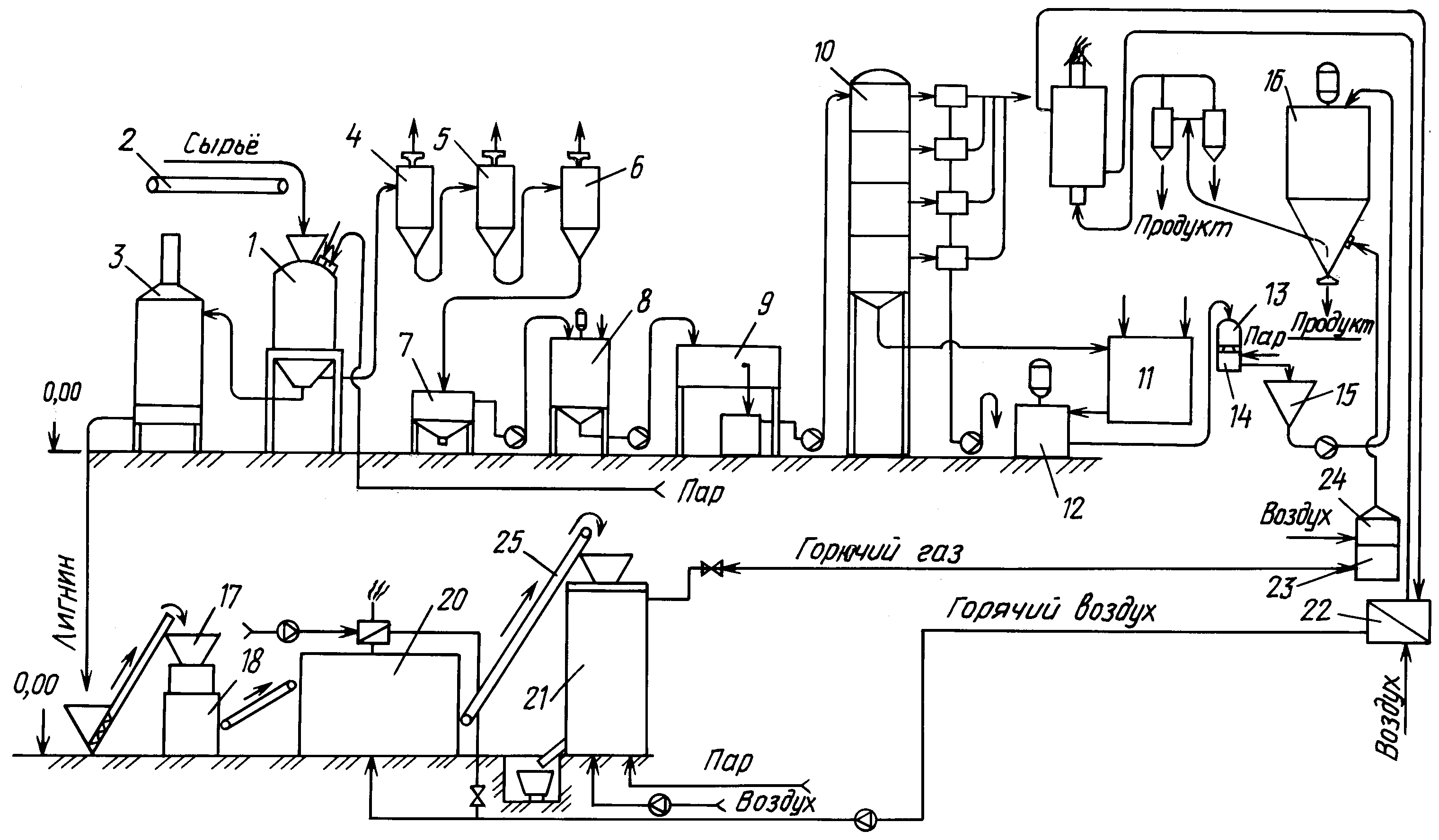
ПРОИЗВОДСТВО КОРМОВЫХ ДРОЖЖЕЙ Характеристика изготовляемой продукции [c.236]
Сырьем для производства кормовых дрожжей служит барда— отход спиртового производства при переработке крахмалсодержащего сырья на спирт. Состав ее приведен в главе I раздела П1. [c.237]
ПРОИЗВОДСТВО КОРМОВЫХ ДРОЖЖЕЙ [c.1]
Фугат с сепараторов собирается в сборник, из которого нас сом подается в теплообменник для охлаждения барды, а затем сборник вторичной барды. Возможным также является возврат ф гата в производство кормовых дрожжей либо в спиртовое пpo водство. [c.252]
[c.252]
Прн производстве кормовых дрожжей контролируют качество сырья и материалов, питательной среды и микробиологическое и биохимическое состояние дрожжей на различных стадиях технологии. [c.307]
Цехи по производству кормовых дрожжей 66,0 66,0 66,0 63,55 [c.214]
Цех по производству кормовых дрожжей [c.219]
Выбор сырья для производства кормовых дрожжей определяется способностью микроорганизмов эффективно накапливать белковую биомассу на углеводородах нефти, ресурсами и стоимостью сырья, а также техаико-экономв-ческими показателями переработки нефтяного сырья дяя получения качественного белкового продукта. [c.263]
Для удовлетворения потребности в зимних и арктических сортах дизельного топлива и особенно жидкого парафина для производства кормовых дрожжей широкое развитие получит процесс карбамидной депарафинизации. [c.28]
Упаренную барду применяют для улучшения питательных сред в производстве кормовых дрожжей на гидролизатах сельскохозяйственных отходов, для предотвращения образования статического электрического заряда на поверхности дрожжей при их высушивании, для производства удобрений. УкрНИИСП разработал и внедрил на Лужанском экспериментальном спиртовом заводе технологию гранулированных органо-минеральных чюбрений (ГОМУ). В настоящее время осуществляется строительство крупнотоннажного цеха ГОМУ (100 тыс. т в год) на Гайсинском спиртовом заводе Винницкой области. [c.386]
УкрНИИСП разработал и внедрил на Лужанском экспериментальном спиртовом заводе технологию гранулированных органо-минеральных чюбрений (ГОМУ). В настоящее время осуществляется строительство крупнотоннажного цеха ГОМУ (100 тыс. т в год) на Гайсинском спиртовом заводе Винницкой области. [c.386]
Х14Г14Н4Т 10Х14АГ15 — для изготовления деталей оборудования, работающего в средах слабой агрессивности (органических кислотах невысоких концентраций и умеренных температур), а также оборудования по производству кормовых дрожжей для кислородных компрессоров, установок газоразделения, работающих при температурах до 196 °С, а также как жаропрочные, применяющиеся при температуре до 700 °С. Сталь 10Х14АГ15 используется для изготовления деталей торгового оборудования, приборов бытового назначения (кроме режущих элементов, холодильников, стиральных машин), [c.65]
В процессе производства кормовых дрожжей образуются еле дующие количества промежуточных и конечных продуктов и сухоп вещества (в кг иа 1 т исходной натуральной барды с содержание сухих веществ 7,5%, по В. Б. Фремелю и А. П. Саввиной) [c.256]
Б. Фремелю и А. П. Саввиной) [c.256]
Для применения в производстве целлюлозы и бумаги сырье должно содержать достаточно много целлюлозы, а ее волокна обладать хорошими бумагообразующими свойствами. Сырье для гидролизных производств должно давать высокий выход сахаров при кислотном гидролизе, причем, в зависимости от принадлежности к растениям голосеменным (хвойные древесные породы) или покрытосеменным (лиственные древесные породы и сельскохозяйственные культуры, отходы которых утилизируются), оно может использоваться в разных производствах. Так, древесину лиственных пород, а также сельскохозяйственные отходы, как пентозансодержащее сырье применяют в производстве фурфурола и ксилита, тогда как древесина хвойных пород, дающая при гидролизе высокий выход сбраживаемых сахаров — гексоз, может бьггь использована для производства этанола и углекислоты. И те и другие древесные породы используют в производстве кормовых дрожжей. В лесохимии разные производства требуют вполне определенного сырья. В канифольно-скипидарном производстве используются высокосмолистые хвойные породы. При пиролизе древесины ценным сырьем для производства активного угля служит древесина твердолиственных пород. Кроме того, больший выход уксусной кислоты достигается также из древесины лиственных пород, включающих в свой состав по сравнению с древесиной хвойных пород больше ацетилсодержащих гемицеллюлоз (ацетилированных ксиланов). [c.223]
В канифольно-скипидарном производстве используются высокосмолистые хвойные породы. При пиролизе древесины ценным сырьем для производства активного угля служит древесина твердолиственных пород. Кроме того, больший выход уксусной кислоты достигается также из древесины лиственных пород, включающих в свой состав по сравнению с древесиной хвойных пород больше ацетилсодержащих гемицеллюлоз (ацетилированных ксиланов). [c.223]
Налаже1го также производство кормовых дрожжей из технологической щепы и опилок. Питательной средой для их выращивания служат нейтрализованные гидролизат или барда. Полученную дрожжевую суспензию сгущают, обезвоживают и высушивают. [c.309]
Биотехнология производства кормовых дрожжей
МИНОБРНАУКИ РФ
Государственное образовательное учреждение высшего профессионального образования
«Самарский государственный
Факультет пищевых производств
Кафедра «Технология пищевых производств и парфюмерно-косметических продуктов»
КУРСОВАЯ РАБОТА
по дисциплине «Пищевая биотехнология»______________
на тему ___ «Биотехнология производства кормовых дрожжей»___ _ __
Принял к исполнению
Студент IV – ФПП — 3
Забабурин В. В. _
В. _
__________________________
« »
2012г.
Самара 2012
СОДЕРЖАНИЕ
Введение | 3 |
1.Обзор литературы | 4 |
1.1 Сырье для производства | 4 |
1.2 Виды культур микроорганизмов, используемых для производства кормового белка | 6 |
1. | 7 |
1.4 Приготовление растворов солей и кислот | 9 |
1.5 Способы выращивания кормовых дрожжей | 9 |
2.Технологическая часть | 13 |
2.1 Сырье для культивирования кормовых дрожжей | 13 |
2.2 Характеристика культивируемых микроорганизмов, используемых для производства кормового белка | 14 |
2.3 Технологическая схема | 15 |
Заключение | 17 |
Список используемых источников | 18 |
Приложение1. Технологическая схема получения жидких кормовых дрожжей | 19 |
ВВЕДЕНИЕ
В настоящее время проблемы комплексного
научного обеспечения кормопроизводства
как многофункциональной  По данным ряда специалистов
мировой дефицит белка кормов к началу
XXI века оценивался в 30-35 млн. т. в год.
По данным ряда специалистов
мировой дефицит белка кормов к началу
XXI века оценивался в 30-35 млн. т. в год.
Применяемые в
настоящее время в хозяйствах
методы кормления животных не всегда
позволяют в полной мере сбалансировать
рационы по важнейшим показателям: энергии,
протеину, минералам и витаминам, вследствие
чего, генетически заложенный потенциал
продуктивности животных используется
только на 50-60 %. За последнее десятилетие
наполнение российского рынка мясными
продуктами на 40-60 % зависит от поставки
его из-за рубежа, что грозит продовольственной
безопасности страны, поэтому в Минсельхозе принята
концепция по развитию животноводства
в России, где предусматривалось увеличение
к 2010 году производство говядины, свинины,
мяса птицы в два раза. Решение поставленных
задач по развитию животноводства предполагало
значительное расширение производства
кормов, повышение их качества, применения
новых технологий и создание на этой основе
крупнотоннажных производств.
Кроме недостаточного объема производства кормов неблагоприятным фактором в животноводстве является низкое качество кормов, в первую очередь, его несбалансированность и недостаток белка, эти проблемы имеют всеобщее значение. Большинство кормов, используемых в животноводстве, не содержат в достаточном количестве белков и витаминов. Даже такие ценные корма, как кукуруза и сахарная свекла, дающие максимальное количество кормовых единиц с гектара, богаты углеводами, но не содержат достаточного количества азотистых веществ. В связи с чем, во всех странах отмечается большой дефицит кормового белка. Этот дефицит покрывается увеличением производства растительного протеина, содержащегося в сельскохозяйственных кормовых культурах: зерне, люцерне, выпуском рыбной и мясной муки, сухих молочных продуктов [1].
1. ОБЗОР ЛИТЕРАТУРЫ
Кормовые дрожжи
– дрожжи, специально выращиваемые для
корма сельскохозяйственных животных,
являющиеся ценным белково-витаминным
источником.
Кормовые дрожжи содержат примерно 50 % сырого протеина, включающего почти все незаменимые и частично незаменимые для животных аминокислоты. Общая питательная ценность 1 кг сухих кормовых дрожжей составляет 1,03 – 1,16 к.е. Так же, кормовые дрожжи являются источником витаминов группы В, жиров, провитамина D2 (эргостерин), минеральных веществ, разнообразных ферментов, гормонов, способствующих усвоению белков и углеводов. Кормовые дрожжи используют в качестве белково-витаминной добавки к рациону. При скармливании ускоряется развитие животных, повышается их продуктивность [2].
1.1 Сырье для производства кормовых дрожжей
В зависимости от вида культивируемых организмов, среды выращивания кормовых дрожжи подразделяют на следующие разновидности:
- Гидролизные. Для культивирования дрожжей используют
гидролизаты отходов: древесных (опилки,
стружка, цепа) и сельскохозяйственных
(солома, мякина, лузга подсолнечника,
кочерыжка кукурузы).
 А так же могут применяться
отходы целлюлозно-бумажного производства;
А так же могут применяться
отходы целлюлозно-бумажного производства; - Классические. Выращивание дрожжей на барде, получаемой как отход спиртового производства;
- Нерастительные (нефтепродукты и газопродукты). В качестве сырья используются нефтяные парафины; низшие спирты – метанол и этанол; природный газ [3].
При накоплении биомассы дрожжей источниками
углерода могут служить: глюкоза,
ксилоза, мальтоза, сахароза, манноза,
арабиноза, а также уксусная кислота, этиловый
спирт и другие органические вещества.
Некоторое количество углеводов содержится
в отходах пищевой промышленности, которые
можно использовать для выращивания дрожжей.
К таким отходам следует отнести спиртовую
барду заводов производства этилового
спирта биохимическим способом из мелассы,
зерна и картофеля, соковые воды крахмальных
заводов, отбросный щелок, получаемый
при известковой сепарации меласса, отходы
некоторых других пищевых производств.
Количество дрожжей, которое можно получить
на этих заводах, определяется количеством
отходов.
Для выработки кормовых дрожжей используются также и отходы целлюлозно-бумажной промышленности: спиртовая барда, предгидролизаты и щелока. Например, некоторые виды сульфитного щелока нецелесообразно перерабатывать на этиловый спирт ввиду незначительного содержания в них гексоз. Большое количество дрожжей может быть получено при использовании растительных источников сырья: отходы древесины хвойных и лиственных пород и сельского хозяйства (подсолнечная лузга, кукурузная кочерыжка, рисовая шелуха и т.д.).
Культивировать кормовые дрожжи возможно
и на парафинах. Парафины представляют
собой смесь твердых углеводородов метанового
ряда преимущественно нормального строения
с 18 – 35 атомами углерода в молекуле и температурой
плавления 45 – 65 °С. В парафинах обычно
содержится некоторое количество изопарафиновых
углеводородов, а также углеводородов
с ароматическим или нафтеновым ядром
в молекуле. Парафины инертны к большинству
химических реагентов. Они окисляются
азотной кислотой, кислородом воздуха
(при 140 °С) и некоторыми другими окислителями
с образованием различных жирных кислот,
аналогичных жирным кислотам, содержащимся
в жирах растительного и животного происхождения. Синтетические жирные кислоты, получаемые
окислением парафина, применяют вместо
жиров растительного и животного происхождения
в парфюмерной промышленности, при производстве
смазок, моющих средств и других продуктов.
Синтетические жирные кислоты, получаемые
окислением парафина, применяют вместо
жиров растительного и животного происхождения
в парфюмерной промышленности, при производстве
смазок, моющих средств и других продуктов.
Технология получения белков из нефтепродуктов пригодна и для производства из низших спиртов – метанола и этанола. В отличие от углеводородов, спирты полностью смешиваются с водой, что облегчает приготовление сред и снижает расходы на перемешивание [4].
В настоящее время отказались
от получения кормового белка на нефтепродуктах
и природном газе, так как это сырье постоянно
дорожает, и использовать его становится
все более нерентабельно. Помимо этого,
кормовой белок, произведенный на нерастительном
сырье, кроме спиртов, не так безопасен,
как белок, произведенный на растительных
средах и спиртах. Обуславливается это
тем, что в кормовых дрожжах, культивированных
на парафинах, накапливаются нефтяные
фракции, которые вызывают патогенные
изменения у животных, особенно влияя
на печень.
1.2 Виды культур микроорганизмов, используемых для производства кормового белка
В производстве кормовых дрожжей используются разнообразные виды дрожжей. Это обусловлено: во-первых, питательной средой, используемой на производстве; во-вторых, качественным и количественным составом продукта культивирования; в-третьих, условиями и методами культивирования [5].
Виды применяемых микроорганизмов:
- Candida guilliermondii
- Candida scottii
- Candida tropicalis
- Candida utilis
- Monilia munmanica
- Saccharomyces cerevisiae 1026
- Saccharomycetales Kudrjanzev
- Torula utilis
- Trichosporon cutaneum
Дрожжи рода Candida относятся к подсемейству Candidoideae семейства Cryptococcaceae. Выделено 186 видов рода Candida. C. stellata может быть частью чайного
гриба. C. kefyr / Kluyveromyces marxianus, C. firmetaria / Pichia fermentans, C. lipolytica / Yarrowia lipolytica, C. krusei / Issatchenkia orientalis и некоторые другие могут
содержатся в обычном кефире. C. albicans, C. pseudotropicalis, C. tropicalis, C. krusei, C. parapsilosis, C.
quillermondii, C. glabrata, C. lusitaniae и некоторые
другие могут вызвать заболевания. Candida albicans (Robin) Ber Khout (синонимы: Monilia albicans, Oidium albicans, Candida claussenii, Candida langezoni) —
условно-патогенный гриб.
lipolytica / Yarrowia lipolytica, C. krusei / Issatchenkia orientalis и некоторые другие могут
содержатся в обычном кефире. C. albicans, C. pseudotropicalis, C. tropicalis, C. krusei, C. parapsilosis, C.
quillermondii, C. glabrata, C. lusitaniae и некоторые
другие могут вызвать заболевания. Candida albicans (Robin) Ber Khout (синонимы: Monilia albicans, Oidium albicans, Candida claussenii, Candida langezoni) —
условно-патогенный гриб.
Некоторые виды рода гриба Monilia в зависимости от условий развития, возраста и культуры образуют либо почкующийся мицелий, либо происходит почкование округлых дрожжеподобных клеток. Например, Monilia murmanica хорошо развивается в сахаристых растворах. Другие виды Monilia имеют хорошо выраженный многоклеточный мицелий и размножаются конидиями. Представитель этого вида, например Monilia fructigena, вызывает порчу яблок и груш — плодовую гниль [14].
Saccharomyces cerevisiae 1026 – эта
разновидность пивных дрожжей, послужила
для создания кормового препарата И –
Сак 1026, единственной дрожжевой культуры,
рекомендованной ЕС для использования
в рационах молочного, мясного скота и
телят. Помимо дрожжей для получения белка
используют и другие микроорганизмы –
дрожжеподобные грибы и бактерии [5].
Помимо дрожжей для получения белка
используют и другие микроорганизмы –
дрожжеподобные грибы и бактерии [5].
Дрожжи вида Torula выращиваются на древесной массе, используемой в производстве бумаги, или на черной патоке, то есть мелассе. Применяются Torula utilis и Torula ellipsoidea, которые потребляют пентозы, оставшиеся при производстве спирта.
Дрожжи Trichosporon cutaneum
1.3 Питательные среды, их приготовление
Сырьем для
производства кормовых дрожжей служит
спиртовая барда. Питательную среду из
барды получают смешиванием ее с растворами
солей, содержащих азот и фосфор. Эта операция
производится в чанах-смесителях. В смеситель
непрерывно поступает барда и растворы
солей, а полученная питательная среда
непрерывно откачивается в дрожжерастильные
чаны. Солевые растворы, прибавляемые
к барде, дозируются мерниками-дозаторами,
исходя из потребностей штамма микроорганизма
и изначального химического состава барды.
Солевые растворы, прибавляемые
к барде, дозируются мерниками-дозаторами,
исходя из потребностей штамма микроорганизма
и изначального химического состава барды.
Зернокартофельную барду чаще используют как корм для животных в натуральном или высушенном состоянии, но ее питательная ценность возрастает, если на ней выращивают кормовые дрожжи. Химический состав барды зависит от вида и качества исходного сырья и принятой технологии спирта.
Меласса непосредственно
на корм животных непригодна, так как в
ней содержится большое количество минеральных
веществ. Мелассу используют в различных
направлениях: как основное сырье для
выращивания кормовых дрожжей, для получения
органоминеральных удобрений, кормового
концентрата витамина В, для выделения
глицерина, глютаминовой кислоты, глютамината
натрия, бетаина или солянокислого бетаина
(ацидина), холинхлорида и других ценных
веществ. Меласса содержит 7,5-10 % сухих
веществ, в том числе неорганических соединений
около 3 %. Дрожжами усваиваются редуцирующие
сахара (0,2-0,5 %), глицерин (0,6-0,9 %). органические
кислоты (1,5-2,5 %), аминокислоты, спирты,
глюкозиды, органические и неорганические
азотсодержащие соединения, соли фосфора,
калия, магния, железа, витамины и микроэлементы.
Многие из аминокислот барды (аргинин,
валин, глицин, лейцин, изолейцин, глютаминовая
и аспарагиновая аминокислоты) усваиваются
дрожжами.
Дрожжами усваиваются редуцирующие
сахара (0,2-0,5 %), глицерин (0,6-0,9 %). органические
кислоты (1,5-2,5 %), аминокислоты, спирты,
глюкозиды, органические и неорганические
азотсодержащие соединения, соли фосфора,
калия, магния, железа, витамины и микроэлементы.
Многие из аминокислот барды (аргинин,
валин, глицин, лейцин, изолейцин, глютаминовая
и аспарагиновая аминокислоты) усваиваются
дрожжами.
Способ производства кормовых дрожжей из торфа
Изобретение относится к способам производства кормовых дрожжей из гидролизатов, получаемых при переработке растительного сырья. Известен способ получения белковых кормовых дрожжей из растительного сырья (патент №2064275, 1996 г.), включающий гидролиз последнего с добавкой отхода производства дрожжей, обработку сырья при нагревании серной кислотой, инверсию сахаров, нейтрализацию гидролизатов, добавку питательных солей, выращивание дрожжей, утилизацию отходов, при этом в качестве отхода производства дрожжей используют активный ил, полученный из технологических сточных вод дрожжевого производства, который дополнительно вводят перед выращиванием дрожжей в количестве до 50% от общего количества питательных солей, а утилизацию дрожжевой бражки производят путем ее переработки в активный ил и технически чистую воду.
Способ предусматривает подачу сырья и суспензию активного ила с добавкой серной кислоты. Затем смесь направляют в гидролизаппарат и проводят двухстадийный гидролиз по обычной схеме с подачей пара. После удаления лигнина и летучих соединений, содержащих фурфурол, проводят нейтрализацию гидролизата 25% аммиачной водой до рН 4,2-4,4 и добавляют питательные соли. Очищенный от шлама и охлажденный гидролизат направляют в аэратор, а из него после осветления и отстоя — в дрожжевое отделение в ферментер. В ферментере в гидролизат вносят засевные дрожжи и активный ил для обогащения дрожжевой массы белком, витаминами и минеральными солями, азотом, фосфором, пропускают воздух и проводят выращивание дрожжей. После окончания процесса сусло сепарируют, дрожжи обезвоживают и сушат. Полученную последрожжевую бражку направляют на очистку и получение активного ила на очистную станцию «Симбиотенк». После двухстадийной раздельной очистки в «Симбиотенке« вода высокой степени чистоты вновь возвращается в производство, а полученный активный ил используется для добавки в исходное сырье и ферментеры.
Недостатком данного способа является проведение гидролиза с помощью серной кислоты (как катализатора процесса), требующей последующую нейтрализацию полученного гидролизата азотной кислотой, использование гидролизаппаратов. Применение кислотного гидролиза в гидролизаппаратах, с последующей нейтрализацией гидролизата требует больших объемов оборотной воды при использовании гидролизаппаратов в технологическом процессе.
Эти недостатки позволяет устранить предлагаемый способ производства кормовых дрожжей из торфа. Малоразложившийся торф влажностью 60% из бункера направляется в экструдер, имеющий зоны прогрева и гидролиза. Температура в зоне прогрева 100°С, а в зоне гидролиза 210°С, давление 2,5 МПА. В зону гидролиза подают отход производства активный ил. Активный ил по химическому составу является ценным органическим сырьем, содержащим обычно 30-50% сырого протеина. Качественный состав аминокислот белка активного ила сходен с аминокислотным составом белка дрожжей. В условиях ферментации образующиеся аминокислоты не только являются дополнительным органическим питанием для дрожжей, но также способствуют повышению скорости и глубины ассимиляции моносахаридов и других питательных веществ гидролизных сред (Холькин В.И. Технология гидролизных производств, М. Лесная промышленность,1989 г стр. 475). Прогрев торфа и активного ила проводится острым паром. Процесс высокотемпературного гидролиза происходит автокаталитическим способом под воздействием образующихся органических кислот торфа в результате сдвиговых деформаций при механическом воздействии экструдирования.
Сжатие сырья и увеличение скорости движения приводят к уменьшению времени распада и как следствие — к увеличению выхода сахара от веса сухого сырья, увеличивая концентрацию сахара в гидролизаппарате. (Шарков В.И. Гидролиз осахаривания, 1945 г. Стр. 271). Скорость гидролиза целлюлозы торфа и полисахаридов совпадают, что способствует при таком режиме увеличению выхода моносахаридов и обогащает гидролизат неорганическими микро- и макроэлементами.
Полученная после гидролиза реакционная смесь выводится из экструдера на отжим, отжатый остаток влажностью 40% поступает на производство органо-минерального удобрения. Отделенный отжим поступает на отстаивание и очищение от шлама, затем добавляют питательные соли и направляют на охлаждение в отстойник. Затем очищенный и охлажденный гидролизат поступает в дрожжевое отделение на ферментацию. После ферментации полученную дрожжевую суспензию сепарируют, обезвоживают и сушат до получения 10% влажности. Полученную последрожжевую бражку пропускают через биоокислитель, откуда полученную биомассу (активный ил) направляются на гидролиз торфа, а отделенная последрожжевая бражка поступает вместе с производственными сточными водами на очистную станцию «Симбиотенк», где после очистки технически чистая вода возвращается в производство, а полученный активный ил идет на получение органо-минерального удобрения вместе с гидролизованным лигнином и шламовыми отходами. Применение системы очистки технологических сточных вод гидролизного производства на очистной станции «Симбиотенк» решает проблему предотвращения загрязнения окружающей среды, позволяя осуществлять безотходную бессточную экологически безопасную технологию производства кормовых дрожжей с утилизацией отходов производства (гидролизованный отжатый торф, шламовые отходы, активный ил) для получения высококачественного органо-минерального удобрения (ОМУ). Торф, используемый для производства кормовых дрожжей, имеющий степень разложения 15-20% содержит в своем составе 60-80% гидролизуемых веществ, в том числе 45-65% редуцирующих веществ (РВ). В составе легкогидролизуемых РВ установлено до 40-80%, а в трудногидролизуемых — до 60-80% моносахаридов. Кроме моносахаридов, в составе РВ торфов обнаружено до 17% уроновых кислот, которые хорошо усваиваются кормовыми дрожжами. В составе торфа идентифицировано 17 аминокислот, в том числе такие кислоты, как аланин, тирозин, пролин, аспарагиновая и глютаминовая кислоты, фенилаланин являются веществами высокой биологической активности и играют большую роль в ускорении процесса роста дрожжей находясь в гидролизатах торфов. Также наряду РВ и аминокислотами источником питания являются органические кислоты, содержание которых в торфе составляет от 4,5 до 15%, а янтарная кислота, присутствующая в значительных количествах, обладает высокой биологической активностью. В торфах различного происхождения также содержатся витамины В1, В2, В3. Входящие в состав гидролизатов торфов органические кислоты, аминокислоты, витамины увеличивают выход биомассы дрожжей до 65,5% от РВ, стимулируя их рост. А добавка в процесс гидролиза активного ила совместно с торфом поднимает выход дрожжей от РВ до 70%.
В основе технологии гидролизного производства кормовых дрожжей предложенным способом гидролиза торфа лежат особенности химического и биологического состава малоразложившегося торфа как сырья, влияющего на биохимические процессы переработки полисахаридов под воздействием высокой температуры и сдвиговых деформаций при экструдировании в парофазном состоянии с активным илом.
Предлагаемое гидролизное производство кормовых дрожжей на базе торфодобывающих предприятий является высокорентабельным, которое позволит решить проблему снабжения высококачественным экологически чистыми продуктами питания населения по более низким ценам, обеспечит решение продовольственной программы страны, и тем самым окажет положительное влияние на экономику страны.
Способ производства кормовых дрожжей из растительного сырья, включающий гидролиз сырья с добавкой отхода производства дрожжей — активного ила, очищение полученного гидролизата от шлама, добавление питательных солей, охлаждение и отстаивание гидролизата, его ферментацию культурой дрожжей, сепарацию полученной дрожжевой суспензии с отделением дрожжей, их обезвоживание и сушку, полученную последрожжевую бражку пропускают через биоокислитель с отделением активного ила, который используют при гидролизе исходного растительного сырья, отличающийся тем, что в качестве растительного сырья используют торф со степенью разложения 15-20%, гидролиз растительного сырья осуществляют в экструдере в два этапа: в зоне прогрева при температуре 100°С, а затем в зоне гидролиза с добавлением отхода производства — активного ила при температуре 210°С и давлении 2,5 МПа, полученную в результате гидролиза смесь направляют на отжим, при этом отжатый остаток используют для получения органо-минерального удобрения, а отделенный отжим отстаивают, отделяют от шлама, добавляют в него питательные соли, охлаждают в отстойнике и ферментируют культурой дрожжей.Гидролизный завод-производство спирта этилового, дезинфицирующих и спиртосодержащих растворов, двуокись углерода, биотопливо,лекарственные средства
Дрожжи кормовые, ГОСТ 20083-74.
Код ТН ВЭД 21 02 20 1900. Объем производства: 70 тонн в месяц.
Дрожжи кормовые используются при производстве комбикормов, а также в качестве добавки в кормовые рационы сельскохозяйственных животных, птиц и пушных зверей.
Качественные характеристики кормовых дрожжей:
— массовая доля белка по Барнштейну(в пересчете на абсолютно сухое вещество высшей категории), составляет не менее 32 – 38 %;
— золы не более 10 %;
— массовая доля влаги, не более 10 %;
— наличие живых клеток продуцента не допускается;
— токсичности не допускается;
— общая бактериальная обсемененность, тысяч клеток в 1г дрожжей, не более 150;
— порошок коричневого цвета;
— экологически чистый продукт.
Упаковка: 3-х слойные бумажные мешки (с клапанами) по 20 кг. Хранить в хорошо проветриваемом помещении, защищенном от прямых солнечных лучей и атмосферных осадков.
Срок хранения кормовых дрожжей: шесть месяцев со дня изготовления
Дрожжи кормовые вырабатываются из технически чистых культур дрожжей, выращенных на мелассных-зерновых субстратах. Согласно многократным исследованиям и испытаниям, произведенным Центральной лабораторией комбикормовой промышленности Министерства сельского хозяйства и продовольствия Республики Беларусь установлено, что дрожжи кормовые содержат витамины группы «В» и в этом отношении превосходят все белковые корма, в том числе и рыбную муку.
Естественное сочетание в дрожжах полноценных белков и витаминов группы «В» оказывается очень важным в питании животных и птиц. Витамины группы «В» тесно связаны с белковым обменом в организме животных и являются компонентами ферментных систем, активными катализаторами, необходимыми для усвоения аминокислот и синтеза белка.
В сухом веществе дрожжей содержатся следующие аминокислоты: лизин – 31,5 г/кг, гистидин – 12,4 г/кг, аргинин – 25,6 г/кг, треонин – 19,3 г/кг, аланин – 25,8 г/кг, валин – 26,7г/кг, метионин – 8,1 г/кг, изолейцин – 30,6 г/кг, лейцин – 35,5 г/кг, фенилаланин – 19,6 г/кг.
Нормы ввода в комбикорма дрожжей кормовых составляют:
— для с/х животных – 0-12%;
— для с/х птиц — 0-5%;
— для пушных зверей – 0-15%;
— для рыб – 0-10%.
Скармливание комбикормов с кормовыми дрожжами обеспечивает хорошее физиологическое состояние животных, лучшую трансформацию содержащихся в них питательных веществ на продуктивные цели, выразившиеся в достоверно более высокой интенсивности роста (на 6%), снижение на 3,5 % затрат кормов в расчете на 1 кг прироста живой массы.
Максимально допустимые уровни накопленной радиоактивности в виде цезия -134 и -137 регулируются Регламентом Совета Европейских Сообществ № 737/90 от 22 марта 1990 года (статья 3) – 370 Бк/кг. Фактическое содержание радионуклидов цезия -137 в дрожжах производимых ОАО «Бобруйский завод биотехнологий» подтверждается Могилевской областной ветеринарной лабораторией по каждой поставляемой партии.
Условия поставки: ж.д. транспортом (в крытых вагонах), самовывоз автомобильным транспортом в соответствии с правилами транспортировки опасных грузов.
Система менеджмента качества разработки и производства дрожжей кормовых соответствует требованиям СТБ ИСО 9001 – 2001.
Система управления окружающей средой производства дрожжей кормовых соответствует требованиям СТБ ИСО 14001 – 2005.
Дрожжи кормовые: производство, применение и характеристика
Кормовые дрожжи являются прекрасным источником белка для птиц и домашнего скота. С помощью этой добавки можно улучшить яйценоскость у птицы, повысить пищеварение у жвачных животных. Кормовые дрожжи благоприятно влияют на привесы, способствуют поднятию иммунитета и выносливости.
Полезная витаминная добавка для животных
Дрожжи являются одной из разновидностей грибов, которые производятся как из растительных, так и нерастительных субстратов. Они не образуют мицелия и не имеют плодовых тел. Это очень ценный продукт, который богат белком и витаминами. Кормовые дрожжи обычно дают следующим видам скота:
- коровы;
- свиньи;
- птица;
- пушной зверь.
Полезна эта добавка и для рыбы, и для раков. Белок из кормовых дрожжей усваивается животными на 90 процентов. Ими обогащают смеси из зерна в домашних условиях и комбикорма на производстве. В этих дрожжах содержатся незаменимые аминокислоты и витамины.
При постоянном применении этой добавки в хозяйстве увеличиваются привесы, повышается жирность молока, улучшается здоровье молодняка. Кормовые дрожжи снижают затраты на еду скотине, обогащая ее рацион.
Химический состав
Кормовые дрожжи содержат от 47 до 55% белка в своем составе. Самыми питательными из них считаются те, которые выращены на картофельно-зерновой барде. Кормовые дрожжи являются источниками углеводов и жиров, но их в составе гораздо меньше, чем протеина. Это ценный продукт, который полезен для скота.
Кормовые дрожжи по ГОСТ 20083-74 должны содержать лизин, триптофан и метионин. Они богаты полезными микроэлементами:
- фосфор;
- натрий;
- калий;
- никель;
- хром;
- медь;
- марганец;
- цинк;
- кальций;
- железо;
- селен.
В полезной добавке содержатся витамины группы В и С. Они являются прекрасным источником незаменимых аминокислот. Кормовые дрожжи обогащают комбикорма и увеличивают их питательную ценность.
Производство кормовых дрожжей
Для получения этого продукта стерильность на производстве не требуется, они растут на многих субстратах. Сейчас на предприятиях в основном используются штаммы рода Кандида. Они дают большой выход биомассы, устойчивы к вытеснению другими грибами, нетребовательны к уровню обсемененности помещения.
Для заселения субстрата на производстве нужна чистая культура дрожжей. Колонии выращиваются в лаборатории и размножаются. Для постоянного воспроизводства им требуется непрерывный приток питательной среды. Для нормального роста дрожжам необходим кислород. При получении штаммов Кандида необходимо следить за оптимальным pH окружающей среды.
Каким животным можно давать
Полезная добавка к рациону позволяет снизить сроки откорма животных, повысить их привесы, увеличить продуктивность. Кормовые дрожжи применяют для восполнения дефицита белка в питательных смесях и обогащения их витаминами и микроэлементами.
У КРС при регулярной даче добавки увеличивается уровень жира в молоке, поднимается белок. У бычков на откорме возрастают привесы. У овец улучшается состояние шерсти, повышается плодовитость, увеличивается убойный выход мяса. Кормовые дрожжи применяют даже при промышленном выращивании рыбы, что дает положительные результаты.
Эта добавка широко распространена в свиноводстве, так как ее использование гарантирует высокие привесы и уменьшает себестоимость мяса. Сейчас кормовые дрожжи начали применяться и в козоводстве, здесь также увеличиваются привесы у молодняка на откорме и повышаются удои у маток.
Применение в рационе пушных зверей
Кормовые дрожжи в рационе пушных зверей помогают экономить мясной корм, ведь ими можно заменить до 30% белкового питания. Применение добавки на фермах положительно сказывается на жизнестойкости молодняка. Ежедневное добавление к еде кормовых дрожжей улучшает качество меха у пушных зверей, особенно усиливается рост зимнего волоса.
Добавку вводят в рацион постепенно, тщательно перемешивая с другими составляющими. Как давать кормовые дрожжи пушным зверям? В составе смеси с зерном, рыбой, мясными продуктами и витаминно-минеральным комплексом для шерсти.
Однако скармливать дрожжи можно только клинически здоровым зверям. При опытах российских и зарубежных ученых было установлено, что эта добавка противопоказана животным, болеющим плазмоцитозом.
Применение в рационе рыб
Кормовые дрожжи применяются при выращивании рыб, чаще всего карповых пород. Полезна данная добавка и ракам. Обычно дрожжи вводятся в состав гранулированных либо тестообразных кормов.
Применение добавки снижает заболеваемость рыб, они реже испытывают проблемы с жабрами и внутренними органами. Белок из кормовых дрожжей легко усваивается водными обитателями. Добавка богата незаменимыми аминокислотами, необходимыми для нормальной жизнедеятельности рыб.
Применение в рационе птицы
Применять кормовые дрожжи для птицы фермеры начинают для обогащения рациона белком и повышения его питательности. Добавка по эффективности стоит в одном ряду со шротами или жмыхами. Дозировка в среднем составляет от 3 до 5 процентов от общего объема рациона.
При ежедневной даче кормовых дрожжей птице повышается яйценоскость самок. Добавка положительно сказывается на привесе и сохранности молодняка. У птицы улучшается иммунитет, повышается качество пуха и пера. Также кормовые дрожжи благотворно влияют на иммунитет пернатых.
Тем фермерам, которые занимаются инкубацией собственного яйца или его продажей, нужно обратить особое внимание на эту добавку. Доказано, что кормовые дрожжи способны поднять оплодотворяемость. Особенно это важно в зимний период, ведь в холодное время года данный показатель всегда падает.
Применение в рационе свиней
Свиньи очень чувствительны к нехватке белка и витаминов в рационе. На неправильное кормление они отвечают малыми привесами. Для обогащения рациона важно начать применение кормовых дрожжей для свиней. Было подсчитано, что с каждой тонны скормленной добавки получаемый привес равняется 500-600 килограммам мяса.
Протеин кормовых дрожжей прекрасно усваивается свиньями. Добавка способствует правильному балансу аминокислот и витаминов в организме. Кальций, содержащийся в кормовых дрожжах, улучшает состояние костей и зубов, что особенно важно для животных, оставляемых на племя.
Добавка нравится свиньям на вкус, и они с удовольствием поедают ее. Если давать кормовые дрожжи племенным маткам, то они становятся более плодовитыми.
Применение в рационе коров
Кормовые дрожжи для КРС применяют фермеры, которые занимаются и мясным, и молочным животноводством. Добавка оказывает благоприятное воздействие на количество надаиваемого молока, повышает белок и жир в нем. В некоторых случаях введение в рацион кормовых дрожжей препятствовало уходу коров в «самозапуск».
Добавку желательно давать и коровам, находящимся на последних месяцах стельности, она способствует рождению крепкого потомства. Высокоудойным рекордисткам кормовые дрожжи дают в повышенной дозировке в первые 40 дней после отела.
Применяют добавку также и при откорме бычков на мясо. При ее помощи можно поднять протеин в рационе без помощи дорогих шротов. Бычки с удовольствием поедают как чистые кормовые дрожжи, так и смеси с ними. Сбалансированное питание ведет к увеличению привеса и улучшению состояния здоровья животных.
Дрожжевание кормов
Дрожжи можно предлагать скоту в сухом виде. Обычно животные с удовольствием поедают корма с этой добавкой. Также можно предложить скоту и дрожжеванное зерно или отруби. Эта субстанция повышает биологическую ценность рациона и делает питательные вещества более доступными.
Приготовить дрожжеванные корма можно в домашних условиях. Приучать к поеданию новых ингредиентов животных следует постепенно, обычно перевод на другое питание занимает от 5 до 10 дней. Если переход будет слишком резким, то это чревато проблемами с желудочно-кишечным трактом.
Для дрожжевания можно использовать отруби или дробленое зерно. Для этих целей хорошо подойдет ячмень или овес. Основу для дрожжевания нужно запарить. Дождитесь остывания смеси до 30-40 градусов и введите кормовую добавку.
Полученную массу оставьте для проявления реакции. Каждые 20-30 минут дрожжеванный корм нужно помешивать. Полное созревание смеси произойдет через 6-9 часов. После этого дрожжеванную еду можно давать птице или животным.
Для приготовления этого вида питания нельзя использовать старые затхлые корма. Если при дрожжевании будет добавляться сено или травяные веники, то их необходимо проверить на наличие ядовитых растений. Ингредиенты должны быть мелко помолоты, это улучшит течение реакции.
Производство кормовых дрожжей в Беларуси
Минская область
Березино
Березинский р-н
Борисов
Борисовский р-н
Вилейка
Вилейский р-н
Воложин
Воложинский р-н
Городея
Дзержинск
Дзержинский р-н
Жодино
Заславль
Ивенец
Клецк
Клецкий р-н
Копыль
Копыльский р-н
Красная Слобода
Крупки
Крупский р-н
Логойск
Логойский р-н
Любанский р-н
Любань
Марьина Горка
Минск(2)
Минский р-н
Молодечненский р-н
Молодечно
Мядель
Мядельский р-н
Нарочь
Негорелое
Несвиж
Несвижский р-н
Плещеницы
Пуховичский р-н
Радошковичи
Раков
Руденск
Слуцк
Слуцкий р-н
Смиловичи
Смолевичи(1)
Смолевичский р-н
Солигорск
Солигорский р-н
Старобин
Стародорожский р-н
Старые Дороги
Столбцовский р-н
Столбцы
Узда
Узденский р-н
Уречье
Фаниполь
Холопеничи
Червенский р-н
Червень
Брестская область
Антополь
Барановичи
Барановичский р-н
Белоозерск
Береза
Березовский р-н
Брест(1)
Брестский р-н
Высокое
Ганцевичи
Ганцевичский р-н
Городище
Давид-Городок
Дрогичин
Дрогичинский р-н
Жабинка
Жабинковский р-н
Иваново
Ивановский р-н
Ивацевичи
Ивацевичский р-н
Каменец
Каменецкий р-н
Кобрин
Кобринский р-н
Коссово
Лунинец
Лунинецкий р-н
Ляховичи
Ляховичский р-н
Малорита
Малоритский р-н
Микашевичи
Пинск
Пинский р-н
Пружанский р-н
Пружаны
Ружаны
Столин(1)
Столинский р-н
Телеханы
Витебская область
Барань
Бегомль
Бешенковичи
Бешенковичский р-н
Богушевск
Браслав
Браславский р-н
Верхнедвинск
Верхнедвинский р-н
Витебск
Витебский р-н
Глубокое
Глубокский р-н
Городок
Городокский р-н
Дисна
Докшицкий р-н
Докшицы
Дубровенский р-н
Дубровно
Езерище
Коханово
Лепель
Лепельский р-н
Лиозненский р-н
Лиозно
Миорский р-н
Миоры
Новолукомль
Новополоцк
Оболь
Орша
Оршанский р-н
Освея
Подсвилье
Полоцк
Полоцкий р-н
Поставский р-н
Поставы
Россонский р-н
Россоны
Сенненский р-н
Сенно
Толочин
Толочинский р-н
Ушачи
Ушачский р-н
Чашники
Чашникский р-н
Шарковщина
Шарковщинский р-н
Шумилино
Шумилинский р-н
Гомельская область
Брагин
Брагинский р-н
Буда-Кошелево
Буда-Кошелёвский р-н
Василевичи
Ветка
Ветковский р-н
Гомель
Гомельский р-н
Добруш
Добрушский р-н
Ельск
Ельский р-н
Житковичи
Житковичский р-н
Жлобин
Жлобинский р-н
Калинковичи
Калинковичский р-н
Корма
Кормянский р-н
Лельчицкий р-н
Лельчицы
Лоев
Лоевский р-н
Мозырский р-н
Мозырь
Мозырь-11
Наровля
Наровлянский р-н
Октябрьский
Октябрьский р-н
Петриков
Петриковский р-н
Речица
Речицкий р-н
Рогачев
Рогачевский р-н
Светлогорск
Светлогорский р-н
Туров
Хойники
Хойникский р-н
Чечерск
Чечерский р-н
Гродненская область
Б. Берестовица
Березовка
Берестовицкий р-н
Волковыск
Волковысский р-н
Вороново
Вороновский р-н
Гродненский р-н
Гродно
Дятлово
Дятловский р-н
Желудок
Зельва
Зельвенский р-н
Ивье
Ивьевский р-н
Козловщина
Кореличи
Кореличский р-н
Красносельский
Лида
Лидский р-н
Мир
Мостовский р-н
Мосты
Новогрудок
Новогрудский р-н
Новоельня
Острино
Островец
Островецкий р-н
Ошмянский р-н
Ошмяны(1)
Радунь
Россь
Свислочский р-н
Свислочь
Скидель
Слоним
Слонимский р-н
Сморгонский р-н
Сморгонь
Сопоцкин
Щучин
Щучинский р-н
Юратишки
Могилевская область
Белыничи
Белыничский р-н
Бобруйск(1)
Бобруйский р-н
Быхов
Быховский р-н
Глуск
Глусский р-н
Горецкий р-н
Горки
Дрибин
Дрибинский р-н
Кировск
Кировский р-н
Климовичи(1)
Климовичский р-н
Кличев
Кличевский р-н
Костюковичи
Костюковичский р-н
Краснополье
Краснопольский р-н
Кричев
Кричевский р-н
Круглое
Круглянский р-н
Могилев
Могилевский р-н
Мстиславль
Мстиславский р-н
Осиповичи
Осиповичский р-н
Славгород
Славгородский р-н
Хотимск
Хотимский р-н
Чаусский р-н
Чаусы
Чериков
Чериковский р-н
Шклов
Шкловский р-н
новый подход к стратегии кормления с ограничением глюкозы
Braz J Microbiol. 2013; 44 (2): 551–558.
Эрика Дуран Виейра
1 Faculdade de Engenharia Química, Universidade Estadual de Campinas, Campinas, SP, Brazil.
Мария да Граса Ступиелло Андриетта
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
Silvio Roberto Andrietta
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
1 Faculdade de Engenharia Química, Universidade Estadual de Campinas, Кампинас, SP, Бразилия.
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
Отправить корреспонденцию Э. Д. Виейре. Школа химической инженерии, Университет Кампинаса, Cidade Universitária «Zeferino Vaz», C.P. 6066, 13083-970, Кампинас, СП, Бразилия. Электронная почта: moc.liamg@vdakire.Поступило 27 июня 2011 г .; Принята в печать 10 сентября 2012 г.
Copyright © 2013, Sociedade Brasileira de MicrobiologiaВсе содержимое журнала, если не указано иное, находится под лицензией Creative Commons License CC BY-NC.
Эта статья цитируется в других статьях в PMC.Abstract
Целью данной работы было экспериментально реализовать простую стратегию кормления с ограничением глюкозы для производства дрожжевой биомассы в реакторе с пузырьковой колонной на основе имитатора электронных таблиц, пригодного для промышленного применения. В процессе производства биомассы с использованием штаммов Saccharomyces cerevisiae одним из ограничений является сильная тенденция этих видов к анаэробному метаболизму сахаров из-за репрессии катаболитов, что приводит к низким значениям выхода биомассы на субстрат.Обычной стратегией для контроля этой метаболической тенденции является использование периодического процесса с подпиткой, в котором источник сахара подается постепенно, а общая концентрация сахара в бульоне поддерживается ниже определенного значения. Симулятор, представленный в этой работе, был разработан для управления питанием патокой на основе простой теоретической модели, в которой были учтены потребности роста дрожжевых клеток в питательных веществах и два входных данных: теоретическая удельная скорость роста и начальная биомасса клеток. В экспериментальном анализе использовали коммерческий штамм пекарских дрожжей и патоку в качестве источника сахара.Экспериментальные результаты показали общий выход биомассы на субстрат 0,33, увеличение биомассы в 6,4 раза и удельную скорость роста 0,165 ч -1 в отличие от прогнозируемого значения 0,180 ч-1 на втором этапе моделирования.
Ключевые слова: дрожжи, биомасса, партия с подпиткой, моделирование процесса, Saccharomyces cerevisiae
Введение
Микробная биомасса является подходящим дополнительным источником белка, получаемым в процессе культивирования бактерий, дрожжей, других грибов или водорослей в Большие количества.Биомасса дрожжей широко используется в качестве добавки к человеческому или животному белку в кормах для животных или в питании человека (Halasz and Lasztity, 1991). Обычные штаммы, используемые в качестве источника одноклеточного белка, включают штаммы Saccharomyces cerevisiae и Candida utilis . Типичные продукты микробной биомассы включают пекарские дрожжи и дрожжевые экстракты, где штаммы Saccharomyces cerevisiae являются хозяевами для продукции гетерологичного белка (Beudeker et al. , 1990; Hensing et al., 1995).
По сути, концепция промышленного процесса основана на размножении клеток из чистой культуральной косой агара в большие биореакторы, увеличивая объем на каждой стадии размножения до конечного объема биореактора (Rose, 1979; Burrows, 1979; EPA, 1995; Rendez-Gil, Sanz and Priteo, 1999; Ди Серио и др. , 2001; Ди Серио, Тессер и Сантачесария, 2001). Однако, помимо этой простой концепции, промышленное производство направлено на эффективное преобразование сахарного сырья в биомассу дрожжей, главным образом на более поздних стадиях, когда объем биомассы велик.Эффективное преобразование сахара в дрожжевой белок требует, чтобы производство анаэробных метаболитов, таких как этанол и ацетальдегид (Bauer et al. , 1999) было сведено к минимуму, , т.е. , чтобы метаболизм сахара был отклонен в сторону окислительного пути для достижения максимального выхода энергии АТФ. и образование биомассы (Van Hoek, Van Dijken and Pronk, 1998). Кроме того, токсичны такие продукты ферментации, как этанол и, в частности, ацетальдегид. Эта проблема становится особенно актуальной при культивировании с высокой плотностью биомассы (Hensing et al., 1995; ван Дейкен, Weusthuis and Pronk, 1993).
Общеизвестно, что видов Saccharomyces cerevisiae имеют тенденцию к гликолитическому метаболизму глюкозы при избытке глюкозы даже в полностью аэробных условиях с образованием этанола, явление, известное как эффект Крэбтри (Käppeli, 1986; Sonnleitner and Käppeli, 1986; Verduyn, 1991; Dynesen). , 1998). Кроме того, было показано, что не только глюкоза, но и фруктоза запускает репрессию катаболитов у штаммов Saccharomyces cerevisiae (Dynesen, 1998).Эта катаболитная репрессия приводит к низкому выходу биомассы при культивировании Saccharomyces cerevisiae в периодических культурах и отрицательно влияет на урожай биомассы из-за низкого выхода АТФ при спиртовой ферментации. Несмотря на это, образование биомассы может быть достигнуто множеством метаболических путей (Frick and Whitmann, 2005), а выход биомассы на субстрат может достигать значений до 50% при чистом окислительном росте (Akinyemi, Betiku and Solomon, 2005).
Для преодоления этих ограничений на производство биомассы дрожжей большое значение имеют две важные переменные: скорость переноса кислорода и концентрация глюкозы в бульоне.В гетерогенных газожидкостных реакциях например , при аэробной ферментации жидкая фаза контролирует процессы массопереноса из-за относительной нерастворимости газов. Это ограничение сводится к минимуму за счет использования реакторов с барботажными колоннами из-за их хорошей передачи кислорода при низкой стоимости эксплуатации по сравнению с реакторами с мешалкой (Kantarcia, Borakb and Ulgen, 2005). Минимальная концентрация сахара в бульоне может быть достигнута при использовании периодического процесса с подпиткой. Эта технологическая концепция является современной в промышленном масштабе и обеспечивает хороший выход биомассы при использовании соответствующей стратегии управления технологическим процессом.Традиционно при промышленном производстве патока или другое кормление следует стратегии, построенной на основе заводских исторических данных, и поэтому она свойственна определенному штамму и другим условиям процесса. В настоящее время не только по экономическим причинам, но и из-за экологической политики, некоторые отрасли промышленности вкладывают средства в новые стратегии управления технологическими процессами, чтобы избежать выбросов токсичных загрязнителей (EPA, 1995). В научной литературе можно найти множество статей о производстве пекарских дрожжей, посвященных моделированию роста дрожжей и направленных на достижение различных целей, таких как продуктивность, урожайность и качество дрожжей, а также о новых и надежных онлайн-датчиках (Reyman, 1992; Rigbom, Rothberg and Saxen, 1996; Rendez-Gil, Sanz and Priteo, 1999; Jones and Kompala, 1999; Di Serio et al., 2001; Ди Серио, Тессер и Сантачесария, 2001 г .; Солей, 2005). Однако существует несколько простых теоретических моделей производства дрожжевой биомассы, которые могут быть применимы к любому штамму и процессу и могут быть применимы в промышленных масштабах.
Таким образом, цель настоящей работы заключалась в разработке и экспериментальной реализации простой теоретической модели роста дрожжей, основанной на нескольких параметрах, с целью достижения стратегии кормления с ограничением глюкозы, применимой в промышленных масштабах. Для этой цели была разработана электронная таблица, в которой теоретическая модель могла прогнозировать в каждом временном интервале потребности дрожжевых клеток в питательных веществах на основе двух основных входных данных: теоретической удельной скорости роста и начальной биомассы клеток.Модель была проверена в лабораторном эксперименте. Производство биомассы осуществляли в 5-литровом реакторе с барботажной колонной с использованием коммерческого штамма пекарских дрожжей. Первые две стадии размножения дрожжевых клеток, распространенные в промышленных процессах, были смоделированы экспериментально с использованием патоки сахарного тростника в качестве источника углерода.
Материалы и методы
Операционная система
Операционная система показана на. Конструкция реактора, использованная в данной работе, представляла собой цилиндрический корпус из акрила на 5 штук.Объем 5 литров с коническим дном. На конце конического дна была присоединена трубка диаметром 1 см для входа воздуха без какого-либо воздухораспределителя. К конструкции были добавлены пять равноотстоящих поперечных перегородок с 4 отверстиями для создания турбулентности и сдвига, которые могли разрушить пузырьки воздуха. Конструкция также включала небольшие выпускные трубки, из которых можно было подавать мелассу, а ячейки могли циркулировать через теплообменник со стеклянной спиралью, соединенный с термостатической ванной на 34 ° C. Аэрация оценивалась путем уменьшения типичных промышленных условий: 0.3 vvm для первой стадии и 1.3 vvm для второй стадии. Уменьшение масштаба основывалось на критерии геометрического подобия реакторов и одинакового коэффициента массоотдачи (k La1 = k La2 ) (Aiba, 1971). Это привело к 2,5 vvm (9 л / мин) для первой ступени и 1,3 vvm (приблизительно 30 л / мин) для второй стадии. Реактор был предварительно промыт 5% -ным раствором гидроксида натрия для предотвращения чрезмерного бактериального заражения.
Операционная система: (1) акриловый сосуд, (2) колба для мелассы, (3) теплообменник со стеклянным змеевиком, (4) термостатическая ванна, (5) ротаметр, (6) перистальтические насосы Masterflex и (7) двухзначные весы.
Микроорганизм
Микроорганизм, оцениваемый в этом анализе, представлял собой коммерческий штамм пекарских дрожжей Saccharomyces cerevisiae , названный Y167, из коллекции дрожжей CPQBA. Этот штамм был выбран из-за его известной характеристики — высокой скорости роста клеток. Микроорганизм сохраняли в картофельном агаре с декстрозой (КПК), погруженном в минеральное масло, и хранили при 4 ° C. Размножение инициировали переносом консервированных микроорганизмов на свежий скошенный PDA, который инкубировали при 32 ° C в течение 24 часов.
Инокулят
Использованный инокулят был приготовлен в 250 мл колбах Эрленмайера со 100 мл стерилизованной среды (15 мин 121 ° C), состоящей из: 150 г / л сахарозы, 6 г / л дрожжевого экстракта, 5 г / л фосфата калия. одноосновный, 5 г / л хлорида аммония, 1 г / л сульфата магния и 1 г / л хлорида калия. Дрожжи, выращенные в скошенном PDA в течение 24 ч при 32 ° C, ресуспендировали в стерилизованной воде и инокулировали в концентрации 10% от общего объема ферментационной среды. Колбы инкубировали на шейкере 24 ч при 32 ° C и 150 об / мин.
Кормовой субстрат
Источник углерода, используемый во всех анализах, происходил из одной единственной партии патоки сахарного тростника с бразильского сахарного завода. Этот образец мелассы имел температуру 80 ° Brix с общим содержанием сахара около 56%, и его удобно разбавляли дистиллированной водой для использования в анализах. Одноосновный фосфат калия (KH 2 PO 4 ) использовали в качестве источника фосфора, а хлорид аммония (NH 4 Cl) в качестве источника азота. Другие витамины и питательные вещества уже присутствуют в патоке сахарного тростника в достаточных количествах, так что ферментационный бульон был обогащен только указанными солями, чтобы гарантировать снабжение азотом и фосфором.
Первая стадия роста клеток
Реактор был заполнен 3,5 литрами разбавленной патоки сахарного тростника с температурой приблизительно 15 ° Brix, предварительно стерилизованной в течение 10 минут при 121 ° C. Мелассу обогащали KH 2 PO 4 и NH 4 Cl, и ее pH доводили до 4,5, оптимального pH для большинства штаммов Saccharomyces cerevisiae (Rose, 1987). Необходимое количество сырой мелассы и солей азота и фосфора было рассчитано на основе имитатора электронных таблиц.В реакторе инкубировали 45 мл дрожжей, выращенных в колбе. Эту первую стадию роста клеток проводили в течение 16 часов при уровне аэрации 9 л / мин. Этот этап проводился без периодического отбора проб и с избытком источника углерода, поскольку целью этого этапа является получение максимального увеличения биомассы в ущерб потерям биомассы на выходе субстрата (оценивается в 0,22) и высокой продуктивности. Через 16 часов реактор опустошили и промыли водой, а часть ферментационного бульона первой стадии использовали в качестве инокулята для второй стадии.В промышленном процессе объем биореакторов постепенно увеличивается, так что объем биореактора первой ступени спроектирован таким образом, чтобы составлять около 15-20% от объема биореактора второй ступени, а весь ферментационный бульон первой ступени перемещается во вторую ступень. стадия биореактора для продолжения размножения дрожжевой биомассы. Из-за отсутствия в лаборатории биореактора большего размера, анализ второй стадии проводили в том же акриловом сосуде первой стадии и в количестве ферментационного бульона первой стадии, соответствующем 16% от конечного рабочего объема (3.5 литров), использовали в качестве посевного материала на втором этапе.
Вторая стадия роста клеток
Очищенный реактор был заполнен 2 литрами дистиллированной воды. Это количество было рассчитано на основе данных электронной таблицы для получения окончательного рабочего объема 3,5 литра. Эта операция добавления воды является обычной в промышленном производстве биомассы дрожжей, чтобы минимизировать концентрацию этанола, образующуюся на первой стадии размножения, которая может ингибировать рост клеток на следующей стадии. Затем в реактор залили 560 мл (16% 3.5 литров) ферментационного бульона с первой стадии, pH которого предварительно был доведен до 4,5 с помощью 2 н. HCl. Вторую стадию роста клеток проводили в течение 12 часов при уровне аэрации 30 л / мин. Разбавленную мелассу (40 ° Brix), предварительно стерилизованную в течение 10 мин при 121 ° C, постепенно подавали перистальтическим насосом. Скорость подачи контролировали путем взвешивания колбы с патокой на двухзначных весах. Каждый час к ферментационному бульону добавляли определенную аликвоту 10% (мас. / Мас.) Одноосновного раствора фосфата калия и 10% (мас. / Мас.) Раствора хлорида аммония.Массу мелассы и аликвоты растворов азота и фосфора, подаваемые в каждый временной интервал, рассчитывали на основе имитатора электронной таблицы производства биомассы.
Отбор проб из биореактора
На первом этапе отбирали две пробы по 10 мл в 0 ч и в 16 ч, а на втором этапе каждый час отбирали пробу 10 мл для измерения биомассы (стандартный метод для сухой клеточная масса) и анализы фруктозы, глюкозы и сахарозы (ВЭЖХ). Образец объемом 10 мл центрифугировали при 4000 об / мин и 4 мин в градуированных центрифужных пробирках.Супернатант разбавляли для анализа ВЭЖХ в хроматографической системе Dionex с колонкой CarboPac PA1 и импульсным амперометрическим детектированием. Объем влажных клеток использовали для оценки концентрации клеток в бульоне с учетом того, что масса сухих клеток (г) приблизительно равна 25% от объема влажных клеток (мл). Центрифугированные клетки промывали дистиллированной водой и центрифугировали два раза после переноса в предварительно взвешенные чашки. Клетки сушили при 60 ± 5 ° C до постоянного веса.
Электронная таблица производства биомассы
Электронная таблица была разработана для моделирования роста дрожжевых клеток и прогнозирования их потребностей в питании в периодическом процессе с подпиткой при ограниченной концентрации глюкозы.Образец роста клеток был установлен как экспоненциальный в соответствии с общим уравнением X = X 0 EXP (v 0 .t), где X обозначает микробную биомассу в момент времени t, X 0 микробную биомассу в момент времени t = 0, t время. в часах (ч) и v 0 — удельная скорость роста (h −1 ). Увеличение биомассы в каждом часовом интервале может быть рассчитано после ввода начальной клеточной массы (X 0 ) an ± te (μ). Потребности в питательных веществах (источник углерода, азота и фосфора) рассчитывались на основе (i) среднего состава элементов (% масс.) В клетках (% по массе) углерода, азота и фосфора (Atkinson and Mavituna, 1991; Lange and Heijnem, 2001) и ( ii) масса дрожжевых клеток в реакторе каждый раз (X (t)).Считалось, что только 50% израсходованного углерода преобразовалось в биомассу, , то есть , выход биомассы на субстрат (Y X / S ) равен 0,5. показывает основу электронных таблиц, реализованную в программном обеспечении Microsoft Excel. показывает определения переменных, используемых в имитаторе электронных таблиц.
Таблица 1
Основа имитатора электронных таблиц.
| Колонка | Переменная | Символ | Единица | Формула | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | время | t | h | X (т) | г | = X0 * exp (μ¯ * t) | ||||||||||
| 3 | Масса углерода в ячейках в момент времени t | C (t) | г | = CF * X (t) | ||||||||||||
| 4 | Масса азота в ячейках в момент времени t | N (t) | г | = NF * X (t) | ||||||||||||
| 5 | Масса фосфора в клетках в момент времени t | P (t) | г | = PF * X (t) | ||||||||||||
| 6 | Потребность в углероде | ΔC (t) | г | = C (t + 1) — C (t) | ||||||||||||
| 7 | Общая потребность в редуцирующем сахаре | ΔTRS (t) | г | = ΔC (t) / (H * Y X / S ) | ||||||||||||
| 8 | Потребность в разбавленной мелассе | ΔM (t) | г | = ΔTRS (t) * d / MP | ||||||||||||
| 9 | Потребность в азоте | ΔN (t) | г | = N (t + 1) — N (t) | ||||||||||||
| 10 | 10% NH 4 Аликвота раствора CL | ΔNS (t) | мл | = ΔN (t) * W / NFS | ||||||||||||
| 11 | Потребность в фосфоре | ΔP (t) | г | = P (t + 1) — P (t) | ||||||||||||
| 12 | 10% KH 2 PO 4 аликвота раствора | ΔPS (t) | мл | = ΔP (t) * W / PFS |
Таблица 2
Определение переменных.
| Переменная | Значение | Определение | Ед. Удельная скорость роста | ч −1 | |
|---|---|---|---|---|---|
| FC | 0,47 | Массовая доля углерода в дрожжевой клетке | — | ||
| NF | 0.085 | Массовая доля азота в дрожжевой клетке | — | ||
| PF | PF | PF | 0,0113 | Массовая доля фосфора в дрожжевой клетке | — |
| H | 0,4 | гексагональная фракция углерода||||
| Y X / S | 0,5 | Выход биомассы на субстрате | — | ||
| d | Требуется установка | Коэффициент разбавления мелассы | — | MP | |
| MP | |||||
| Меласса Чистота сахара (TRS на мелассу, г / г) | вес / вес | ||||
| NFS | 0.26 | Массовая доля азота в NH 4 Cl | — | ||
| PFS | 0,23 | Массовая доля фосфора в KH 2 PO 4 | — | W Концентрация соли | % мас. / Мас. |
Результаты
Расчетная таблица, используемая для оценки необходимого количества питательных веществ на первом этапе анализа, показана на. Необходимое количество сырой мелассы и солей азота и фосфора рассчитывалось с учетом содержания биомассы в реакторе 70 г в конце первой стадии.Это соображение было сделано на основе оценки увеличения биомассы в 100 раз, с 0,7 г до 70 г общей биомассы, без учета модели экспоненциального роста. Расчетная таблица, использованная во втором этапе анализа, показана на. Была принята удельная скорость роста 0,18 ч -1 и ожидаемая начальная масса клеток 7,0 г, оцененная по объему центрифугированных влажных клеток посевного материала. Чистота патоки составляла 56%, как определено сахарным HPCL (фруктоза, глюкоза и сахароза) и анализом Brix.Объем дистиллированной воды, добавленной в реактор, рассчитывали путем вычитания объема питательного вещества, добавляемого до конца 12 часов, и объема посевного материала из общего рабочего объема реактора. Плотность разбавленной мелассы составляла 1,06 г / мл. Стоит отметить, что конечный объем на втором этапе не достиг ожидаемых 3,5 л из-за потери воды, отпаренной при аэрации. Конечный объем составлял приблизительно 3 литра, и все данные о концентрации были скорректированы на основе этого эффекта.
Таблица 3
Данные электронной таблицы первого этапа, построенные со следующими входными переменными: X 0 = 0,7 г / л, Y X / S = 0,22, MP = 0,56 и d = 1.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | N (т) | P (т) | ΔC (т) | ΔTRS (т) | ΔM (т) | ΔN | ΔNS | ΔP | ΔP ) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) ) | (г) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 0.70 | 0,33 | 0,06 | 0,01 | 32,57 | 370,1 | 660,9 | 5,89 | 22,49 | 0,78 | 22,49 | 0,78 | 3,44 | 9018 5 — | — | — | — | — | — | — |
Таблица 4
Данные электронной таблицы второго этапа, построенные со следующими входными переменными: X 0 = 7.0 г / л, μ̄ = 0,18 ч −1 , MP = 0,56 и d = 2.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| t | X (t) | C (t) | N (t) | P (t) | ΔC (t) ΔTRS (т) | ΔM (т) | ΔN | ΔNS | ΔP | ΔPS | |||||||||||
| (ч) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (мл) | (г) | (мл) | ||||||||
| 0 | 7.0 | 3,29 | 0,60 | 0,08 | 0,65 | 3,2 | 11,6 | 0,12 | 4,5 | 0,02 | 0,7 | ||||||||||
| 0,7 | 9018 0,78 | 3,9 | 13,9 | 0,14 | 5,4 | 0,02 | 0,8 | ||||||||||||||
| 2 | 10,0 | 4,72 | 0,85 | 0,11 | 934,7 | 16,6 | 0,17 | 6,4 | 0,02 | 1,0 | |||||||||||
| 3 | 12,0 | 5,65 | 5,65 | 0,14 | 7,7 | 0,03 | 1,2 | ||||||||||||||
| 4 | 14,4 | 6,76 | 1,22 | 0,16 | 1,33 | 6,7 | 23,8 | 0.24 | 9,2 | 0,03 | 1,4 | ||||||||||
| 5 | 17,2 | 8,09 | 1,46 | 0,19 | 1,60 | 0,19 | 1,60 | 8,0 | 28,5 | 8,0 | 28,5 | 28,5 | 28,5 | 9018||||||||
| 6 | 20,6 | 9,69 | 1,75 | 0,23 | 1,91 | 9,6 | 34,1 | 0,35 | 13,2 | 0,05 | 2.0 | ||||||||||
| 7 | 24,7 | 11,60 | 2,10 | 0,28 | 2,29 | 11,4 | 40,8 | 0,41 | 15,8 | 9018 9018 2 | 9018 | 9018 | 2,51 | 0,33 | 2,74 | 13,7 | 48,9 | 0,50 | 18,9 | 0,07 | 2,9 |
| 9 | 35.4 | 16,62 | 3,01 | 0,40 | 3,28 | 16,4 | 58,5 | 0,59 | 22,6 | 0,08 | 3,5 | ||||||||||
| 3,93 | 19,6 | 70,1 | 0,71 | 27,1 | 0,09 | 4,1 | |||||||||||||||
| 11 | 50,7 | 23,83 | 4,31 | 0.57 | 4,70 | 23,5 | 83,9 | 0,85 | 32,5 | 0,11 | 5,0 | ||||||||||
| 12 | 60,7 | 28,53 | — | — | — | — | |||||||||||||||
| Всего | — | — | — | — | — | 126,19 | 450,68 | .3 | 0,61 | 26,7 | |||||||||||
| Исходные данные | 9018 9018 9018 9018 Объем добавленных питательных веществ 9018 9018 9018 Объем 9018 9018 1186 | ||||||||||||||||||||
| Объем инокулята (мл) | 560 | 3500 | |||||||||||||||||||
| Объем дистиллированной воды (мл) | 9018 9018 9018 9018 9018 9018 9018 | 9018 | |||||||||||||||||||
Сводные данные первого Этап и второй этап анализов роста клеток показаны в Таблице 5.На первом этапе выход биомассы достиг 0,20, как и ожидалось, в среде с избытком глюкозы, когда штаммы Saccharomyces cerevisiae предпочитают анаэробное дыхание. Увеличение биомассы достигло 112,8 раза, так что цель по высокому увеличению биомассы на этом первом этапе была достигнута. Напротив, на втором этапе общий выход биомассы был выше, достигнув 0,33, а увеличение биомассы было 6,4 раза, оба приемлемых значения для промышленного производства биомассы. Однако ожидалось, что урожай биомассы будет ближе к 0.5, как это происходит в промышленных биореакторах.
Схема роста клеток второй стадии показана на. Кривая экспоненциальной регрессии хорошо согласуется с экспериментальными данными. Удельная скорость роста составила 0,165 ч -1 , что подтверждает хорошие параметры роста штамма Y167 и хорошую начальную оценку 0,18 ч -1 .
показывает профиль концентрации биомассы. Расчетная концентрация биомассы относится к значениям, рассчитанным на основе электронной таблицы, а экспериментальная концентрация биомассы относится к значениям, рассчитанным на основе массы сухих клеток.Эти данные показывают, что после 6 часов реальная концентрация биомассы в реакторе была ниже ожидаемого значения, а питательные вещества и сахар могли быть поданы в избытке.
Профиль концентрации биомассы.
Сахарный профиль второй стадии показан на. Концентрация TRS поддерживалась ниже 1 г / л до 5 -го часа. После 6-го часа TRS увеличился примерно с 1 г / л до 3 г / л, вероятно, из-за концентрации биомассы ниже прогнозируемого значения.
Другие интересные переменные, которые должны помочь в анализе данных, представлены в. Урожай биомассы был рассчитан как мгновенный и совокупный, , т. Е. , урожай за один час (Y X / S Мгновенный в 5 -м часе относится к интервалу с 4 -го часа до 5-го часа). th час) и доходность с нулевого времени до текущего времени соответственно. Совокупный выход биомассы начинается с низкого значения 0,24, достигая максимального значения 0.45 на 6 час. После 6 -го часа можно заметить небольшую тенденцию к снижению значений до общего значения 0,33. В отличие от сахарного профиля, кумулятивное падение выхода биомассы тесно связано с увеличением TRS, что подтверждает сильную тенденцию дрожжей менять метаболизм с аэробного на анаэробное дыхание, когда в бульоне присутствует избыток сахара. Мгновенный выход биомассы показал разрозненные значения, но он следовал той же тенденции, что и кумулятивные значения.
Мгновенный и совокупный профиль выхода биомассы.
Обсуждение
На типичной установке по производству биомассы размножение дрожжей начинается так же, как и в анализе, представленном в этой работе: от скошенного агара до посевного реактора до биореакторов объемом 150 000 литров (реакторы с пузырьковыми колонками). Рост дрожжей в колбе представляет собой рост дрожжей в посевном реакторе, где стерильный рост необходим для обеспечения чистого посевного материала культуры. Первая и вторая ступени в реакторе с барботажной колонной представляют собой первую и вторую стадии размножения дрожжей в больших биореакторах.На первом этапе цель состоит в том, чтобы получить высокий прирост биомассы (продуктивности), чтобы выход биомассы на субстрат не был важной переменной, и не было необходимости в контроле кормления. На втором этапе цель состоит в том, чтобы максимизировать выход биомассы на субстрат путем постепенной подачи патоки, чтобы избежать катаболитной репрессии. Эта стратегия кормления используется от второй стадии размножения до последних биореакторов, где выход биомассы имеет большое значение для производственных затрат.Высокая плотность ячеек и большой рабочий объем, достигаемые на этих стадиях процесса, превращают потребление мелассы в значительную переменную стоимости, поэтому необходима хорошая стратегия подачи и контроль процесса.
Другой важной переменной в производстве биомассы является аэрация и перенос кислорода, поскольку выход биомассы зависит от достижения полностью аэробных условий. Это состояние нелегко смоделировать в пузырьковых реакторах в лабораторных масштабах из-за небольшой высоты реактора, которая приводит к короткому времени пребывания пузырьков воздуха.В случае анализа, представленного в этой работе, рабочая высота биореактора была слишком мала по сравнению с промышленными биореакторами, так что время пребывания пузырьков воздуха было недостаточным для достижения максимального растворенного кислорода в бульоне. Значения выхода биомассы свидетельствовали о том, что экспериментальные условия не достигли полностью аэробных условий. Таким образом, относительно низкое значение выхода биомассы, полученное в этой работе, объясняется ограниченной доступностью кислорода, вызванной плохой передачей кислорода и малым временем пребывания пузырьков воздуха, обусловленным конструкцией и размером реактора соответственно (Fiecher, Käppeli and Meussdoerffer, 1987 ).Другим фактом, который подтверждает доказательства плохой оксигенации бульона, был интенсивный запах ацетальдегида в лаборатории во время анализа, а также присутствие и постоянно растущая концентрация побочных продуктов, обнаруженных с помощью анализа ВЭЖХ (результаты не рассчитаны количественно).
Концентрация клеток в бульоне после 6 -го часа была ниже расчетного значения. Это говорит о том, что, исходя из теории электронных таблиц, количество TRS, которое подавалось с этого времени до конца эксперимента, было избыточным.Это может объяснить увеличение TRS в бульоне () и снижение значений выхода биомассы () вместе с плохой оксигенацией. В условиях более высокой плотности клеток потребление кислорода можно теоретически рассчитать и добавить в электронную таблицу, чтобы аэрация увеличивалась по мере увеличения биомассы. Узкое место оксигенации в мелкомасштабных операциях затрудняет моделирование предыдущих этапов. Он был смоделирован на стадии 3 rd (результаты здесь не показаны), но результаты ясно показали, что перенос кислорода был недостаточным, даже когда аэрация была выше 45 л / мин.Кроме того, было замечено, что клетки были серьезно повреждены, и их жизнеспособность упала до 50%. Это было связано с сильным напряжением сдвига, вызванным высокой скоростью потока пузырьков воздуха.
Выводы
Промышленное производство дрожжевой биомассы — это хорошо отработанный и простой процесс, который с годами совершенствовался с внедрением более совершенной концепции процесса, разработки и стратегий управления. Настоящая работа сосредоточена на улучшении контроля процесса с помощью простой стратегии кормления с ограничением глюкозы.Результаты, представленные здесь, хорошо согласуются с промышленными реалиями, и имитатор электронных таблиц может быть полезным инструментом в эксплуатации и управлении процессом производства биомассы.
Выражение признательности
CAPES, Бразильская организация по координации совершенствования кадров высшего образования, за стипендию, присужденную первому автору.
Ссылки
- Aiba S. Масштабирование. В: Хамфри А.Е., Миллис Н.Ф., редакторы. Биохимическая инженерия. Токийский университет прессы; Токио: 1971.[Google Scholar]
- Акинеми О.П., Бетику Э., Соломон Б.О. Канал субстрата и энергетика Saccharomyces cerevisiae DSM 2155, выращенного на глюкозе в процессе периодической ферментации с подпиткой. Afr J Biotechnol. 2005; 2: 96–103. [Google Scholar]
- Аткинсон Б., Мавитуна Ф. Справочник по биохимической инженерии и биотехнологии. Stockton Press; 1991. с. 120. [Google Scholar]
- Bauer J, Luttik MAH, Flores CL, van Dijken JP, Pronk JT, Niederberger P. Образование побочных продуктов при воздействии на дышащие культуры Saccharomyces cerevisiae избытка глюкозы не вызвано ограниченной способностью пирувата. карбоксилаза.FEMS Microbiol Lett. 1999. 179: 107–113. [PubMed] [Google Scholar]
- Beudeker RF, van Dam HW, van der Plaat JB, Vellenga K. Развитие производства пекарских дрожжей. В: Verachtert H, DeMot R, редакторы. Биотехнология и биокатализ дрожжей. Марсель Деккер; Нью-Йорк: 1990. С. 103–146. [Google Scholar]
- Дрожжи Берроуза С. Бэкера. В: Роуз А.Х., редактор. Микробная биомасса. Vol. 4. Академическая пресса; Нью-Йорк: 1979. С. 30–63. [Google Scholar]
- Di Serio M, De Alteriis E, Parascandola P, Santacesaria E.Общая кинетическая модель и модель массопереноса для моделирования роста пекарских дрожжей в биореакторах. Катал сегодня. 2001; 66: 437–445. [Google Scholar]
- Ди Серио М., Тессер Р., Сантачесария Э. Кинетическая и массообменная модель для моделирования роста пекарских дрожжей в промышленных биореакторах. Chem Eng J. 2001; 82: 347–354. [Google Scholar]
- Динесен Дж., Смитс Х.П., Олссон Л., Нильсен Дж. Углеродная катаболическая репрессия инвертазы при периодическом культивировании Saccharomyces cerevisiae: роль глюкозы, фруктозы и маннозы.Appl Microbiol Biotechnol. 1998. 50: 579–582. [PubMed] [Google Scholar]
- EPA. Производство дрожжей. [Доступ 20 июня 2011 г.]; Compilation of Air Pollutant Emission Factors: AP-42. (Пятое издание). Том I 1995 г. (глава 9.13.4) Доступно по адресу: http://www.epa.gov/ttn/chief/ap42. [Google Scholar]
- Фихер А., Каппели О., Мейсдёрфер Ф. Баня и непрерывная культура. В: Rose AH, Harrison JS, редакторы. Дрожжи. 2-е издание. Vol. 2. Академическая пресса; Нью-Йорк: 1987. С. 99–129. [Google Scholar]
- Фрик О., Витманн К.Характеристика метаболического сдвига между окислительным и ферментативным ростом у Saccharomyces cerevisiae с помощью сравнительного анализа потока 13 C. Фабрики микробных клеток. 2005; 4:30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Halasz A, Lasztity R. Использование биомассы дрожжей в производстве продуктов питания. CRC Press; Бока-Ратон, Флорида: 1991. стр. 312. [Google Scholar]
- Hensing MCM, Rouwenhorst RJ, Heijnen JJ, van Dijken JP, Pronk JT. Физиологические и технологические аспекты крупномасштабного производства гетерологичных белков дрожжами.Антон ван Ли. 1995. 67: 261–279. [PubMed] [Google Scholar]
- ван Дейкен, JP, Weusthuis RA, Pronk JT. Кинетика роста и потребления сахара дрожжами. Антон ван Ли. 1993; 63: 343–352. [PubMed] [Google Scholar]
- Джонс К.Д., Компала Д.С. Кибернетическая модель динамики роста Saccharomyces cerevisiae в периодических и непрерывных культурах. J Biotechnol. 1999. 71: 105–131. [PubMed] [Google Scholar]
- Kantarcia N, Borakb F, Ulgen KO. Реакторы барботажные колонны. Process Biochem.2005; 40: 2263–2283. [Google Scholar]
- Каппели О. Регулирование углеродного обмена у Saccharomyces cerevisiae и родственных дрожжей. Adv Microb Physiol. 1986; 28: 181–209. [PubMed] [Google Scholar]
- Lange HC, Heijnen JJ. Статистическое согласование элементного и молекулярного состава биомассы Saccharomyces cerevisiae. Biotechnol Bioeng. 2001; 75: 334–344. [PubMed] [Google Scholar]
- Rendez-Gil F, Sanz P, Prieto JA. Технические пекарские дрожжи: есть над чем работать.Trends Biotechnol. 1999; 17: 237–244. [PubMed] [Google Scholar]
- Рейман Г. Моделирование и контроль периодической ферментации пекарских дрожжей с подпиткой. Пищевой контроль. 1992; 3: 33–44. [Google Scholar]
- Рингбом К., Ротберг А., Саксен Б. Автоматизация производства пекарских дрожжей на основе моделей. J Biotechnol. 1996; 51: 73–82. [PubMed] [Google Scholar]
- Rose AH. История и научные основы крупномасштабного производства микробной биомассы. В: Роуз А.Х., редактор. Микробная биомасса. Vol. 4. Академическая пресса; Нью-Йорк: 1979.С. 1–29. [Google Scholar]
- Rose AH. Реакция на химическую среду. В: Rose AH, Harrison JS, редакторы. Дрожжи. 2-е издание. Vol. 2. Академическая пресса; Нью-Йорк: 1987. С. 5–40. [Google Scholar]
- Soley A, Lecina M, Gámez X, Cairó JJ, Riu P, Rosell X, Bragós R., Gòdia F. Онлайн-мониторинг роста дрожжевых клеток с помощью импедансной спектроскопии. J Biotechnol. 2005. 118: 398–405. [PubMed] [Google Scholar]
- Зоннлейтнер Б., Кэппели О. Рост Saccharomyces cerevisiae контролируется его ограниченной дыхательной способностью: формулировка и проверка гипотезы.Biotechnol Bioeng. 1986; 28: 927–937. [PubMed] [Google Scholar]
- ван Хук П., Ван Дейкен Дж., Пронк Дж. Влияние удельной скорости роста на ферментативную способность пекарских дрожжей. Appl Environ Microbiol. 1998; 64: 4226–4233. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Verduyn C. Физиология дрожжей в зависимости от урожайности биомассы. Антон ван Ли. 1991; 60: 325–53. [PubMed] [Google Scholar]
новый подход к стратегии кормления с ограничением глюкозы
Braz J Microbiol.2013; 44 (2): 551–558.
Эрика Дуран Виейра
1 Faculdade de Engenharia Química, Universidade Estadual de Campinas, Campinas, SP, Brazil.
Мария да Граса Ступиелло Андриетта
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
Silvio Roberto Andrietta
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
1 Faculdade de Engenharia Química, Universidade Estadual de Campinas, Кампинас, SP, Бразилия.
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
Отправить корреспонденцию Э. Д. Виейре. Школа химической инженерии, Университет Кампинаса, Cidade Universitária «Zeferino Vaz», C.P. 6066, 13083-970, Кампинас, СП, Бразилия. Электронная почта: moc.liamg@vdakire.Поступило 27 июня 2011 г .; Принята в печать 10 сентября 2012 г.
Copyright © 2013, Sociedade Brasileira de MicrobiologiaВсе содержимое журнала, если не указано иное, находится под лицензией Creative Commons License CC BY-NC.
Эта статья цитируется в других статьях в PMC.Abstract
Целью данной работы было экспериментально реализовать простую стратегию кормления с ограничением глюкозы для производства дрожжевой биомассы в реакторе с пузырьковой колонной на основе имитатора электронных таблиц, пригодного для промышленного применения. В процессе производства биомассы с использованием штаммов Saccharomyces cerevisiae одним из ограничений является сильная тенденция этих видов к анаэробному метаболизму сахаров из-за репрессии катаболитов, что приводит к низким значениям выхода биомассы на субстрат.Обычной стратегией для контроля этой метаболической тенденции является использование периодического процесса с подпиткой, в котором источник сахара подается постепенно, а общая концентрация сахара в бульоне поддерживается ниже определенного значения. Симулятор, представленный в этой работе, был разработан для управления питанием патокой на основе простой теоретической модели, в которой были учтены потребности роста дрожжевых клеток в питательных веществах и два входных данных: теоретическая удельная скорость роста и начальная биомасса клеток. В экспериментальном анализе использовали коммерческий штамм пекарских дрожжей и патоку в качестве источника сахара.Экспериментальные результаты показали общий выход биомассы на субстрат 0,33, увеличение биомассы в 6,4 раза и удельную скорость роста 0,165 ч -1 в отличие от прогнозируемого значения 0,180 ч-1 на втором этапе моделирования.
Ключевые слова: дрожжи, биомасса, партия с подпиткой, моделирование процесса, Saccharomyces cerevisiae
Введение
Микробная биомасса является подходящим дополнительным источником белка, получаемым в процессе культивирования бактерий, дрожжей, других грибов или водорослей в Большие количества.Биомасса дрожжей широко используется в качестве добавки к человеческому или животному белку в кормах для животных или в питании человека (Halasz and Lasztity, 1991). Обычные штаммы, используемые в качестве источника одноклеточного белка, включают штаммы Saccharomyces cerevisiae и Candida utilis . Типичные продукты микробной биомассы включают пекарские дрожжи и дрожжевые экстракты, где штаммы Saccharomyces cerevisiae являются хозяевами для продукции гетерологичного белка (Beudeker et al. , 1990; Hensing et al., 1995).
По сути, концепция промышленного процесса основана на размножении клеток из чистой культуральной косой агара в большие биореакторы, увеличивая объем на каждой стадии размножения до конечного объема биореактора (Rose, 1979; Burrows, 1979; EPA, 1995; Rendez-Gil, Sanz and Priteo, 1999; Ди Серио и др. , 2001; Ди Серио, Тессер и Сантачесария, 2001). Однако, помимо этой простой концепции, промышленное производство направлено на эффективное преобразование сахарного сырья в биомассу дрожжей, главным образом на более поздних стадиях, когда объем биомассы велик.Эффективное преобразование сахара в дрожжевой белок требует, чтобы производство анаэробных метаболитов, таких как этанол и ацетальдегид (Bauer et al. , 1999) было сведено к минимуму, , т.е. , чтобы метаболизм сахара был отклонен в сторону окислительного пути для достижения максимального выхода энергии АТФ. и образование биомассы (Van Hoek, Van Dijken and Pronk, 1998). Кроме того, токсичны такие продукты ферментации, как этанол и, в частности, ацетальдегид. Эта проблема становится особенно актуальной при культивировании с высокой плотностью биомассы (Hensing et al., 1995; ван Дейкен, Weusthuis and Pronk, 1993).
Общеизвестно, что видов Saccharomyces cerevisiae имеют тенденцию к гликолитическому метаболизму глюкозы при избытке глюкозы даже в полностью аэробных условиях с образованием этанола, явление, известное как эффект Крэбтри (Käppeli, 1986; Sonnleitner and Käppeli, 1986; Verduyn, 1991; Dynesen). , 1998). Кроме того, было показано, что не только глюкоза, но и фруктоза запускает репрессию катаболитов у штаммов Saccharomyces cerevisiae (Dynesen, 1998).Эта катаболитная репрессия приводит к низкому выходу биомассы при культивировании Saccharomyces cerevisiae в периодических культурах и отрицательно влияет на урожай биомассы из-за низкого выхода АТФ при спиртовой ферментации. Несмотря на это, образование биомассы может быть достигнуто множеством метаболических путей (Frick and Whitmann, 2005), а выход биомассы на субстрат может достигать значений до 50% при чистом окислительном росте (Akinyemi, Betiku and Solomon, 2005).
Для преодоления этих ограничений на производство биомассы дрожжей большое значение имеют две важные переменные: скорость переноса кислорода и концентрация глюкозы в бульоне.В гетерогенных газожидкостных реакциях например , при аэробной ферментации жидкая фаза контролирует процессы массопереноса из-за относительной нерастворимости газов. Это ограничение сводится к минимуму за счет использования реакторов с барботажными колоннами из-за их хорошей передачи кислорода при низкой стоимости эксплуатации по сравнению с реакторами с мешалкой (Kantarcia, Borakb and Ulgen, 2005). Минимальная концентрация сахара в бульоне может быть достигнута при использовании периодического процесса с подпиткой. Эта технологическая концепция является современной в промышленном масштабе и обеспечивает хороший выход биомассы при использовании соответствующей стратегии управления технологическим процессом.Традиционно при промышленном производстве патока или другое кормление следует стратегии, построенной на основе заводских исторических данных, и поэтому она свойственна определенному штамму и другим условиям процесса. В настоящее время не только по экономическим причинам, но и из-за экологической политики, некоторые отрасли промышленности вкладывают средства в новые стратегии управления технологическими процессами, чтобы избежать выбросов токсичных загрязнителей (EPA, 1995). В научной литературе можно найти множество статей о производстве пекарских дрожжей, посвященных моделированию роста дрожжей и направленных на достижение различных целей, таких как продуктивность, урожайность и качество дрожжей, а также о новых и надежных онлайн-датчиках (Reyman, 1992; Rigbom, Rothberg and Saxen, 1996; Rendez-Gil, Sanz and Priteo, 1999; Jones and Kompala, 1999; Di Serio et al., 2001; Ди Серио, Тессер и Сантачесария, 2001 г .; Солей, 2005). Однако существует несколько простых теоретических моделей производства дрожжевой биомассы, которые могут быть применимы к любому штамму и процессу и могут быть применимы в промышленных масштабах.
Таким образом, цель настоящей работы заключалась в разработке и экспериментальной реализации простой теоретической модели роста дрожжей, основанной на нескольких параметрах, с целью достижения стратегии кормления с ограничением глюкозы, применимой в промышленных масштабах. Для этой цели была разработана электронная таблица, в которой теоретическая модель могла прогнозировать в каждом временном интервале потребности дрожжевых клеток в питательных веществах на основе двух основных входных данных: теоретической удельной скорости роста и начальной биомассы клеток.Модель была проверена в лабораторном эксперименте. Производство биомассы осуществляли в 5-литровом реакторе с барботажной колонной с использованием коммерческого штамма пекарских дрожжей. Первые две стадии размножения дрожжевых клеток, распространенные в промышленных процессах, были смоделированы экспериментально с использованием патоки сахарного тростника в качестве источника углерода.
Материалы и методы
Операционная система
Операционная система показана на. Конструкция реактора, использованная в данной работе, представляла собой цилиндрический корпус из акрила на 5 штук.Объем 5 литров с коническим дном. На конце конического дна была присоединена трубка диаметром 1 см для входа воздуха без какого-либо воздухораспределителя. К конструкции были добавлены пять равноотстоящих поперечных перегородок с 4 отверстиями для создания турбулентности и сдвига, которые могли разрушить пузырьки воздуха. Конструкция также включала небольшие выпускные трубки, из которых можно было подавать мелассу, а ячейки могли циркулировать через теплообменник со стеклянной спиралью, соединенный с термостатической ванной на 34 ° C. Аэрация оценивалась путем уменьшения типичных промышленных условий: 0.3 vvm для первой стадии и 1.3 vvm для второй стадии. Уменьшение масштаба основывалось на критерии геометрического подобия реакторов и одинакового коэффициента массоотдачи (k La1 = k La2 ) (Aiba, 1971). Это привело к 2,5 vvm (9 л / мин) для первой ступени и 1,3 vvm (приблизительно 30 л / мин) для второй стадии. Реактор был предварительно промыт 5% -ным раствором гидроксида натрия для предотвращения чрезмерного бактериального заражения.
Операционная система: (1) акриловый сосуд, (2) колба для мелассы, (3) теплообменник со стеклянным змеевиком, (4) термостатическая ванна, (5) ротаметр, (6) перистальтические насосы Masterflex и (7) двухзначные весы.
Микроорганизм
Микроорганизм, оцениваемый в этом анализе, представлял собой коммерческий штамм пекарских дрожжей Saccharomyces cerevisiae , названный Y167, из коллекции дрожжей CPQBA. Этот штамм был выбран из-за его известной характеристики — высокой скорости роста клеток. Микроорганизм сохраняли в картофельном агаре с декстрозой (КПК), погруженном в минеральное масло, и хранили при 4 ° C. Размножение инициировали переносом консервированных микроорганизмов на свежий скошенный PDA, который инкубировали при 32 ° C в течение 24 часов.
Инокулят
Использованный инокулят был приготовлен в 250 мл колбах Эрленмайера со 100 мл стерилизованной среды (15 мин 121 ° C), состоящей из: 150 г / л сахарозы, 6 г / л дрожжевого экстракта, 5 г / л фосфата калия. одноосновный, 5 г / л хлорида аммония, 1 г / л сульфата магния и 1 г / л хлорида калия. Дрожжи, выращенные в скошенном PDA в течение 24 ч при 32 ° C, ресуспендировали в стерилизованной воде и инокулировали в концентрации 10% от общего объема ферментационной среды. Колбы инкубировали на шейкере 24 ч при 32 ° C и 150 об / мин.
Кормовой субстрат
Источник углерода, используемый во всех анализах, происходил из одной единственной партии патоки сахарного тростника с бразильского сахарного завода. Этот образец мелассы имел температуру 80 ° Brix с общим содержанием сахара около 56%, и его удобно разбавляли дистиллированной водой для использования в анализах. Одноосновный фосфат калия (KH 2 PO 4 ) использовали в качестве источника фосфора, а хлорид аммония (NH 4 Cl) в качестве источника азота. Другие витамины и питательные вещества уже присутствуют в патоке сахарного тростника в достаточных количествах, так что ферментационный бульон был обогащен только указанными солями, чтобы гарантировать снабжение азотом и фосфором.
Первая стадия роста клеток
Реактор был заполнен 3,5 литрами разбавленной патоки сахарного тростника с температурой приблизительно 15 ° Brix, предварительно стерилизованной в течение 10 минут при 121 ° C. Мелассу обогащали KH 2 PO 4 и NH 4 Cl, и ее pH доводили до 4,5, оптимального pH для большинства штаммов Saccharomyces cerevisiae (Rose, 1987). Необходимое количество сырой мелассы и солей азота и фосфора было рассчитано на основе имитатора электронных таблиц.В реакторе инкубировали 45 мл дрожжей, выращенных в колбе. Эту первую стадию роста клеток проводили в течение 16 часов при уровне аэрации 9 л / мин. Этот этап проводился без периодического отбора проб и с избытком источника углерода, поскольку целью этого этапа является получение максимального увеличения биомассы в ущерб потерям биомассы на выходе субстрата (оценивается в 0,22) и высокой продуктивности. Через 16 часов реактор опустошили и промыли водой, а часть ферментационного бульона первой стадии использовали в качестве инокулята для второй стадии.В промышленном процессе объем биореакторов постепенно увеличивается, так что объем биореактора первой ступени спроектирован таким образом, чтобы составлять около 15-20% от объема биореактора второй ступени, а весь ферментационный бульон первой ступени перемещается во вторую ступень. стадия биореактора для продолжения размножения дрожжевой биомассы. Из-за отсутствия в лаборатории биореактора большего размера, анализ второй стадии проводили в том же акриловом сосуде первой стадии и в количестве ферментационного бульона первой стадии, соответствующем 16% от конечного рабочего объема (3.5 литров), использовали в качестве посевного материала на втором этапе.
Вторая стадия роста клеток
Очищенный реактор был заполнен 2 литрами дистиллированной воды. Это количество было рассчитано на основе данных электронной таблицы для получения окончательного рабочего объема 3,5 литра. Эта операция добавления воды является обычной в промышленном производстве биомассы дрожжей, чтобы минимизировать концентрацию этанола, образующуюся на первой стадии размножения, которая может ингибировать рост клеток на следующей стадии. Затем в реактор залили 560 мл (16% 3.5 литров) ферментационного бульона с первой стадии, pH которого предварительно был доведен до 4,5 с помощью 2 н. HCl. Вторую стадию роста клеток проводили в течение 12 часов при уровне аэрации 30 л / мин. Разбавленную мелассу (40 ° Brix), предварительно стерилизованную в течение 10 мин при 121 ° C, постепенно подавали перистальтическим насосом. Скорость подачи контролировали путем взвешивания колбы с патокой на двухзначных весах. Каждый час к ферментационному бульону добавляли определенную аликвоту 10% (мас. / Мас.) Одноосновного раствора фосфата калия и 10% (мас. / Мас.) Раствора хлорида аммония.Массу мелассы и аликвоты растворов азота и фосфора, подаваемые в каждый временной интервал, рассчитывали на основе имитатора электронной таблицы производства биомассы.
Отбор проб из биореактора
На первом этапе отбирали две пробы по 10 мл в 0 ч и в 16 ч, а на втором этапе каждый час отбирали пробу 10 мл для измерения биомассы (стандартный метод для сухой клеточная масса) и анализы фруктозы, глюкозы и сахарозы (ВЭЖХ). Образец объемом 10 мл центрифугировали при 4000 об / мин и 4 мин в градуированных центрифужных пробирках.Супернатант разбавляли для анализа ВЭЖХ в хроматографической системе Dionex с колонкой CarboPac PA1 и импульсным амперометрическим детектированием. Объем влажных клеток использовали для оценки концентрации клеток в бульоне с учетом того, что масса сухих клеток (г) приблизительно равна 25% от объема влажных клеток (мл). Центрифугированные клетки промывали дистиллированной водой и центрифугировали два раза после переноса в предварительно взвешенные чашки. Клетки сушили при 60 ± 5 ° C до постоянного веса.
Электронная таблица производства биомассы
Электронная таблица была разработана для моделирования роста дрожжевых клеток и прогнозирования их потребностей в питании в периодическом процессе с подпиткой при ограниченной концентрации глюкозы.Образец роста клеток был установлен как экспоненциальный в соответствии с общим уравнением X = X 0 EXP (v 0 .t), где X обозначает микробную биомассу в момент времени t, X 0 микробную биомассу в момент времени t = 0, t время. в часах (ч) и v 0 — удельная скорость роста (h −1 ). Увеличение биомассы в каждом часовом интервале может быть рассчитано после ввода начальной клеточной массы (X 0 ) an ± te (μ). Потребности в питательных веществах (источник углерода, азота и фосфора) рассчитывались на основе (i) среднего состава элементов (% масс.) В клетках (% по массе) углерода, азота и фосфора (Atkinson and Mavituna, 1991; Lange and Heijnem, 2001) и ( ii) масса дрожжевых клеток в реакторе каждый раз (X (t)).Считалось, что только 50% израсходованного углерода преобразовалось в биомассу, , то есть , выход биомассы на субстрат (Y X / S ) равен 0,5. показывает основу электронных таблиц, реализованную в программном обеспечении Microsoft Excel. показывает определения переменных, используемых в имитаторе электронных таблиц.
Таблица 1
Основа имитатора электронных таблиц.
| Колонка | Переменная | Символ | Единица | Формула | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | время | t | h | X (т) | г | = X0 * exp (μ¯ * t) | ||||||||||
| 3 | Масса углерода в ячейках в момент времени t | C (t) | г | = CF * X (t) | ||||||||||||
| 4 | Масса азота в ячейках в момент времени t | N (t) | г | = NF * X (t) | ||||||||||||
| 5 | Масса фосфора в клетках в момент времени t | P (t) | г | = PF * X (t) | ||||||||||||
| 6 | Потребность в углероде | ΔC (t) | г | = C (t + 1) — C (t) | ||||||||||||
| 7 | Общая потребность в редуцирующем сахаре | ΔTRS (t) | г | = ΔC (t) / (H * Y X / S ) | ||||||||||||
| 8 | Потребность в разбавленной мелассе | ΔM (t) | г | = ΔTRS (t) * d / MP | ||||||||||||
| 9 | Потребность в азоте | ΔN (t) | г | = N (t + 1) — N (t) | ||||||||||||
| 10 | 10% NH 4 Аликвота раствора CL | ΔNS (t) | мл | = ΔN (t) * W / NFS | ||||||||||||
| 11 | Потребность в фосфоре | ΔP (t) | г | = P (t + 1) — P (t) | ||||||||||||
| 12 | 10% KH 2 PO 4 аликвота раствора | ΔPS (t) | мл | = ΔP (t) * W / PFS |
Таблица 2
Определение переменных.
| Переменная | Значение | Определение | Ед. Удельная скорость роста | ч −1 | |
|---|---|---|---|---|---|
| FC | 0,47 | Массовая доля углерода в дрожжевой клетке | — | ||
| NF | 0.085 | Массовая доля азота в дрожжевой клетке | — | ||
| PF | PF | PF | 0,0113 | Массовая доля фосфора в дрожжевой клетке | — |
| H | 0,4 | гексагональная фракция углерода||||
| Y X / S | 0,5 | Выход биомассы на субстрате | — | ||
| d | Требуется установка | Коэффициент разбавления мелассы | — | MP | |
| MP | |||||
| Меласса Чистота сахара (TRS на мелассу, г / г) | вес / вес | ||||
| NFS | 0.26 | Массовая доля азота в NH 4 Cl | — | ||
| PFS | 0,23 | Массовая доля фосфора в KH 2 PO 4 | — | W Концентрация соли | % мас. / Мас. |
Результаты
Расчетная таблица, используемая для оценки необходимого количества питательных веществ на первом этапе анализа, показана на. Необходимое количество сырой мелассы и солей азота и фосфора рассчитывалось с учетом содержания биомассы в реакторе 70 г в конце первой стадии.Это соображение было сделано на основе оценки увеличения биомассы в 100 раз, с 0,7 г до 70 г общей биомассы, без учета модели экспоненциального роста. Расчетная таблица, использованная во втором этапе анализа, показана на. Была принята удельная скорость роста 0,18 ч -1 и ожидаемая начальная масса клеток 7,0 г, оцененная по объему центрифугированных влажных клеток посевного материала. Чистота патоки составляла 56%, как определено сахарным HPCL (фруктоза, глюкоза и сахароза) и анализом Brix.Объем дистиллированной воды, добавленной в реактор, рассчитывали путем вычитания объема питательного вещества, добавляемого до конца 12 часов, и объема посевного материала из общего рабочего объема реактора. Плотность разбавленной мелассы составляла 1,06 г / мл. Стоит отметить, что конечный объем на втором этапе не достиг ожидаемых 3,5 л из-за потери воды, отпаренной при аэрации. Конечный объем составлял приблизительно 3 литра, и все данные о концентрации были скорректированы на основе этого эффекта.
Таблица 3
Данные электронной таблицы первого этапа, построенные со следующими входными переменными: X 0 = 0,7 г / л, Y X / S = 0,22, MP = 0,56 и d = 1.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | N (т) | P (т) | ΔC (т) | ΔTRS (т) | ΔM (т) | ΔN | ΔNS | ΔP | ΔP ) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) ) | (г) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 0.70 | 0,33 | 0,06 | 0,01 | 32,57 | 370,1 | 660,9 | 5,89 | 22,49 | 0,78 | 22,49 | 0,78 | 3,44 | 9018 5 — | — | — | — | — | — | — |
Таблица 4
Данные электронной таблицы второго этапа, построенные со следующими входными переменными: X 0 = 7.0 г / л, μ̄ = 0,18 ч −1 , MP = 0,56 и d = 2.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| t | X (t) | C (t) | N (t) | P (t) | ΔC (t) ΔTRS (т) | ΔM (т) | ΔN | ΔNS | ΔP | ΔPS | |||||||||||
| (ч) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (мл) | (г) | (мл) | ||||||||
| 0 | 7.0 | 3,29 | 0,60 | 0,08 | 0,65 | 3,2 | 11,6 | 0,12 | 4,5 | 0,02 | 0,7 | ||||||||||
| 0,7 | 9018 0,78 | 3,9 | 13,9 | 0,14 | 5,4 | 0,02 | 0,8 | ||||||||||||||
| 2 | 10,0 | 4,72 | 0,85 | 0,11 | 934,7 | 16,6 | 0,17 | 6,4 | 0,02 | 1,0 | |||||||||||
| 3 | 12,0 | 5,65 | 5,65 | 0,14 | 7,7 | 0,03 | 1,2 | ||||||||||||||
| 4 | 14,4 | 6,76 | 1,22 | 0,16 | 1,33 | 6,7 | 23,8 | 0.24 | 9,2 | 0,03 | 1,4 | ||||||||||
| 5 | 17,2 | 8,09 | 1,46 | 0,19 | 1,60 | 0,19 | 1,60 | 8,0 | 28,5 | 8,0 | 28,5 | 28,5 | 28,5 | 9018||||||||
| 6 | 20,6 | 9,69 | 1,75 | 0,23 | 1,91 | 9,6 | 34,1 | 0,35 | 13,2 | 0,05 | 2.0 | ||||||||||
| 7 | 24,7 | 11,60 | 2,10 | 0,28 | 2,29 | 11,4 | 40,8 | 0,41 | 15,8 | 9018 9018 2 | 9018 | 9018 | 2,51 | 0,33 | 2,74 | 13,7 | 48,9 | 0,50 | 18,9 | 0,07 | 2,9 |
| 9 | 35.4 | 16,62 | 3,01 | 0,40 | 3,28 | 16,4 | 58,5 | 0,59 | 22,6 | 0,08 | 3,5 | ||||||||||
| 3,93 | 19,6 | 70,1 | 0,71 | 27,1 | 0,09 | 4,1 | |||||||||||||||
| 11 | 50,7 | 23,83 | 4,31 | 0.57 | 4,70 | 23,5 | 83,9 | 0,85 | 32,5 | 0,11 | 5,0 | ||||||||||
| 12 | 60,7 | 28,53 | — | — | — | — | |||||||||||||||
| Всего | — | — | — | — | — | 126,19 | 450,68 | .3 | 0,61 | 26,7 | |||||||||||
| Исходные данные | 9018 9018 9018 9018 Объем добавленных питательных веществ 9018 9018 9018 Объем 9018 9018 1186 | ||||||||||||||||||||
| Объем инокулята (мл) | 560 | 3500 | |||||||||||||||||||
| Объем дистиллированной воды (мл) | 9018 9018 9018 9018 9018 9018 9018 | 9018 | |||||||||||||||||||
Сводные данные первого Этап и второй этап анализов роста клеток показаны в Таблице 5.На первом этапе выход биомассы достиг 0,20, как и ожидалось, в среде с избытком глюкозы, когда штаммы Saccharomyces cerevisiae предпочитают анаэробное дыхание. Увеличение биомассы достигло 112,8 раза, так что цель по высокому увеличению биомассы на этом первом этапе была достигнута. Напротив, на втором этапе общий выход биомассы был выше, достигнув 0,33, а увеличение биомассы было 6,4 раза, оба приемлемых значения для промышленного производства биомассы. Однако ожидалось, что урожай биомассы будет ближе к 0.5, как это происходит в промышленных биореакторах.
Схема роста клеток второй стадии показана на. Кривая экспоненциальной регрессии хорошо согласуется с экспериментальными данными. Удельная скорость роста составила 0,165 ч -1 , что подтверждает хорошие параметры роста штамма Y167 и хорошую начальную оценку 0,18 ч -1 .
показывает профиль концентрации биомассы. Расчетная концентрация биомассы относится к значениям, рассчитанным на основе электронной таблицы, а экспериментальная концентрация биомассы относится к значениям, рассчитанным на основе массы сухих клеток.Эти данные показывают, что после 6 часов реальная концентрация биомассы в реакторе была ниже ожидаемого значения, а питательные вещества и сахар могли быть поданы в избытке.
Профиль концентрации биомассы.
Сахарный профиль второй стадии показан на. Концентрация TRS поддерживалась ниже 1 г / л до 5 -го часа. После 6-го часа TRS увеличился примерно с 1 г / л до 3 г / л, вероятно, из-за концентрации биомассы ниже прогнозируемого значения.
Другие интересные переменные, которые должны помочь в анализе данных, представлены в. Урожай биомассы был рассчитан как мгновенный и совокупный, , т. Е. , урожай за один час (Y X / S Мгновенный в 5 -м часе относится к интервалу с 4 -го часа до 5-го часа). th час) и доходность с нулевого времени до текущего времени соответственно. Совокупный выход биомассы начинается с низкого значения 0,24, достигая максимального значения 0.45 на 6 час. После 6 -го часа можно заметить небольшую тенденцию к снижению значений до общего значения 0,33. В отличие от сахарного профиля, кумулятивное падение выхода биомассы тесно связано с увеличением TRS, что подтверждает сильную тенденцию дрожжей менять метаболизм с аэробного на анаэробное дыхание, когда в бульоне присутствует избыток сахара. Мгновенный выход биомассы показал разрозненные значения, но он следовал той же тенденции, что и кумулятивные значения.
Мгновенный и совокупный профиль выхода биомассы.
Обсуждение
На типичной установке по производству биомассы размножение дрожжей начинается так же, как и в анализе, представленном в этой работе: от скошенного агара до посевного реактора до биореакторов объемом 150 000 литров (реакторы с пузырьковыми колонками). Рост дрожжей в колбе представляет собой рост дрожжей в посевном реакторе, где стерильный рост необходим для обеспечения чистого посевного материала культуры. Первая и вторая ступени в реакторе с барботажной колонной представляют собой первую и вторую стадии размножения дрожжей в больших биореакторах.На первом этапе цель состоит в том, чтобы получить высокий прирост биомассы (продуктивности), чтобы выход биомассы на субстрат не был важной переменной, и не было необходимости в контроле кормления. На втором этапе цель состоит в том, чтобы максимизировать выход биомассы на субстрат путем постепенной подачи патоки, чтобы избежать катаболитной репрессии. Эта стратегия кормления используется от второй стадии размножения до последних биореакторов, где выход биомассы имеет большое значение для производственных затрат.Высокая плотность ячеек и большой рабочий объем, достигаемые на этих стадиях процесса, превращают потребление мелассы в значительную переменную стоимости, поэтому необходима хорошая стратегия подачи и контроль процесса.
Другой важной переменной в производстве биомассы является аэрация и перенос кислорода, поскольку выход биомассы зависит от достижения полностью аэробных условий. Это состояние нелегко смоделировать в пузырьковых реакторах в лабораторных масштабах из-за небольшой высоты реактора, которая приводит к короткому времени пребывания пузырьков воздуха.В случае анализа, представленного в этой работе, рабочая высота биореактора была слишком мала по сравнению с промышленными биореакторами, так что время пребывания пузырьков воздуха было недостаточным для достижения максимального растворенного кислорода в бульоне. Значения выхода биомассы свидетельствовали о том, что экспериментальные условия не достигли полностью аэробных условий. Таким образом, относительно низкое значение выхода биомассы, полученное в этой работе, объясняется ограниченной доступностью кислорода, вызванной плохой передачей кислорода и малым временем пребывания пузырьков воздуха, обусловленным конструкцией и размером реактора соответственно (Fiecher, Käppeli and Meussdoerffer, 1987 ).Другим фактом, который подтверждает доказательства плохой оксигенации бульона, был интенсивный запах ацетальдегида в лаборатории во время анализа, а также присутствие и постоянно растущая концентрация побочных продуктов, обнаруженных с помощью анализа ВЭЖХ (результаты не рассчитаны количественно).
Концентрация клеток в бульоне после 6 -го часа была ниже расчетного значения. Это говорит о том, что, исходя из теории электронных таблиц, количество TRS, которое подавалось с этого времени до конца эксперимента, было избыточным.Это может объяснить увеличение TRS в бульоне () и снижение значений выхода биомассы () вместе с плохой оксигенацией. В условиях более высокой плотности клеток потребление кислорода можно теоретически рассчитать и добавить в электронную таблицу, чтобы аэрация увеличивалась по мере увеличения биомассы. Узкое место оксигенации в мелкомасштабных операциях затрудняет моделирование предыдущих этапов. Он был смоделирован на стадии 3 rd (результаты здесь не показаны), но результаты ясно показали, что перенос кислорода был недостаточным, даже когда аэрация была выше 45 л / мин.Кроме того, было замечено, что клетки были серьезно повреждены, и их жизнеспособность упала до 50%. Это было связано с сильным напряжением сдвига, вызванным высокой скоростью потока пузырьков воздуха.
Выводы
Промышленное производство дрожжевой биомассы — это хорошо отработанный и простой процесс, который с годами совершенствовался с внедрением более совершенной концепции процесса, разработки и стратегий управления. Настоящая работа сосредоточена на улучшении контроля процесса с помощью простой стратегии кормления с ограничением глюкозы.Результаты, представленные здесь, хорошо согласуются с промышленными реалиями, и имитатор электронных таблиц может быть полезным инструментом в эксплуатации и управлении процессом производства биомассы.
Выражение признательности
CAPES, Бразильская организация по координации совершенствования кадров высшего образования, за стипендию, присужденную первому автору.
Ссылки
- Aiba S. Масштабирование. В: Хамфри А.Е., Миллис Н.Ф., редакторы. Биохимическая инженерия. Токийский университет прессы; Токио: 1971.[Google Scholar]
- Акинеми О.П., Бетику Э., Соломон Б.О. Канал субстрата и энергетика Saccharomyces cerevisiae DSM 2155, выращенного на глюкозе в процессе периодической ферментации с подпиткой. Afr J Biotechnol. 2005; 2: 96–103. [Google Scholar]
- Аткинсон Б., Мавитуна Ф. Справочник по биохимической инженерии и биотехнологии. Stockton Press; 1991. с. 120. [Google Scholar]
- Bauer J, Luttik MAH, Flores CL, van Dijken JP, Pronk JT, Niederberger P. Образование побочных продуктов при воздействии на дышащие культуры Saccharomyces cerevisiae избытка глюкозы не вызвано ограниченной способностью пирувата. карбоксилаза.FEMS Microbiol Lett. 1999. 179: 107–113. [PubMed] [Google Scholar]
- Beudeker RF, van Dam HW, van der Plaat JB, Vellenga K. Развитие производства пекарских дрожжей. В: Verachtert H, DeMot R, редакторы. Биотехнология и биокатализ дрожжей. Марсель Деккер; Нью-Йорк: 1990. С. 103–146. [Google Scholar]
- Дрожжи Берроуза С. Бэкера. В: Роуз А.Х., редактор. Микробная биомасса. Vol. 4. Академическая пресса; Нью-Йорк: 1979. С. 30–63. [Google Scholar]
- Di Serio M, De Alteriis E, Parascandola P, Santacesaria E.Общая кинетическая модель и модель массопереноса для моделирования роста пекарских дрожжей в биореакторах. Катал сегодня. 2001; 66: 437–445. [Google Scholar]
- Ди Серио М., Тессер Р., Сантачесария Э. Кинетическая и массообменная модель для моделирования роста пекарских дрожжей в промышленных биореакторах. Chem Eng J. 2001; 82: 347–354. [Google Scholar]
- Динесен Дж., Смитс Х.П., Олссон Л., Нильсен Дж. Углеродная катаболическая репрессия инвертазы при периодическом культивировании Saccharomyces cerevisiae: роль глюкозы, фруктозы и маннозы.Appl Microbiol Biotechnol. 1998. 50: 579–582. [PubMed] [Google Scholar]
- EPA. Производство дрожжей. [Доступ 20 июня 2011 г.]; Compilation of Air Pollutant Emission Factors: AP-42. (Пятое издание). Том I 1995 г. (глава 9.13.4) Доступно по адресу: http://www.epa.gov/ttn/chief/ap42. [Google Scholar]
- Фихер А., Каппели О., Мейсдёрфер Ф. Баня и непрерывная культура. В: Rose AH, Harrison JS, редакторы. Дрожжи. 2-е издание. Vol. 2. Академическая пресса; Нью-Йорк: 1987. С. 99–129. [Google Scholar]
- Фрик О., Витманн К.Характеристика метаболического сдвига между окислительным и ферментативным ростом у Saccharomyces cerevisiae с помощью сравнительного анализа потока 13 C. Фабрики микробных клеток. 2005; 4:30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Halasz A, Lasztity R. Использование биомассы дрожжей в производстве продуктов питания. CRC Press; Бока-Ратон, Флорида: 1991. стр. 312. [Google Scholar]
- Hensing MCM, Rouwenhorst RJ, Heijnen JJ, van Dijken JP, Pronk JT. Физиологические и технологические аспекты крупномасштабного производства гетерологичных белков дрожжами.Антон ван Ли. 1995. 67: 261–279. [PubMed] [Google Scholar]
- ван Дейкен, JP, Weusthuis RA, Pronk JT. Кинетика роста и потребления сахара дрожжами. Антон ван Ли. 1993; 63: 343–352. [PubMed] [Google Scholar]
- Джонс К.Д., Компала Д.С. Кибернетическая модель динамики роста Saccharomyces cerevisiae в периодических и непрерывных культурах. J Biotechnol. 1999. 71: 105–131. [PubMed] [Google Scholar]
- Kantarcia N, Borakb F, Ulgen KO. Реакторы барботажные колонны. Process Biochem.2005; 40: 2263–2283. [Google Scholar]
- Каппели О. Регулирование углеродного обмена у Saccharomyces cerevisiae и родственных дрожжей. Adv Microb Physiol. 1986; 28: 181–209. [PubMed] [Google Scholar]
- Lange HC, Heijnen JJ. Статистическое согласование элементного и молекулярного состава биомассы Saccharomyces cerevisiae. Biotechnol Bioeng. 2001; 75: 334–344. [PubMed] [Google Scholar]
- Rendez-Gil F, Sanz P, Prieto JA. Технические пекарские дрожжи: есть над чем работать.Trends Biotechnol. 1999; 17: 237–244. [PubMed] [Google Scholar]
- Рейман Г. Моделирование и контроль периодической ферментации пекарских дрожжей с подпиткой. Пищевой контроль. 1992; 3: 33–44. [Google Scholar]
- Рингбом К., Ротберг А., Саксен Б. Автоматизация производства пекарских дрожжей на основе моделей. J Biotechnol. 1996; 51: 73–82. [PubMed] [Google Scholar]
- Rose AH. История и научные основы крупномасштабного производства микробной биомассы. В: Роуз А.Х., редактор. Микробная биомасса. Vol. 4. Академическая пресса; Нью-Йорк: 1979.С. 1–29. [Google Scholar]
- Rose AH. Реакция на химическую среду. В: Rose AH, Harrison JS, редакторы. Дрожжи. 2-е издание. Vol. 2. Академическая пресса; Нью-Йорк: 1987. С. 5–40. [Google Scholar]
- Soley A, Lecina M, Gámez X, Cairó JJ, Riu P, Rosell X, Bragós R., Gòdia F. Онлайн-мониторинг роста дрожжевых клеток с помощью импедансной спектроскопии. J Biotechnol. 2005. 118: 398–405. [PubMed] [Google Scholar]
- Зоннлейтнер Б., Кэппели О. Рост Saccharomyces cerevisiae контролируется его ограниченной дыхательной способностью: формулировка и проверка гипотезы.Biotechnol Bioeng. 1986; 28: 927–937. [PubMed] [Google Scholar]
- ван Хук П., Ван Дейкен Дж., Пронк Дж. Влияние удельной скорости роста на ферментативную способность пекарских дрожжей. Appl Environ Microbiol. 1998; 64: 4226–4233. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Verduyn C. Физиология дрожжей в зависимости от урожайности биомассы. Антон ван Ли. 1991; 60: 325–53. [PubMed] [Google Scholar]
новый подход к стратегии кормления с ограничением глюкозы
Braz J Microbiol.2013; 44 (2): 551–558.
Эрика Дуран Виейра
1 Faculdade de Engenharia Química, Universidade Estadual de Campinas, Campinas, SP, Brazil.
Мария да Граса Ступиелло Андриетта
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
Silvio Roberto Andrietta
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
1 Faculdade de Engenharia Química, Universidade Estadual de Campinas, Кампинас, SP, Бразилия.
2 Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas, Universidade Estadual de Campinas, Paulínia, SP, Brazil.
Отправить корреспонденцию Э. Д. Виейре. Школа химической инженерии, Университет Кампинаса, Cidade Universitária «Zeferino Vaz», C.P. 6066, 13083-970, Кампинас, СП, Бразилия. Электронная почта: moc.liamg@vdakire.Поступило 27 июня 2011 г .; Принята в печать 10 сентября 2012 г.
Copyright © 2013, Sociedade Brasileira de MicrobiologiaВсе содержимое журнала, если не указано иное, находится под лицензией Creative Commons License CC BY-NC.
Эта статья цитируется в других статьях в PMC.Abstract
Целью данной работы было экспериментально реализовать простую стратегию кормления с ограничением глюкозы для производства дрожжевой биомассы в реакторе с пузырьковой колонной на основе имитатора электронных таблиц, пригодного для промышленного применения. В процессе производства биомассы с использованием штаммов Saccharomyces cerevisiae одним из ограничений является сильная тенденция этих видов к анаэробному метаболизму сахаров из-за репрессии катаболитов, что приводит к низким значениям выхода биомассы на субстрат.Обычной стратегией для контроля этой метаболической тенденции является использование периодического процесса с подпиткой, в котором источник сахара подается постепенно, а общая концентрация сахара в бульоне поддерживается ниже определенного значения. Симулятор, представленный в этой работе, был разработан для управления питанием патокой на основе простой теоретической модели, в которой были учтены потребности роста дрожжевых клеток в питательных веществах и два входных данных: теоретическая удельная скорость роста и начальная биомасса клеток. В экспериментальном анализе использовали коммерческий штамм пекарских дрожжей и патоку в качестве источника сахара.Экспериментальные результаты показали общий выход биомассы на субстрат 0,33, увеличение биомассы в 6,4 раза и удельную скорость роста 0,165 ч -1 в отличие от прогнозируемого значения 0,180 ч-1 на втором этапе моделирования.
Ключевые слова: дрожжи, биомасса, партия с подпиткой, моделирование процесса, Saccharomyces cerevisiae
Введение
Микробная биомасса является подходящим дополнительным источником белка, получаемым в процессе культивирования бактерий, дрожжей, других грибов или водорослей в Большие количества.Биомасса дрожжей широко используется в качестве добавки к человеческому или животному белку в кормах для животных или в питании человека (Halasz and Lasztity, 1991). Обычные штаммы, используемые в качестве источника одноклеточного белка, включают штаммы Saccharomyces cerevisiae и Candida utilis . Типичные продукты микробной биомассы включают пекарские дрожжи и дрожжевые экстракты, где штаммы Saccharomyces cerevisiae являются хозяевами для продукции гетерологичного белка (Beudeker et al. , 1990; Hensing et al., 1995).
По сути, концепция промышленного процесса основана на размножении клеток из чистой культуральной косой агара в большие биореакторы, увеличивая объем на каждой стадии размножения до конечного объема биореактора (Rose, 1979; Burrows, 1979; EPA, 1995; Rendez-Gil, Sanz and Priteo, 1999; Ди Серио и др. , 2001; Ди Серио, Тессер и Сантачесария, 2001). Однако, помимо этой простой концепции, промышленное производство направлено на эффективное преобразование сахарного сырья в биомассу дрожжей, главным образом на более поздних стадиях, когда объем биомассы велик.Эффективное преобразование сахара в дрожжевой белок требует, чтобы производство анаэробных метаболитов, таких как этанол и ацетальдегид (Bauer et al. , 1999) было сведено к минимуму, , т.е. , чтобы метаболизм сахара был отклонен в сторону окислительного пути для достижения максимального выхода энергии АТФ. и образование биомассы (Van Hoek, Van Dijken and Pronk, 1998). Кроме того, токсичны такие продукты ферментации, как этанол и, в частности, ацетальдегид. Эта проблема становится особенно актуальной при культивировании с высокой плотностью биомассы (Hensing et al., 1995; ван Дейкен, Weusthuis and Pronk, 1993).
Общеизвестно, что видов Saccharomyces cerevisiae имеют тенденцию к гликолитическому метаболизму глюкозы при избытке глюкозы даже в полностью аэробных условиях с образованием этанола, явление, известное как эффект Крэбтри (Käppeli, 1986; Sonnleitner and Käppeli, 1986; Verduyn, 1991; Dynesen). , 1998). Кроме того, было показано, что не только глюкоза, но и фруктоза запускает репрессию катаболитов у штаммов Saccharomyces cerevisiae (Dynesen, 1998).Эта катаболитная репрессия приводит к низкому выходу биомассы при культивировании Saccharomyces cerevisiae в периодических культурах и отрицательно влияет на урожай биомассы из-за низкого выхода АТФ при спиртовой ферментации. Несмотря на это, образование биомассы может быть достигнуто множеством метаболических путей (Frick and Whitmann, 2005), а выход биомассы на субстрат может достигать значений до 50% при чистом окислительном росте (Akinyemi, Betiku and Solomon, 2005).
Для преодоления этих ограничений на производство биомассы дрожжей большое значение имеют две важные переменные: скорость переноса кислорода и концентрация глюкозы в бульоне.В гетерогенных газожидкостных реакциях например , при аэробной ферментации жидкая фаза контролирует процессы массопереноса из-за относительной нерастворимости газов. Это ограничение сводится к минимуму за счет использования реакторов с барботажными колоннами из-за их хорошей передачи кислорода при низкой стоимости эксплуатации по сравнению с реакторами с мешалкой (Kantarcia, Borakb and Ulgen, 2005). Минимальная концентрация сахара в бульоне может быть достигнута при использовании периодического процесса с подпиткой. Эта технологическая концепция является современной в промышленном масштабе и обеспечивает хороший выход биомассы при использовании соответствующей стратегии управления технологическим процессом.Традиционно при промышленном производстве патока или другое кормление следует стратегии, построенной на основе заводских исторических данных, и поэтому она свойственна определенному штамму и другим условиям процесса. В настоящее время не только по экономическим причинам, но и из-за экологической политики, некоторые отрасли промышленности вкладывают средства в новые стратегии управления технологическими процессами, чтобы избежать выбросов токсичных загрязнителей (EPA, 1995). В научной литературе можно найти множество статей о производстве пекарских дрожжей, посвященных моделированию роста дрожжей и направленных на достижение различных целей, таких как продуктивность, урожайность и качество дрожжей, а также о новых и надежных онлайн-датчиках (Reyman, 1992; Rigbom, Rothberg and Saxen, 1996; Rendez-Gil, Sanz and Priteo, 1999; Jones and Kompala, 1999; Di Serio et al., 2001; Ди Серио, Тессер и Сантачесария, 2001 г .; Солей, 2005). Однако существует несколько простых теоретических моделей производства дрожжевой биомассы, которые могут быть применимы к любому штамму и процессу и могут быть применимы в промышленных масштабах.
Таким образом, цель настоящей работы заключалась в разработке и экспериментальной реализации простой теоретической модели роста дрожжей, основанной на нескольких параметрах, с целью достижения стратегии кормления с ограничением глюкозы, применимой в промышленных масштабах. Для этой цели была разработана электронная таблица, в которой теоретическая модель могла прогнозировать в каждом временном интервале потребности дрожжевых клеток в питательных веществах на основе двух основных входных данных: теоретической удельной скорости роста и начальной биомассы клеток.Модель была проверена в лабораторном эксперименте. Производство биомассы осуществляли в 5-литровом реакторе с барботажной колонной с использованием коммерческого штамма пекарских дрожжей. Первые две стадии размножения дрожжевых клеток, распространенные в промышленных процессах, были смоделированы экспериментально с использованием патоки сахарного тростника в качестве источника углерода.
Материалы и методы
Операционная система
Операционная система показана на. Конструкция реактора, использованная в данной работе, представляла собой цилиндрический корпус из акрила на 5 штук.Объем 5 литров с коническим дном. На конце конического дна была присоединена трубка диаметром 1 см для входа воздуха без какого-либо воздухораспределителя. К конструкции были добавлены пять равноотстоящих поперечных перегородок с 4 отверстиями для создания турбулентности и сдвига, которые могли разрушить пузырьки воздуха. Конструкция также включала небольшие выпускные трубки, из которых можно было подавать мелассу, а ячейки могли циркулировать через теплообменник со стеклянной спиралью, соединенный с термостатической ванной на 34 ° C. Аэрация оценивалась путем уменьшения типичных промышленных условий: 0.3 vvm для первой стадии и 1.3 vvm для второй стадии. Уменьшение масштаба основывалось на критерии геометрического подобия реакторов и одинакового коэффициента массоотдачи (k La1 = k La2 ) (Aiba, 1971). Это привело к 2,5 vvm (9 л / мин) для первой ступени и 1,3 vvm (приблизительно 30 л / мин) для второй стадии. Реактор был предварительно промыт 5% -ным раствором гидроксида натрия для предотвращения чрезмерного бактериального заражения.
Операционная система: (1) акриловый сосуд, (2) колба для мелассы, (3) теплообменник со стеклянным змеевиком, (4) термостатическая ванна, (5) ротаметр, (6) перистальтические насосы Masterflex и (7) двухзначные весы.
Микроорганизм
Микроорганизм, оцениваемый в этом анализе, представлял собой коммерческий штамм пекарских дрожжей Saccharomyces cerevisiae , названный Y167, из коллекции дрожжей CPQBA. Этот штамм был выбран из-за его известной характеристики — высокой скорости роста клеток. Микроорганизм сохраняли в картофельном агаре с декстрозой (КПК), погруженном в минеральное масло, и хранили при 4 ° C. Размножение инициировали переносом консервированных микроорганизмов на свежий скошенный PDA, который инкубировали при 32 ° C в течение 24 часов.
Инокулят
Использованный инокулят был приготовлен в 250 мл колбах Эрленмайера со 100 мл стерилизованной среды (15 мин 121 ° C), состоящей из: 150 г / л сахарозы, 6 г / л дрожжевого экстракта, 5 г / л фосфата калия. одноосновный, 5 г / л хлорида аммония, 1 г / л сульфата магния и 1 г / л хлорида калия. Дрожжи, выращенные в скошенном PDA в течение 24 ч при 32 ° C, ресуспендировали в стерилизованной воде и инокулировали в концентрации 10% от общего объема ферментационной среды. Колбы инкубировали на шейкере 24 ч при 32 ° C и 150 об / мин.
Кормовой субстрат
Источник углерода, используемый во всех анализах, происходил из одной единственной партии патоки сахарного тростника с бразильского сахарного завода. Этот образец мелассы имел температуру 80 ° Brix с общим содержанием сахара около 56%, и его удобно разбавляли дистиллированной водой для использования в анализах. Одноосновный фосфат калия (KH 2 PO 4 ) использовали в качестве источника фосфора, а хлорид аммония (NH 4 Cl) в качестве источника азота. Другие витамины и питательные вещества уже присутствуют в патоке сахарного тростника в достаточных количествах, так что ферментационный бульон был обогащен только указанными солями, чтобы гарантировать снабжение азотом и фосфором.
Первая стадия роста клеток
Реактор был заполнен 3,5 литрами разбавленной патоки сахарного тростника с температурой приблизительно 15 ° Brix, предварительно стерилизованной в течение 10 минут при 121 ° C. Мелассу обогащали KH 2 PO 4 и NH 4 Cl, и ее pH доводили до 4,5, оптимального pH для большинства штаммов Saccharomyces cerevisiae (Rose, 1987). Необходимое количество сырой мелассы и солей азота и фосфора было рассчитано на основе имитатора электронных таблиц.В реакторе инкубировали 45 мл дрожжей, выращенных в колбе. Эту первую стадию роста клеток проводили в течение 16 часов при уровне аэрации 9 л / мин. Этот этап проводился без периодического отбора проб и с избытком источника углерода, поскольку целью этого этапа является получение максимального увеличения биомассы в ущерб потерям биомассы на выходе субстрата (оценивается в 0,22) и высокой продуктивности. Через 16 часов реактор опустошили и промыли водой, а часть ферментационного бульона первой стадии использовали в качестве инокулята для второй стадии.В промышленном процессе объем биореакторов постепенно увеличивается, так что объем биореактора первой ступени спроектирован таким образом, чтобы составлять около 15-20% от объема биореактора второй ступени, а весь ферментационный бульон первой ступени перемещается во вторую ступень. стадия биореактора для продолжения размножения дрожжевой биомассы. Из-за отсутствия в лаборатории биореактора большего размера, анализ второй стадии проводили в том же акриловом сосуде первой стадии и в количестве ферментационного бульона первой стадии, соответствующем 16% от конечного рабочего объема (3.5 литров), использовали в качестве посевного материала на втором этапе.
Вторая стадия роста клеток
Очищенный реактор был заполнен 2 литрами дистиллированной воды. Это количество было рассчитано на основе данных электронной таблицы для получения окончательного рабочего объема 3,5 литра. Эта операция добавления воды является обычной в промышленном производстве биомассы дрожжей, чтобы минимизировать концентрацию этанола, образующуюся на первой стадии размножения, которая может ингибировать рост клеток на следующей стадии. Затем в реактор залили 560 мл (16% 3.5 литров) ферментационного бульона с первой стадии, pH которого предварительно был доведен до 4,5 с помощью 2 н. HCl. Вторую стадию роста клеток проводили в течение 12 часов при уровне аэрации 30 л / мин. Разбавленную мелассу (40 ° Brix), предварительно стерилизованную в течение 10 мин при 121 ° C, постепенно подавали перистальтическим насосом. Скорость подачи контролировали путем взвешивания колбы с патокой на двухзначных весах. Каждый час к ферментационному бульону добавляли определенную аликвоту 10% (мас. / Мас.) Одноосновного раствора фосфата калия и 10% (мас. / Мас.) Раствора хлорида аммония.Массу мелассы и аликвоты растворов азота и фосфора, подаваемые в каждый временной интервал, рассчитывали на основе имитатора электронной таблицы производства биомассы.
Отбор проб из биореактора
На первом этапе отбирали две пробы по 10 мл в 0 ч и в 16 ч, а на втором этапе каждый час отбирали пробу 10 мл для измерения биомассы (стандартный метод для сухой клеточная масса) и анализы фруктозы, глюкозы и сахарозы (ВЭЖХ). Образец объемом 10 мл центрифугировали при 4000 об / мин и 4 мин в градуированных центрифужных пробирках.Супернатант разбавляли для анализа ВЭЖХ в хроматографической системе Dionex с колонкой CarboPac PA1 и импульсным амперометрическим детектированием. Объем влажных клеток использовали для оценки концентрации клеток в бульоне с учетом того, что масса сухих клеток (г) приблизительно равна 25% от объема влажных клеток (мл). Центрифугированные клетки промывали дистиллированной водой и центрифугировали два раза после переноса в предварительно взвешенные чашки. Клетки сушили при 60 ± 5 ° C до постоянного веса.
Электронная таблица производства биомассы
Электронная таблица была разработана для моделирования роста дрожжевых клеток и прогнозирования их потребностей в питании в периодическом процессе с подпиткой при ограниченной концентрации глюкозы.Образец роста клеток был установлен как экспоненциальный в соответствии с общим уравнением X = X 0 EXP (v 0 .t), где X обозначает микробную биомассу в момент времени t, X 0 микробную биомассу в момент времени t = 0, t время. в часах (ч) и v 0 — удельная скорость роста (h −1 ). Увеличение биомассы в каждом часовом интервале может быть рассчитано после ввода начальной клеточной массы (X 0 ) an ± te (μ). Потребности в питательных веществах (источник углерода, азота и фосфора) рассчитывались на основе (i) среднего состава элементов (% масс.) В клетках (% по массе) углерода, азота и фосфора (Atkinson and Mavituna, 1991; Lange and Heijnem, 2001) и ( ii) масса дрожжевых клеток в реакторе каждый раз (X (t)).Считалось, что только 50% израсходованного углерода преобразовалось в биомассу, , то есть , выход биомассы на субстрат (Y X / S ) равен 0,5. показывает основу электронных таблиц, реализованную в программном обеспечении Microsoft Excel. показывает определения переменных, используемых в имитаторе электронных таблиц.
Таблица 1
Основа имитатора электронных таблиц.
| Колонка | Переменная | Символ | Единица | Формула | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | время | t | h | X (т) | г | = X0 * exp (μ¯ * t) | ||||||||||
| 3 | Масса углерода в ячейках в момент времени t | C (t) | г | = CF * X (t) | ||||||||||||
| 4 | Масса азота в ячейках в момент времени t | N (t) | г | = NF * X (t) | ||||||||||||
| 5 | Масса фосфора в клетках в момент времени t | P (t) | г | = PF * X (t) | ||||||||||||
| 6 | Потребность в углероде | ΔC (t) | г | = C (t + 1) — C (t) | ||||||||||||
| 7 | Общая потребность в редуцирующем сахаре | ΔTRS (t) | г | = ΔC (t) / (H * Y X / S ) | ||||||||||||
| 8 | Потребность в разбавленной мелассе | ΔM (t) | г | = ΔTRS (t) * d / MP | ||||||||||||
| 9 | Потребность в азоте | ΔN (t) | г | = N (t + 1) — N (t) | ||||||||||||
| 10 | 10% NH 4 Аликвота раствора CL | ΔNS (t) | мл | = ΔN (t) * W / NFS | ||||||||||||
| 11 | Потребность в фосфоре | ΔP (t) | г | = P (t + 1) — P (t) | ||||||||||||
| 12 | 10% KH 2 PO 4 аликвота раствора | ΔPS (t) | мл | = ΔP (t) * W / PFS |
Таблица 2
Определение переменных.
| Переменная | Значение | Определение | Ед. Удельная скорость роста | ч −1 | |
|---|---|---|---|---|---|
| FC | 0,47 | Массовая доля углерода в дрожжевой клетке | — | ||
| NF | 0.085 | Массовая доля азота в дрожжевой клетке | — | ||
| PF | PF | PF | 0,0113 | Массовая доля фосфора в дрожжевой клетке | — |
| H | 0,4 | гексагональная фракция углерода||||
| Y X / S | 0,5 | Выход биомассы на субстрате | — | ||
| d | Требуется установка | Коэффициент разбавления мелассы | — | MP | |
| MP | |||||
| Меласса Чистота сахара (TRS на мелассу, г / г) | вес / вес | ||||
| NFS | 0.26 | Массовая доля азота в NH 4 Cl | — | ||
| PFS | 0,23 | Массовая доля фосфора в KH 2 PO 4 | — | W Концентрация соли | % мас. / Мас. |
Результаты
Расчетная таблица, используемая для оценки необходимого количества питательных веществ на первом этапе анализа, показана на. Необходимое количество сырой мелассы и солей азота и фосфора рассчитывалось с учетом содержания биомассы в реакторе 70 г в конце первой стадии.Это соображение было сделано на основе оценки увеличения биомассы в 100 раз, с 0,7 г до 70 г общей биомассы, без учета модели экспоненциального роста. Расчетная таблица, использованная во втором этапе анализа, показана на. Была принята удельная скорость роста 0,18 ч -1 и ожидаемая начальная масса клеток 7,0 г, оцененная по объему центрифугированных влажных клеток посевного материала. Чистота патоки составляла 56%, как определено сахарным HPCL (фруктоза, глюкоза и сахароза) и анализом Brix.Объем дистиллированной воды, добавленной в реактор, рассчитывали путем вычитания объема питательного вещества, добавляемого до конца 12 часов, и объема посевного материала из общего рабочего объема реактора. Плотность разбавленной мелассы составляла 1,06 г / мл. Стоит отметить, что конечный объем на втором этапе не достиг ожидаемых 3,5 л из-за потери воды, отпаренной при аэрации. Конечный объем составлял приблизительно 3 литра, и все данные о концентрации были скорректированы на основе этого эффекта.
Таблица 3
Данные электронной таблицы первого этапа, построенные со следующими входными переменными: X 0 = 0,7 г / л, Y X / S = 0,22, MP = 0,56 и d = 1.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | N (т) | P (т) | ΔC (т) | ΔTRS (т) | ΔM (т) | ΔN | ΔNS | ΔP | ΔP ) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) ) | (г) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 0.70 | 0,33 | 0,06 | 0,01 | 32,57 | 370,1 | 660,9 | 5,89 | 22,49 | 0,78 | 22,49 | 0,78 | 3,44 | 9018 5 — | — | — | — | — | — | — |
Таблица 4
Данные электронной таблицы второго этапа, построенные со следующими входными переменными: X 0 = 7.0 г / л, μ̄ = 0,18 ч −1 , MP = 0,56 и d = 2.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| t | X (t) | C (t) | N (t) | P (t) | ΔC (t) ΔTRS (т) | ΔM (т) | ΔN | ΔNS | ΔP | ΔPS | |||||||||||
| (ч) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (г) | (мл) | (г) | (мл) | ||||||||
| 0 | 7.0 | 3,29 | 0,60 | 0,08 | 0,65 | 3,2 | 11,6 | 0,12 | 4,5 | 0,02 | 0,7 | ||||||||||
| 0,7 | 9018 0,78 | 3,9 | 13,9 | 0,14 | 5,4 | 0,02 | 0,8 | ||||||||||||||
| 2 | 10,0 | 4,72 | 0,85 | 0,11 | 934,7 | 16,6 | 0,17 | 6,4 | 0,02 | 1,0 | |||||||||||
| 3 | 12,0 | 5,65 | 5,65 | 0,14 | 7,7 | 0,03 | 1,2 | ||||||||||||||
| 4 | 14,4 | 6,76 | 1,22 | 0,16 | 1,33 | 6,7 | 23,8 | 0.24 | 9,2 | 0,03 | 1,4 | ||||||||||
| 5 | 17,2 | 8,09 | 1,46 | 0,19 | 1,60 | 0,19 | 1,60 | 8,0 | 28,5 | 8,0 | 28,5 | 28,5 | 28,5 | 9018||||||||
| 6 | 20,6 | 9,69 | 1,75 | 0,23 | 1,91 | 9,6 | 34,1 | 0,35 | 13,2 | 0,05 | 2.0 | ||||||||||
| 7 | 24,7 | 11,60 | 2,10 | 0,28 | 2,29 | 11,4 | 40,8 | 0,41 | 15,8 | 9018 9018 2 | 9018 | 9018 | 2,51 | 0,33 | 2,74 | 13,7 | 48,9 | 0,50 | 18,9 | 0,07 | 2,9 |
| 9 | 35.4 | 16,62 | 3,01 | 0,40 | 3,28 | 16,4 | 58,5 | 0,59 | 22,6 | 0,08 | 3,5 | ||||||||||
| 3,93 | 19,6 | 70,1 | 0,71 | 27,1 | 0,09 | 4,1 | |||||||||||||||
| 11 | 50,7 | 23,83 | 4,31 | 0.57 | 4,70 | 23,5 | 83,9 | 0,85 | 32,5 | 0,11 | 5,0 | ||||||||||
| 12 | 60,7 | 28,53 | — | — | — | — | |||||||||||||||
| Всего | — | — | — | — | — | 126,19 | 450,68 | .3 | 0,61 | 26,7 | |||||||||||
| Исходные данные | 9018 9018 9018 9018 Объем добавленных питательных веществ 9018 9018 9018 Объем 9018 9018 1186 | ||||||||||||||||||||
| Объем инокулята (мл) | 560 | 3500 | |||||||||||||||||||
| Объем дистиллированной воды (мл) | 9018 9018 9018 9018 9018 9018 9018 | 9018 | |||||||||||||||||||
Сводные данные первого Этап и второй этап анализов роста клеток показаны в Таблице 5.На первом этапе выход биомассы достиг 0,20, как и ожидалось, в среде с избытком глюкозы, когда штаммы Saccharomyces cerevisiae предпочитают анаэробное дыхание. Увеличение биомассы достигло 112,8 раза, так что цель по высокому увеличению биомассы на этом первом этапе была достигнута. Напротив, на втором этапе общий выход биомассы был выше, достигнув 0,33, а увеличение биомассы было 6,4 раза, оба приемлемых значения для промышленного производства биомассы. Однако ожидалось, что урожай биомассы будет ближе к 0.5, как это происходит в промышленных биореакторах.
Схема роста клеток второй стадии показана на. Кривая экспоненциальной регрессии хорошо согласуется с экспериментальными данными. Удельная скорость роста составила 0,165 ч -1 , что подтверждает хорошие параметры роста штамма Y167 и хорошую начальную оценку 0,18 ч -1 .
показывает профиль концентрации биомассы. Расчетная концентрация биомассы относится к значениям, рассчитанным на основе электронной таблицы, а экспериментальная концентрация биомассы относится к значениям, рассчитанным на основе массы сухих клеток.Эти данные показывают, что после 6 часов реальная концентрация биомассы в реакторе была ниже ожидаемого значения, а питательные вещества и сахар могли быть поданы в избытке.
Профиль концентрации биомассы.
Сахарный профиль второй стадии показан на. Концентрация TRS поддерживалась ниже 1 г / л до 5 -го часа. После 6-го часа TRS увеличился примерно с 1 г / л до 3 г / л, вероятно, из-за концентрации биомассы ниже прогнозируемого значения.
Другие интересные переменные, которые должны помочь в анализе данных, представлены в. Урожай биомассы был рассчитан как мгновенный и совокупный, , т. Е. , урожай за один час (Y X / S Мгновенный в 5 -м часе относится к интервалу с 4 -го часа до 5-го часа). th час) и доходность с нулевого времени до текущего времени соответственно. Совокупный выход биомассы начинается с низкого значения 0,24, достигая максимального значения 0.45 на 6 час. После 6 -го часа можно заметить небольшую тенденцию к снижению значений до общего значения 0,33. В отличие от сахарного профиля, кумулятивное падение выхода биомассы тесно связано с увеличением TRS, что подтверждает сильную тенденцию дрожжей менять метаболизм с аэробного на анаэробное дыхание, когда в бульоне присутствует избыток сахара. Мгновенный выход биомассы показал разрозненные значения, но он следовал той же тенденции, что и кумулятивные значения.
Мгновенный и совокупный профиль выхода биомассы.
Обсуждение
На типичной установке по производству биомассы размножение дрожжей начинается так же, как и в анализе, представленном в этой работе: от скошенного агара до посевного реактора до биореакторов объемом 150 000 литров (реакторы с пузырьковыми колонками). Рост дрожжей в колбе представляет собой рост дрожжей в посевном реакторе, где стерильный рост необходим для обеспечения чистого посевного материала культуры. Первая и вторая ступени в реакторе с барботажной колонной представляют собой первую и вторую стадии размножения дрожжей в больших биореакторах.На первом этапе цель состоит в том, чтобы получить высокий прирост биомассы (продуктивности), чтобы выход биомассы на субстрат не был важной переменной, и не было необходимости в контроле кормления. На втором этапе цель состоит в том, чтобы максимизировать выход биомассы на субстрат путем постепенной подачи патоки, чтобы избежать катаболитной репрессии. Эта стратегия кормления используется от второй стадии размножения до последних биореакторов, где выход биомассы имеет большое значение для производственных затрат.Высокая плотность ячеек и большой рабочий объем, достигаемые на этих стадиях процесса, превращают потребление мелассы в значительную переменную стоимости, поэтому необходима хорошая стратегия подачи и контроль процесса.
Другой важной переменной в производстве биомассы является аэрация и перенос кислорода, поскольку выход биомассы зависит от достижения полностью аэробных условий. Это состояние нелегко смоделировать в пузырьковых реакторах в лабораторных масштабах из-за небольшой высоты реактора, которая приводит к короткому времени пребывания пузырьков воздуха.В случае анализа, представленного в этой работе, рабочая высота биореактора была слишком мала по сравнению с промышленными биореакторами, так что время пребывания пузырьков воздуха было недостаточным для достижения максимального растворенного кислорода в бульоне. Значения выхода биомассы свидетельствовали о том, что экспериментальные условия не достигли полностью аэробных условий. Таким образом, относительно низкое значение выхода биомассы, полученное в этой работе, объясняется ограниченной доступностью кислорода, вызванной плохой передачей кислорода и малым временем пребывания пузырьков воздуха, обусловленным конструкцией и размером реактора соответственно (Fiecher, Käppeli and Meussdoerffer, 1987 ).Другим фактом, который подтверждает доказательства плохой оксигенации бульона, был интенсивный запах ацетальдегида в лаборатории во время анализа, а также присутствие и постоянно растущая концентрация побочных продуктов, обнаруженных с помощью анализа ВЭЖХ (результаты не рассчитаны количественно).
Концентрация клеток в бульоне после 6 -го часа была ниже расчетного значения. Это говорит о том, что, исходя из теории электронных таблиц, количество TRS, которое подавалось с этого времени до конца эксперимента, было избыточным.Это может объяснить увеличение TRS в бульоне () и снижение значений выхода биомассы () вместе с плохой оксигенацией. В условиях более высокой плотности клеток потребление кислорода можно теоретически рассчитать и добавить в электронную таблицу, чтобы аэрация увеличивалась по мере увеличения биомассы. Узкое место оксигенации в мелкомасштабных операциях затрудняет моделирование предыдущих этапов. Он был смоделирован на стадии 3 rd (результаты здесь не показаны), но результаты ясно показали, что перенос кислорода был недостаточным, даже когда аэрация была выше 45 л / мин.Кроме того, было замечено, что клетки были серьезно повреждены, и их жизнеспособность упала до 50%. Это было связано с сильным напряжением сдвига, вызванным высокой скоростью потока пузырьков воздуха.
Выводы
Промышленное производство дрожжевой биомассы — это хорошо отработанный и простой процесс, который с годами совершенствовался с внедрением более совершенной концепции процесса, разработки и стратегий управления. Настоящая работа сосредоточена на улучшении контроля процесса с помощью простой стратегии кормления с ограничением глюкозы.Результаты, представленные здесь, хорошо согласуются с промышленными реалиями, и имитатор электронных таблиц может быть полезным инструментом в эксплуатации и управлении процессом производства биомассы.
Выражение признательности
CAPES, Бразильская организация по координации совершенствования кадров высшего образования, за стипендию, присужденную первому автору.
Ссылки
- Aiba S. Масштабирование. В: Хамфри А.Е., Миллис Н.Ф., редакторы. Биохимическая инженерия. Токийский университет прессы; Токио: 1971.[Google Scholar]
- Акинеми О.П., Бетику Э., Соломон Б.О. Канал субстрата и энергетика Saccharomyces cerevisiae DSM 2155, выращенного на глюкозе в процессе периодической ферментации с подпиткой. Afr J Biotechnol. 2005; 2: 96–103. [Google Scholar]
- Аткинсон Б., Мавитуна Ф. Справочник по биохимической инженерии и биотехнологии. Stockton Press; 1991. с. 120. [Google Scholar]
- Bauer J, Luttik MAH, Flores CL, van Dijken JP, Pronk JT, Niederberger P. Образование побочных продуктов при воздействии на дышащие культуры Saccharomyces cerevisiae избытка глюкозы не вызвано ограниченной способностью пирувата. карбоксилаза.FEMS Microbiol Lett. 1999. 179: 107–113. [PubMed] [Google Scholar]
- Beudeker RF, van Dam HW, van der Plaat JB, Vellenga K. Развитие производства пекарских дрожжей. В: Verachtert H, DeMot R, редакторы. Биотехнология и биокатализ дрожжей. Марсель Деккер; Нью-Йорк: 1990. С. 103–146. [Google Scholar]
- Дрожжи Берроуза С. Бэкера. В: Роуз А.Х., редактор. Микробная биомасса. Vol. 4. Академическая пресса; Нью-Йорк: 1979. С. 30–63. [Google Scholar]
- Di Serio M, De Alteriis E, Parascandola P, Santacesaria E.Общая кинетическая модель и модель массопереноса для моделирования роста пекарских дрожжей в биореакторах. Катал сегодня. 2001; 66: 437–445. [Google Scholar]
- Ди Серио М., Тессер Р., Сантачесария Э. Кинетическая и массообменная модель для моделирования роста пекарских дрожжей в промышленных биореакторах. Chem Eng J. 2001; 82: 347–354. [Google Scholar]
- Динесен Дж., Смитс Х.П., Олссон Л., Нильсен Дж. Углеродная катаболическая репрессия инвертазы при периодическом культивировании Saccharomyces cerevisiae: роль глюкозы, фруктозы и маннозы.Appl Microbiol Biotechnol. 1998. 50: 579–582. [PubMed] [Google Scholar]
- EPA. Производство дрожжей. [Доступ 20 июня 2011 г.]; Compilation of Air Pollutant Emission Factors: AP-42. (Пятое издание). Том I 1995 г. (глава 9.13.4) Доступно по адресу: http://www.epa.gov/ttn/chief/ap42. [Google Scholar]
- Фихер А., Каппели О., Мейсдёрфер Ф. Баня и непрерывная культура. В: Rose AH, Harrison JS, редакторы. Дрожжи. 2-е издание. Vol. 2. Академическая пресса; Нью-Йорк: 1987. С. 99–129. [Google Scholar]
- Фрик О., Витманн К.Характеристика метаболического сдвига между окислительным и ферментативным ростом у Saccharomyces cerevisiae с помощью сравнительного анализа потока 13 C. Фабрики микробных клеток. 2005; 4:30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Halasz A, Lasztity R. Использование биомассы дрожжей в производстве продуктов питания. CRC Press; Бока-Ратон, Флорида: 1991. стр. 312. [Google Scholar]
- Hensing MCM, Rouwenhorst RJ, Heijnen JJ, van Dijken JP, Pronk JT. Физиологические и технологические аспекты крупномасштабного производства гетерологичных белков дрожжами.Антон ван Ли. 1995. 67: 261–279. [PubMed] [Google Scholar]
- ван Дейкен, JP, Weusthuis RA, Pronk JT. Кинетика роста и потребления сахара дрожжами. Антон ван Ли. 1993; 63: 343–352. [PubMed] [Google Scholar]
- Джонс К.Д., Компала Д.С. Кибернетическая модель динамики роста Saccharomyces cerevisiae в периодических и непрерывных культурах. J Biotechnol. 1999. 71: 105–131. [PubMed] [Google Scholar]
- Kantarcia N, Borakb F, Ulgen KO. Реакторы барботажные колонны. Process Biochem.2005; 40: 2263–2283. [Google Scholar]
- Каппели О. Регулирование углеродного обмена у Saccharomyces cerevisiae и родственных дрожжей. Adv Microb Physiol. 1986; 28: 181–209. [PubMed] [Google Scholar]
- Lange HC, Heijnen JJ. Статистическое согласование элементного и молекулярного состава биомассы Saccharomyces cerevisiae. Biotechnol Bioeng. 2001; 75: 334–344. [PubMed] [Google Scholar]
- Rendez-Gil F, Sanz P, Prieto JA. Технические пекарские дрожжи: есть над чем работать.Trends Biotechnol. 1999; 17: 237–244. [PubMed] [Google Scholar]
- Рейман Г. Моделирование и контроль периодической ферментации пекарских дрожжей с подпиткой. Пищевой контроль. 1992; 3: 33–44. [Google Scholar]
- Рингбом К., Ротберг А., Саксен Б. Автоматизация производства пекарских дрожжей на основе моделей. J Biotechnol. 1996; 51: 73–82. [PubMed] [Google Scholar]
- Rose AH. История и научные основы крупномасштабного производства микробной биомассы. В: Роуз А.Х., редактор. Микробная биомасса. Vol. 4. Академическая пресса; Нью-Йорк: 1979.С. 1–29. [Google Scholar]
- Rose AH. Реакция на химическую среду. В: Rose AH, Harrison JS, редакторы. Дрожжи. 2-е издание. Vol. 2. Академическая пресса; Нью-Йорк: 1987. С. 5–40. [Google Scholar]
- Soley A, Lecina M, Gámez X, Cairó JJ, Riu P, Rosell X, Bragós R., Gòdia F. Онлайн-мониторинг роста дрожжевых клеток с помощью импедансной спектроскопии. J Biotechnol. 2005. 118: 398–405. [PubMed] [Google Scholar]
- Зоннлейтнер Б., Кэппели О. Рост Saccharomyces cerevisiae контролируется его ограниченной дыхательной способностью: формулировка и проверка гипотезы.Biotechnol Bioeng. 1986; 28: 927–937. [PubMed] [Google Scholar]
- ван Хук П., Ван Дейкен Дж., Пронк Дж. Влияние удельной скорости роста на ферментативную способность пекарских дрожжей. Appl Environ Microbiol. 1998; 64: 4226–4233. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Verduyn C. Физиология дрожжей в зависимости от урожайности биомассы. Антон ван Ли. 1991; 60: 325–53. [PubMed] [Google Scholar]
Дрожжевые продукты в комбикормовой промышленности
ВведениеЦель этого буклета — дать полутехническое и нетехническое понимание различных дрожжевых продуктов, предлагаемых и используемых по, кормовая промышленность.
Он не касается исследований на животных и эффективности продуктов, а просто описывает, что это за продукты и какие преимущества они призваны обеспечить. Эффективность у животных — слишком сложная тема для рассмотрения в этом коротком буклете. Надеемся, что читатель лучше поймет, что представляют собой различные дрожжевые продукты, чтобы он или она могли принимать обоснованные решения о различных продуктах, основываясь на знании того, что они собой представляют, и данных исследований, представленных поставщиком продукт.Профессионалы кормовой промышленности не могут позволить себе придерживаться мнения, что «дрожжи есть дрожжи», потому что существуют значительные различия в различных дрожжевых продуктах. Существуют как биохимические различия, так и различия в функциональности, и каждый продукт следует использовать из-за своих уникальных свойств. Не все дрожжевые продукты одинаковы.
Дрожжи — Обзор
Дрожжи скармливались животным более ста лет в виде дрожжевого сусла, производимого на ферме, побочных продуктов дрожжей на пивоваренных или ликероводочных заводах или коммерческих дрожжей продукты, специально предназначенные для кормления животных.Хотя кормление дрожжами существует уже давно, в отрасли существует путаница относительно того, что на самом деле представляют собой различные дрожжевые продукты.
Дрожжи — это микроскопические грибы — одноклеточные организмы, размер которых обычно составляет около 5-10 микрон. Им даны латинские названия, обозначающие их род и вид (например, Saccharomyces cerevisiae или Candida utilis). Виды отличаются друг от друга: где они обитают, их клеточной морфологией или формой, как они метаболизируют различные субстраты и как они размножаются.Хотя существует около 50 000 видов грибов, существует всего 60 различных родов дрожжей, представляющих около 500 различных видов.
Дрожжи распространены по всей окружающей среде. Их можно найти на зерновых злаках, побочных продуктах зерна, силосе, сене и даже в почве и воде. Наша лаборатория обнаружила, что различные кормовые ингредиенты содержат от нескольких тысяч (103) живых дрожжевых клеток на грамм до более миллиона (106) на грамм. Несколько видов оказались очень полезными для человека, а некоторые несовершенные дрожжи, как известно, являются патогенными.Но большинство дрожжей являются доброкачественными сапрофитами и не доказали свою полезность и вред для человека или животных.
В коммерческих целях используются очень немногие виды дрожжей. Saccharomyces cerevisiae, также известный как «пекарские дрожжи», является одним из наиболее широко продаваемых видов. Отобранные штаммы этих дрожжей используются на пивоваренных заводах для производства пива и эля, на ликероводочных заводах для производства дистиллированного и технического спирта, а также на винных заводах для производства вина. Candida utilis (ранее классифицированный как Torulopsis utilis) — это дрожжи, известные как «дрожжи Torula».Эти дрожжи важны, потому что они могут использовать пентозные сахара из обработанной древесной массы, используемой для изготовления бумаги. Третьи полезные дрожжи — Kluyveromyces marxianus. Это «сывороточные дрожжи», которые могут использовать молочный сахар или лактозу в качестве субстрата.
Дрожжи — это «факультативные анаэробы», что означает, что они могут выживать и расти как с кислородом, так и без него. Размножение дрожжей — это аэробный процесс, при котором дрожжи превращают кислород и сахар посредством окислительного метаболизма в углекислый газ и полезную свободную энергию для эффективного роста дрожжевых клеток.Однако производство алкогольных напитков (пиво, вино, виски и т. Д.) И технического спирта — анаэробные процессы. Анаэробная ферментация намного менее эффективна, что приводит к значительному «побочному продукту метаболизма» в виде этилового спирта. Дрожжи сбраживают простые сахара в этанол и углекислый газ, и дрожжи очень медленно растут. Чтобы оптимизировать производство этанола, процесс ферментации проводится без кислорода; но, чтобы максимизировать рост дрожжевых клеток, кислород предоставляется в виде воздуха.
Раньше ферментация проводилась путем засева хлебного теста, виноградного сусла или кукурузного сусла с остатками от предыдущей ферментации. Наши предки всегда оставляли часть заквашенного хлебного теста для смешивания со свежим тестом на следующий день. Это дрожжевое тесто было названо «стартовым тестом». Живые дрожжи переходили из теста в тесто в непрерывном цикле. Если закваска была потеряна или закисла из-за бактериального заражения, новые семена можно было приготовить, смочив муку и дождавшись самопроизвольного брожения, или одолжив закваску у соседа и запустив новую закваску.
Сегодня чистые дрожжевые культуры выращивают специально для пивоварен, виноделен, ликероводочных заводов, пекарен и домашнего использования. Коммерческие или патентованные дрожжи используются в промышленности для производства всех дрожжевых хлебобулочных изделий и алкогольных напитков. Хотя некоторые винодельни по-прежнему используют натуральные дрожжи, содержащиеся в винограде, для самопроизвольного брожения своих вин, большинство виноделен в настоящее время зависят от чистых культур определенных штаммов дрожжей для создания постоянных запатентованных вин.
Жизнеспособные дрожжевые продукты
Активные сухие дрожжи (95% сухого вещества) являются преобладающими жизнеспособными дрожжами, доступными для кормовой промышленности.Хотя влажный дрожжевой пирог (30% твердых веществ) и в меньшей степени дрожжевые сливки (18-20% твердых веществ) широко используются в хлебобулочных изделиях, активные сухие дрожжи являются формой жизнеспособных дрожжей, используемых в большинстве кормов для животных. Однако все три формы живых дрожжей можно использовать в качестве инокулята для производства дрожжевой культуры, которая является продуктом дрожжевой ферментации, который будет обсуждаться позже.
Производство активных сухих дрожжей осуществляется с использованием погружных биореакторов для культивирования или аэробных ферментеров. Цель состоит в том, чтобы накормить дрожжи питательными веществами (кислород, азот, углеводы) и позволить им воспроизводиться и формировать новые поколения дрожжевых клеток.Они размножаются, используя «почкование», когда дочерняя клетка эволюционирует из материнской клетки, образуя почку, а когда дочь созреет, они обе будут размножаться. Таким образом, их рост экспоненциальный.
Например, одна ячейка превращается в две, две в четыре, четыре в восемь и так далее. После достижения эффективной концентрации дрожжей ростовой бульон центрифугируется для образования дрожжевого крема, фильтруется через фильтр-пресс для получения дрожжевого жмыха, превращается в влажную дрожжевую лапшу, а затем сушится при температурах, которые не нарушают ферментативную активность дрожжей. .
Активные сухие дрожжи состоят из чистых высушенных дрожжевых клеток с показателем жизнеспособности от 15 до 25 миллиардов живых дрожжевых клеток или колониеобразующих единиц (КОЕ) на грамм. Он продается в трех физических формах, в зависимости от процесса, используемого для сушки дрожжей: туннельные сушеные дрожжи, которые представляют собой гранулированный порошок, сушеные дрожжи в псевдоожиженном слое (также известные как мгновенные или быстрорастущие дрожжи), которые выглядят как маленькие торпеды, и ротолуверы. сушеные дрожжи, похожие на маленькие шарики или шарики. В Соединенных Штатах наиболее распространены туннельно-сушеные дрожжи и сушеные дрожжи в псевдоожиженном слое, тогда как сушеные дрожжи ротолуверного типа наиболее распространены в Европе и Латинской Америке.Процесс сушки в псевдоожиженном слое становится все более популярным, потому что он вызывает меньшее повреждение дрожжевых клеток, что приводит к лучшим разрыхляющим свойствам дрожжей.
Активные сухие дрожжи все чаще появляются в комбикормовой промышленности не в виде чистого продукта, а в виде разбавленных дрожжевых продуктов с широким диапазоном показателей жизнеспособности дрожжей. Это одна из причин, по которой так много недоразумений в отношении живых дрожжевых продуктов. Например, продукт из живых дрожжей, гарантирующий 5 миллиардов КОЕ на грамм количества живых дрожжей, содержит только 20-25% активных сухих дрожжей, что обычно составляет около 20 миллиардов КОЕ на грамм.Остальная часть продукта состоит из более дешевых разбавителей, таких как рисовая шелуха или растворимые вещества дистилляторов. Активные сухие дрожжи обычно стоят менее 7,5 центов за миллиард КОЕ за грамм жизнеспособности дрожжей, в то время как разбавленные продукты, представленные в настоящее время на рынке, продаются в 10-15 раз дороже за миллиард. Поэтому важно, чтобы диетолог и агент по закупкам знали, что они покупают и какова их стоимость на миллиард КОЕ по сравнению с коммерческими активными сухими дрожжами.
Стабильность активных сухих дрожжей зависит от того, как продукт упакован… от наличия кислорода.Дрожжи, упакованные в вакууме или инертном газе, имеют гораздо большую стабильность, чем дрожжи, упакованные в воздухе. В промышленных масштабах наиболее активные сухие пекарские дрожжи расфасовываются либо в вакуумную упаковку, либо продуваются азотом. Присутствие воздуха или кислорода сильно влияет на ферментативную активность.
Влияние гранулирования на жизнеспособность дрожжей
В производстве комбикормов существует значительная путаница в отношении эффектов гранулирования продуктов дрожжей с живыми клетками и дрожжевых культур.Эта путаница возникает из-за отсутствия различий между двумя продуктами и неправильного представления о том, что гранулирование делает с живыми дрожжевыми клетками.
Дрожжевые культуры производятся в США более 50 лет, но последнее десятилетие стало свидетелем быстрого роста коммерческих дрожжевых продуктов с живыми клетками, которые рекламируются как концентрированные «дрожжевые культуры» с большим количеством клеток. Однако эти продукты не являются ферментированными культурами дрожжей, а скорее смесями высушенных жизнеспособных дрожжей (активных сухих дрожжей), разбавленных носителем.К сожалению, это привело к неправильному пониманию того, что такое настоящие дрожжевые культуры и чем они отличаются от дрожжевых продуктов из живых клеток.
Истинные дрожжевые культуры — это сложные ферментированные продукты, содержащие дрожжи и побочные продукты метаболизма, производимые дрожжами во время ферментации. Дрожжевые культуры не используются как источник живых или жизнеспособных дрожжевых клеток, а как пищевая добавка, обеспечивающая неопределенные факторы ферментации, которые, как известно, стимулируют рост бактерий в пищеварительном тракте.Эти факторы ферментации, иногда называемые «нутрилитами», кажутся термостабильными и не подвергаются значительному влиянию высоких температур или гранулирования. Эта термостабильность проиллюстрирована на рисунке выше, демонстрирующем, что даже автоклавирование оказывает минимальное влияние на способность дрожжевой культуры усиливать рост бактерий.
Продукты дрожжей с живыми клетками, с другой стороны, состоят из жизнеспособных активных сухих дрожжей, смешанных с разбавителем, чтобы обеспечить определенное количество живых дрожжевых клеток. Активные сухие дрожжи определяются как чистые сухие дрожжи (без наполнителей и разбавителей), содержащие не менее 15 миллиардов (1.5 x 1010) живых дрожжевых клеток на грамм. Таким образом, продукт с живыми клетками, требующий 5 миллиардов клеток на грамм, будет состоять на 20-25% из активных сухих дрожжей, а остальное — это ингредиенты-носители, такие как растворимые в дистилляторе или рисовая шелуха. Эти определения помогают различать активные сухие дрожжи и настоящие дрожжевые культуры; первая является источником жизнеспособных дрожжевых клеток, а вторая — ферментированной культурой. Поскольку дрожжевые продукты с живыми клетками производятся из активных сухих дрожжей и продаются как источник жизнеспособных дрожжевых клеток, вопрос о том, разрушает ли их активность гранулирование, является серьезной проблемой для производителя кормов или диетолога, использующего их в гранулированных продуктах.
В обычном процессе гранулирования используется пар для кондиционирования сырья для правильной экструзии через фильеру для гранулирования. Принято считать, что пар — один из самых эффективных методов уничтожения микроорганизмов (пар используется при автоклавировании для стерилизации). Влажное тепло денатурирует ферментные системы в организме, разрушая их метаболическую активность и подавляя жизненные процессы. Чем выше температура, тем процесс более полный и необратимый. Также хорошо известно, что сухой жар гораздо менее разрушителен для жизнеспособности дрожжей и активности ферментов, чем влажный жар.Следовательно, нагревание сухих дрожжей без присутствия влаги гораздо менее вредно для дрожжевых клеток, чем при использовании пара.
Чтобы определить, отрицательно ли гранулирование влияет на жизнеспособность и / или ферментативную активность дрожжей, существует три возможных подхода: количество реальных живых, жизнеспособных дрожжевых клеток в продукте до и после гранулирования.Метод выполняется путем последовательного разбавления суспензии дрожжевого продукта в воде и нанесения различных разведений на питательную среду, чтобы клетки дрожжей могли расти и размножаться. Примерно через три дня каждое место на питательном геле, где была отложена одна дрожжевая клетка, вырастет в колонию, состоящую из тысяч дрожжевых клеток, и колонии станут видимыми невооруженным глазом. Количество колоний подсчитывают на каждой чашке, и подсчитывают количество живых дрожжей в тестируемом продукте и записывают в виде колониеобразующих единиц на грамм (КОЕ на грамм).
Процесс гранулирования оказывает эффект «тепловой денатуризации» на метаболические ферменты дрожжевых клеток и является основным принципом пастеризации и стерилизации теплом. Тепло может денатурировать метаболические ферментные системы дрожжевой клетки, которые препятствуют не только метаболической активности, но и размножению, и самой жизни. Из-за этой взаимосвязи, если гранулирование препятствует размножению дрожжевых клеток в чашке Петри, это, скорее всего, также разрушает способность дрожжевых клеток выполнять другие метаболические функции.Вот почему метод подсчета на чашках — это метод выбора для проверки влияния гранулирования на активность дрожжей — это хорошо отработанный метод и довольно точный, плюс он позволяет использовать селективные питательные среды для предотвращения вмешательства со стороны других, не влияющих на активность дрожжей. дрожжевые микроорганизмы в кормовой смеси.
При оценке потерь жизнеспособности дрожжей важно использовать не логарифмы, а фактические числа для выражения подсчета жизнеспособности, поскольку логарифмы могут вводить в заблуждение. Например, если фид содержит 5 миллионов (5.0 x 106) КОЕ на грамм до гранулирования и только 50 тысяч (5,0 x 104) после гранулирования, что представляет собой реальную 99% потерю жизнеспособности. Однако, если числа КОЕ преобразовать в логарифмы log10, числа будут представлены как 6,699 до гранулирования и 4,699 после гранулирования, что делает потерю только 30%. Этот метод использовался в прошлом, чтобы показать, что гранулирование оказывает меньшее влияние на жизнеспособность дрожжей, чем на самом деле. Итак, убедитесь, что вы понимаете, как представлены подсчеты КОЕ в эксперименте, чтобы вы могли сделать точную интерпретацию.
Метаболическая активность:
Этот метод может быть альтернативой методу подсчета на чашках, поскольку он имеет дело непосредственно с измерением конечных продуктов метаболической активности или исчезновения субстрата. Однако у него есть важные недостатки. Могут быть значительные помехи со стороны других микроорганизмов, особенно бактерий. Многие термофильные бактерии могут выжить при гранулировании, а их метаболические побочные продукты могут мешать интерпретации.Кроме того, в гранулируемом корме, вероятно, потребуется более высокое, чем обычно, содержание дрожжей, чтобы их метаболиты можно было обнаружить после короткого периода ферментации. Для измерения объема углекислого газа можно использовать простой манометрический прибор, тогда как для мониторинга исчезновения глюкозы или производства этанола потребуются более сложные аналитические процедуры.
Окрашивание метиленовым синим:
Этот метод не рекомендуется, хотя это очень быстрый и простой метод.Наша лаборатория много раз пыталась сопоставить этот быстрый метод с реальной жизнеспособностью дрожжей и ферментативной активностью, но без особого успеха. Этот метод, кажется, хорошо коррелирует, когда популяции дрожжей здоровы, а их жизнеспособность снижается из-за естественного старения и автолитической смерти. Однако это ненадежный метод, когда дрожжевые клетки подвергались воздействию тепла, потому что он дает завышенную оценку количества жизнеспособных дрожжей. Окрашивание метиленовым синим зависит от разрушения стенки дрожжевой клетки, что позволяет красителю проникать в клетку; таким образом, клетки с поврежденными клеточными стенками окрашиваются в синий цвет, а неповрежденные клетки — нет.Проблема в том, что если дрожжевая клетка умирает из-за тепловой денатуризации ферментных систем и клеточная стенка не затрагивается, мертвая клетка не будет окрашиваться, и дрожжевая клетка будет казаться жизнеспособной, когда это не так.
Культура дрожжей
Культура дрожжей уникальна и отличается от других дрожжевых продуктов. Дрожжевая культура — это единственный определенный кормовой дрожжевой продукт, который не состоит исключительно из дрожжевых клеток или биомассы дрожжей, но, скорее, представляет собой дрожжевой ферментированный продукт, предназначенный для обеспечения метаболитов ферментации в результате определенного процесса ферментации.По определению, дрожжевые культуры содержат остаточную жизнеспособность дрожжей, но они не считаются значительным источником жизнеспособных дрожжевых клеток или биомассы дрожжей. На рисунке слева схематично представлен коммерческий «процесс культивирования дрожжей», который иллюстрирует, как происходит ферментация и как производится продукт.
Метаболиты ферментации:
Производство ферментативных метаболитов дрожжевыми клетками, иногда называемых «нутрилитами», является принципом ферментации дрожжевой культуры.В определенную культуральную среду инокулируют живые дрожжевые клетки, дают возможность ферментироваться при определенных условиях, а затем вся ферментированная среда сушится … она содержит как остаточные живые дрожжевые клетки, используемые в ферментации, так и метаболиты или метаболиты. побочные продукты дрожжей. Культура дрожжей — очень сложный продукт, содержащий как «внутриклеточные» питательные вещества дрожжевых клеток, так и «внеклеточные» метаболиты ферментации. Простое кормление дрожжевых клеток не приведет к дублированию общего «питательного» диапазона дрожжевой культуры.
Когда дрожжевые клетки сбраживают сахара, они выделяют побочные продукты метаболизма… алкоголь является хорошим примером внеклеточного метаболита, образующегося в результате ферментации дрожжей в условиях пивоварения. Различия в профиле метаболитов объясняют, почему разные ферментированные продукты (например, хлеб, пиво, вино, виски) по вкусу и запаху отличаются друг от друга. В зависимости от состава ферментируемой среды и условий процесса ферментации секретируется множество различных метаболитов, включая пептиды, спирты, сложные эфиры и органические кислоты.В случае ферментации пива эти внеклеточные метаболиты вымываются из дрожжевых клеток и содержатся в пиве, а не в составе пивных дрожжей. Просто помните, что дрожжевая культура уникальна среди всех других дрожжевых продуктов и должна оцениваться как ферментированный продукт, содержащий «неопределенные питательные вещества», а не на основе его «известного профиля питательных веществ», такого как профиль белков, витаминов и аминокислот.
Пищевые дрожжи
Пищевые дрожжевые продукты состоят из биомассы дрожжей или чистых мертвых дрожжевых клеток, которые питаются из-за их питательной ценности.Они включают первичные сухие дрожжи, пивные дрожжи, сухие дрожжи torula и сывороточные дрожжи.
Клетки дрожжей уже давно вносят свой вклад в пищевую ценность ферментированных продуктов, таких как хлеб и пиво. В некоторых обществах «мутное» пиво вносит большой вклад в ежедневные потребности в питании. Мутный осадок дрожжевых клеток обеспечивает организм необходимыми витаминами группы B, минералами и аминокислотами. А в средние века младенцев часто кормили осадком из мутного пива, чтобы сохранить их здоровье и избежать дефицита питательных веществ.
Дрожжи — хороший источник белка или аминокислот. Примерно 40% веса сухих дрожжей составляет белок. Качество дрожжевого белка превосходно для растительного белка и примерно равно качеству соевого белка. Оба богаты лизином и являются отличными добавками к злакам, белки которых, как правило, содержат мало лизина. Как и в случае с другими растительными белками, в дрожжевом белке мало серных аминокислот, но добавление в сухие дрожжи 0,5% метионина может повысить качество его белка до уровня казеина.Однако существует предел того, сколько дрожжей можно кормить, потому что около 20% азота сырого протеина в дрожжах находится в форме нуклеиновых кислот. Нуклеиновые кислоты могут вызывать проблемы при переедании, потому что чрезмерное потребление нуклеиновых кислот приводит к повышению уровня мочевой кислоты в крови. Высокий уровень мочевой кислоты имеет тенденцию кристаллизоваться в суставах и у человека, что может вызвать подагру, артрит или даже почечные камни.
В то время как пищевая ценность дрожжей была признана рано, определение питательных факторов, которые излечивают определенные пищевые болезни, не проводилось до начала 20-го века.Именно тогда были открыты витамины группы B. Некоторые из этих витаминов были впервые экстрагированы и охарактеризованы из дрожжей, в том числе биотин, ниацин, пантотеновая кислота и тиамин. Дрожжи давно признаны богатым источником натуральных витаминов группы В.
Первичные сушеные дрожжи
Первичные сухие дрожжи относятся к дрожжам (обычно Saccharomyces cerevisiae или Candida utilis), которые намеренно выращиваются и собираются в качестве источника пищевых дрожжей и не являются побочным продуктом другой отрасли.Обычно его размножают на сахарных субстратах, таких как патока, в аэробных биореакторах, как активные пекарские дрожжи, но сушат при высокой температуре, чтобы убить дрожжевые клетки. В основном они используются в пищевой промышленности для обогащения пищевых продуктов и, как правило, слишком дороги для использования в торговле кормами.
Пивоваренные дрожжи
Пивные дрожжи являются побочным продуктом пивоваренной промышленности. После ферментации пива дрожжи (Saccharomyces cerevisiae) извлекаются из бродильных чанов, сушатся при высокой температуре, чтобы убить дрожжи, и продаются как в пищевой, так и в диетической пищей и кормах для животных в качестве специальной белковой, витаминной и минеральной добавки. .
Сушеные дрожжи Torula
Дрожжи Torula относятся к особым видам дрожжей (Candida utilis), которые часто выращиваются на сточных водах бумажной промышленности и называются сульфитным щелоком. Отработанный раствор с высоким содержанием пентозы или пятиуглеродных сахаров, а выращивание дрожжей в растворе снижает биологическую потребность в кислороде для отходов, что упрощает утилизацию — это также обеспечивает коммерческий побочный продукт. Когда-то кормовая промышленность была основным рынком для дрожжей Torula, но теперь большая часть их используется производителями пищевых продуктов.Он получил свое название от Torulopsis utilis, которое раньше было названием дрожжей, прежде чем они были переклассифицированы систематиками.
Сывороточные дрожжи
Сывороточные дрожжи — это дрожжи, выращенные на молочной сыворотке и состоящие из дрожжей вида Kluyveromyces marxianus (ранее классифицировались как Kluyveromyces fragilis). Когда-то в торговле кормами было доступно значительное количество сывороточных дрожжей, но в последние годы их доступность практически исчезла. Однако, поскольку потоки отходов сыворотки станут более серьезной проблемой в будущем, мы можем увидеть возрождение сывороточных дрожжей в качестве кормовых ингредиентов.
Питательные вещества для дрожжевых клеток
Когда питаются целые дрожжевые клетки, такие как пивные дрожжи или активные сухие дрожжи, их основной питательный вклад обеспечивается белками, пептидами, витаминами и минералами, содержащимися в клетке … внутриклеточными биохимическими веществами, обнаруженными в дрожжевая клетка. Таким образом, чтобы эти питательные вещества стали доступными, дрожжевые клетки должны быть лизированы или вскрыты, чтобы содержимое клетки стало доступным для переваривания и всасывания.
Это может происходить двумя способами: 1) ферменты протеазы и глюканазы из микроорганизмов пищеварительного тракта могут вскрывать клетку посредством «гидролиза» извне внутрь, и 2) ферменты в живых дрожжевых клетках могут вызывать «автолиз». «дрожжевой клетки путем переваривания клеточной стенки изнутри.
Когда скармливаются мертвые дрожжевые клетки, такие как пивные сухие дрожжи, гидролиз — единственный способ сделать доступными внутриклеточные питательные вещества дрожжей. Однако, когда живые дрожжевые клетки скармливаются, как гидролиз, так и автолиз могут играть роль в разрыве клетки для переваривания.
Что касается перевариваемости или доступности питательных веществ внутриклеточных дрожжей, питательные вещества из живых клеток, вероятно, более доступны… при условии, что клетка лизируется. Причина тому — жара. Чем выше температура, используемая для сушки дрожжей, тем больше «денатурирования» или разрушения питательных веществ.Дело не в том, что живые дрожжевые клетки сами по себе более питательны, чем мертвые дрожжевые клетки, а в том, что мертвые дрожжи обычно сушатся при гораздо более высоких температурах, поэтому они мертвы, а доступность питательных веществ, как правило, ниже.
Дрожжи специального назначения
Облученные дрожжи
Хотя дрожжи не являются источником активности витамина D, они содержат стерол, эргостерин, который превращается в витамин D2 (эргокальциферол) при облучении ультрафиолетовый свет.В прошлом облученные сухие дрожжи служили важным источником активности витамина D, пока его не вытеснил с рынка более дешевый синтетический витамин D3 (холкальциферол).
Селеновые дрожжи
Дрожжи также являются хорошим источником диетического селена. Селен в дрожжах обычно находится в форме селенометионина, который представляет собой органическую форму селена, в которой селен замещает серу в молекуле метионина. Селен необходим для активации ферментной системы, которая оказывает защитное действие на печень и другие ткани.Похоже, что активированный селеном фермент, глутатионпероксидаза, предотвращает окислительное повреждение клеточной мембраны и последующее преждевременное старение клетки.
Селен пивоваренных дрожжей сыграл первостепенную роль в питании животных, особенно в производстве кормов для домашних животных. Тот факт, что пивные дрожжи содержат значительное количество витаминов группы B и селена, часто объясняет их включение во многие рецептуры кормов для животных. Он часто использовался в ранних кормах для домашних животных и специальных продуктах в качестве природного источника селена до того, как селенит натрия стал широко использоваться.
Коммерческие дрожжи с высоким содержанием селена производятся и продаются в магазинах здорового питания и иногда добавляются в таблетки витаминов / минералов. В то время как пекарские дрожжи могут содержать одну или две части на миллион (ч / млн) селена, доступны коммерческие дрожжи с «высоким содержанием селена», содержащие до 2000 ч / млн селена, 75% которого органически связано.
Хромовые дрожжи
Хром в дрожжах присутствует в органической форме, называемой «фактором толерантности к глюкозе», и играет важную роль в регуляции метаболизма сахара.Он состоит из трехвалентного хрома в комплексе с биологически активными пептидами, аминокислотами и ниацином и, по-видимому, действует вместе с инсулином, облегчая эффективный метаболизм углеводов. Это кажется важным для пожилых людей, диабетиков и детей, страдающих диабетом, поскольку у них либо более низкое содержание хрома в тканях, либо пониженная способность усваивать хром, либо более высокая частота нарушения толерантности к глюкозе. Хотя точно не известно, как это работает, исследования показывают, что у людей, потребляющих хром в органической форме, наблюдается снижение уровня сахара в крови и зависимость от инсулина, а также снижение уровня холестерина и триглицеридов в сыворотке.Недавние исследования показывают, что органический хром в виде дрожжей с высоким содержанием хрома или пиколината хрома может снизить стресс у крупного рогатого скота и уменьшить отложение жира у свиней.
Дрожжи Phaffia
Дрожжи Phaffia rhodozyma, известные как дрожжи Phaffia, являются последним дрожжевым продуктом, который используется в кормовой промышленности. Эти дрожжи производят красный пигмент, который используется в кормах для форели и лосося для придания ему красной окраски мяса. Этот красный пигмент представляет собой каротиноид под названием «астаксантин». Дрожжи Phaffia более дорогие, чем синтетическая форма каротиноида, но ограниченные данные свидетельствуют о том, что астаксантин из разорванных дрожжевых клеток может быть более эффективным пигментером, поскольку он находится в органической матрице.
Дрожжевые фракции
Дрожжевые экстракты и автолизаты производятся из цельных дрожжевых клеток, будь то пивные дрожжи с дебитированным пивом или первично выращенные пекарские дрожжи, и широко используются в пищевой промышленности для улучшения вкуса. Дрожжевые экстракты состоят из внутриклеточных компонентов дрожжевой клетки с удаленной клеточной стенкой дрожжей. Автолизаты дрожжей состоят из разорванных или лизированных клеток и содержат фракции как внутриклеточной, так и клеточной стенки. Оба содержат 5′-нуклеотиды и глутамат, которые усиливают распознавание аромата.Дрожжевые экстракты также используются в качестве микробных стимуляторов в ферментационной промышленности, а микробиологи используют их в своих лабораторных питательных средах для оптимизации роста бактерий.
Стенки дрожжевых клеток, оставшиеся в качестве побочного продукта при производстве дрожжевых экстрактов, часто называют дрожжевой шелухой или дрожжевыми привидениями. Они состоят преимущественно из бета-глюканов и маннанов, с некоторым количеством хитина и белка. Дрожжевые призраки часто используются в виноделии, чтобы избежать «застревания» брожения из-за накопления октановой и декановой кислот.Эти кислоты адсорбируются на призраках, что предотвращает их ингибирующее действие на ферментацию.
Автолизаты:
Эти дрожжевые продукты состоят из целых дрожжевых клеток, которые были вскрыты (лизированы) за счет того, что дрожжевые клетки разрушили себя с помощью собственных автолитических ферментов (автолизатов), с использованием кислот или ферментов для гидролизовать клетку (гидролизаты) или разрывая клетку с использованием осмотического давления из-за суспендирования дрожжевых клеток в растворе с высоким содержанием соли, что называется плазмолизом (плазмолизаты).
Они содержат как содержимое клетки, так и клеточную стенку клетки. Автолизаты являются наиболее чистыми из трех типов продуктов, поскольку гидролизаты и плазмолизаты обычно имеют высокое содержание соли или натрия из-за солевых градиентов, используемых при плазмолизе, или использования оснований для нейтрализации кислот, используемых для получения гидролизатов.
Автолизаты широко используются в пищевой промышленности из-за их способности улучшать вкус пищевых продуктов, особенно в супах и снэках. Это улучшение связано с содержанием в дрожжах нуклеиновых кислот — 5’-нуклеотидов.Нуклеотиды придают пище пикантность, усиливая действие глутаминовой кислоты или глутамата натрия для усиления вкуса.
Дрожжевые экстракты:
Дрожжевые экстракты состоят исключительно из внутриклеточного содержимого дрожжевых клеток после лизиса клетки с удаленной клеточной стенкой. Они используются микробиологами при приготовлении питательных сред для микробов, а также при некоторых промышленных и фармацевтических ферментациях. Экстракты богаты аминокислотами, витаминами и микроэлементами и действуют как стимуляторы роста микроорганизмов.
Стенки дрожжевых клеток:
Дрожжевые клетки имеют углеводную оболочку вокруг себя, называемую клеточной стенкой дрожжей. Его часто называют «глюкановым щитом», и он состоит в основном из бета-глюканов и маннанов. Это структурные полисахариды (цепочки молекул сахара), похожие на крахмал или целлюлозу. Бета-глюканы представляют собой цепи молекул глюкозы, сахара, точно так же, как крахмал, но сахара соединены вместе различными связями (связи бета-1,3 и 1,6 вместо связей альфа-1,4 и 1,6).Следовательно, необходимы разные ферменты, чтобы расщепить их на всасываемые молекулы сахара. Маннаны представляют собой цепочки другой молекулы сахара, называемой маннозой.
Считается, что клеточная стенка дрожжей обладает уникальной способностью адсорбировать или связываться с определенными веществами в пищеварительном тракте, особенно с вредными веществами, такими как токсины, антивитамины, вирусы и патогенные бактерии, и, как предполагается, имеет защитный или промывочный эффект. в кишечнике. Фракция маннана клеточной стенки дрожжей также считается особым полисахаридом, который избирательно потребляется полезными бактериями в кишечнике.Эти полезные насекомые, в свою очередь, подавляют или убивают вредные бактерии, такие как сальмонелла. Это та же концепция, что и продукт под названием фруктоолигосахарид или ФОС. Дрожжевой продукт также называется «MOS», аббревиатура MOS означает маннанолигосахарид (олигосахарид — это полисахарид, длина которого составляет всего 3-10 молекул сахара вместо сотен молекул, что позволяет предположить, что это маннан с короткой цепью). Когда эти короткоцепочечные маннаны скармливаются, они не перевариваются животным, а потребляются избранными бактериями в кишечнике, которые быстро растут и обладают пробиотическим действием против вредных насекомых.
Ссылки и рекомендуемая литература
Крегер ван Ридж, Н. Дж. У. (ред.). 1984. Дрожжи: таксономическое исследование. Elsevier Biomedical Press, Амстердам, Голландия.
Reed, G. and T. W. Nagodawithana. 1991. Дрожжевые технологии (2-е изд.), Ван Ностранд Рейнхольд, Нью-Йорк.
Пепплер, Х. Дж. 1983. Ферментированные корма и кормовые добавки. В издании «Биотехнология», том 5, Г. Рид (ред.), VCH Publishing Co., Вайнхайм, Западная Германия.
Дирстайн, Р. С. и К. О. Боллинджер.1938. Некоторые эффекты скармливания дрожжевого сусла несушкам. Северная Каролина Агри. Экспериментальная станция, Технический бюллетень № 55.
Джонсон, Э. А., Д. Э. Конклин и М. Дж. Льюис. 1977 г. Дрожжи Phaffia rhodozyma как источник пищевых пигментов для лососевых и ракообразных. J. Fish Res. Совет Канады 34: 2417-2421.
Джонсон, Э. А., Т. Г. Вилла, М. Дж. Льюис и Х. Дж. Фафф. 1978. Простой метод выделения астаксантина из базидиомицетовых дрожжей Phaffia rhodozyma.Прил. Environ. Microbiol. 35: 1155-1159.
Пепплер, Х. Дж. И К. В. Стоун. 1976. Кормовые дрожжевые продукты. Управление кормлением 27 (8): 17-18.
Mertz, W. and K. Schwartz. 1955. Нарушение толерантности к глюкозе как ранний признак чрезмерной некротической деградации пищи. Arch. Биохим. Биофиз. 58: 504-506.
Мерц, В., В. Вопфер, Э. Э. Рогинский и М. М. Полански. 1974. Современные знания о роли хрома. Federation Proc. 33: 2275-2280.
Дойзи, Р. Дж., Д. Х. П. Стритер, Дж.М. Фрейбес и А. Дж. Шнайдер. 1976. Метаболизм хрома в человеке и биохимические эффекты. В «Микроэлементы в здоровье и болезнях человека», т. 2, А.С. Прасад (ред.), Academic Press, Нью-Йорк.
Chang, X. and D. N. Mowat. 1992. Добавка хрома для подвергшихся стрессу и растущих телят на кормушку. J. Anim. Sci. 70: 559-565.
Пейдж, Т. Г., Л. Л. Саузерн, Т. Л. Уорд и Д. Л. Томпсон, мл. 1993. Влияние пиколината хрома на рост, сывороточные свойства и характеристики туши свиней на доращивании и откорме.J. Anim. Sci. 71: 656-662.
Никл, Л., Л. Дж. Олбрайт и Т. П. Л. Эвелин. 1991. Влияние семи иммуностимуляторов на реакцию кижуча на Aeromonas salmonicida. Дис. Акват. Орг. 12: 7-12.
Производство и характеристика дрожжей, выращенных на среде, состоящей из сахаров елового происхождения и гидролизатов белков из куриных субпродуктов | Microbial Cell Factories
Материалы
Свежие куриные субпродукты (сердце, печень и пищеварительный тракт) были предоставлены Nortura Hærland (Hærland, Норвегия) и хранились при -20 ° C до дальнейшего использования.Перед реакциями ферментативного гидролиза образцы размораживали и измельчали на измельчителе кормов BIRO ® MODEL 6642 (Marblehead, Ohio, USA). Субпродукты курицы содержали 30,12 ± 0,50% сухого вещества, в том числе 15,10 ± 1,20% белка, 4,47 ± 0,29% золы и 6,91 ± 0,55% липидов [20]. Ферментные гидролизаты предварительно обработанной BALI ™ древесины ели ( Picea abies ) были любезно предоставлены Borregaard AS (Сарпсборг, Норвегия) [16]. В качестве сырья для варки целлюлозы использовалась еловая стружка с размером щепы до 4 штук.5 × 4,5 × 0,8 см 3 . Углеводный состав гидролизата ели показан в Дополнительном файле 1: Таблица S1. Приобретены дрожжевой экстракт, мясной пептон, азотное основание дрожжей без аминокислот и без сульфата аммония, глюкоза, целлобиоза, ксилоза, молочная кислота, уксусная кислота, серная кислота, хлористый водород, гидроксид натрия, нингидрин, глицин и хлорид олова. от Sigma-Aldrich (штат Миссури, США). Сульфат аммония был приобретен в VWR (Пенсильвания, США), а мочевина любезно предоставлена Yara International ASA (Осло, Норвегия).Кьельтабы для анализа Кьельдаля были приобретены у Thomson and Capper Ltd. (Чешир, Великобритания).
Ферментативный гидролиз побочных продуктов курицы
15 кг (сырого веса) субпродуктов куриного фарша смешивали с 15 л воды в 30-литровых реакторах гидролиза Einar (Belach Bioteknik, Skogås, Стокгольм, Швеция), в результате чего получали сухой -концентрация вещества 15%. Ферментативный гидролиз куриных побочных продуктов проводили с использованием 0,5% (вес порошка фермента / вес влажных куриных побочных продуктов) папаина из Carica papaya , (≥ 3 Ед / мг; Merck, Дармштадт, Германия). при 60 ° C и 50 об / мин без регулирования pH и при медленном нагревании до 60 ° C, как описано ранее [20].Гидролизаты удаляли из резервуаров для гидролиза через 2 часа и фильтровали через сито диаметром 0,85 мм для удаления нерастворимых частиц. Впоследствии гидролизаты охлаждали до 4 ° C и хранили в течение ночи, что привело к накоплению липидов на поверхности гидролизата. Жидкую фракцию центрифугировали на центрифуге Beckman Coulter Avanti J-26S XP (Индианаполис, Индиана, США) при 4 ° C и 10 000 g в течение 10 мин. Наконец, гидролизаты куриных побочных продуктов (CH) фильтровали через сито диаметром 75 мкм и хранили при -20 ° C до использования.Из-за большого объема гидролиза (15 кг исходного материала и 15 кг воды) инактивацию протеолитических ферментов проводили не сразу после гидролиза, а путем автоклавирования определенных объемов аликвот, используемых при приготовлении ферментационной среды.
Эксперименты по выращиванию
Планшеты для микротитрования
Cyberlindnera jadinii LYCC 7549, Thermosacc ® Dry ( Saccharomyces cerevisiae ) (Коллекция культур дрожжей Lallemand, Монреаль W., Канада), anomalus CBS100487 (коллекция штаммов Шведского университета сельскохозяйственных наук, Упсала, Швеция, внутренний штамм номер J121) и B. adeninivorans LS3 (Шведский университет сельскохозяйственных наук, Уппсала, Швеция) хранили в криопробирках, содержащих 20% ( об. / об.) глицерин при — 80 ° С. На рост были протестированы десять различных сред: азотное основание дрожжей без аминокислот и с сульфатом аммония плюс глюкоза (YNBAS + G), азотное основание дрожжей без аминокислот и с сульфатом аммония плюс гидролизат BALI ™ (YNBAS + B), азотное основание дрожжей без аминокислоты и мочевина плюс гидролизат BALI ™ (YNBU + B), дрожжевой экстракт и мясной пептон плюс глюкоза (YP + G), дрожжевой экстракт и мясной пептон плюс гидролизат BALI ™ (YP + B), гидролизат куриных субпродуктов плюс глюкоза (CH + G), гидролизат куриных побочных продуктов плюс гидролизат BALI ™ (CH + B), гидролизат куриных побочных продуктов (CH) и гидролизат BALI ™ (B).Содержание азота (5,86 г / л; на основе содержания азота в YP, содержащем 20 г / л дрожжевого экстракта и 30 г / л мясного пептона, по данным Кьельдаля) и предполагаемое содержание глюкозы (50 г / л) были идентичны в все среды, кроме контрольных, содержащие только сахар (B) или только белок (CH). Обратите внимание, что гидролизат BALI содержит дополнительно 16 г / л углеводов на 50 г глюкозы (дополнительный файл 1: таблица S1). Все компоненты среды индивидуально стерилизовали автоклавированием при 121 ° C в течение 20 минут, а затем смешивали для получения сред с желаемыми композициями.Ночные прекультуры получали добавлением 200 мкл посевной культуры к 25 мл тестируемой среды в 250 мл встряхиваемой колбе с перегородками с последующей инкубацией при 30 ° C, 220 об / мин в течение прибл. 16 ч.
Четыре штамма дрожжей выращивали в системе микротитровальных планшетов Duetz (Duetz-MTPS) (Enzyscreen, Heemstede, Нидерланды), состоящей из 24-квадратных полипропиленовых планшетов с глубокими лунками (11 мл), сэндвич-крышек и зажимов для крышек, которые были помещены в шейкер (Infors HT Shaker Minitron, Боттминген, Швейцария).Автоклавированные и высушенные микротитрационные планшеты заполняли 2,5 мл стерильной жидкой среды. Начальный pH доводили до 5,0 с помощью 1 М NaOH или HCl. В среду инокулировали ночные прекультуры для получения начальной OD 0,5, измеренной при 595 нм с помощью спектрофотометра UV / VIS (Hitachi U1900, Tokyo, Japan). Планшеты инкубировали при 30 ° C при 450 об / мин и отбирали образцы через 8, 16 и 24 часа для измерения сухой массы клеток (CDW), свободного аминного азота и pH. Обратите внимание, что эксперименты были установлены с несколькими лунками для каждого условия, и что каждая лунка была взята только один раз для измерения сухой массы клеток (CDW), свободного аминного азота и pH.Эти эксперименты были выполнены в трех экземплярах.
Периодические ферментации
Биореакторные культивирования проводили в стеклянных ферментерах с общим объемом 2,5 л (Minifors, Infors, Боттминген, Швейцария) с рабочим объемом 1,5 л, оборудованных двумя 6-лопастными крыльчатками Руштона, с использованием YP + G (т.е. 30 г / л мясного пептона, 20 г / л дрожжевого экстракта и 50 г / л глюкозы) и CH + B (т.е. среда «курица + ель»). YP или CH автоклавировали при 121 ° C в течение 15 мин в биореакторах. Глюкозу и гидролизат BALI ™ автоклавировали отдельно.Ночные прекультуры готовили путем добавления 1 мл посевной культуры [80% (об. / Об.) Ночной культуры на стандартном YPD (Sigma-Aldrich, Миссури, США), 20% (об. / Об.) Глицерина, хранящегося в — 80 ° C] в 250 мл среды YP + G или CH + B в 2-литровых встряхиваемых колбах с перегородками, с последующей инкубацией при 30 ° C, 220 об / мин в течение прибл. 16 ч. В биореакторы засевали 30 мл прекультуры в течение ночи (2% (об. / Об.), И каждую ферментацию проводили в двух экземплярах. Температура для всех культивирований составляла 30 ° С. За pH следили с помощью зонда pH (Mettler Toledo, Greifensee, Switzerland). ) и был оставлен на уровне 5.0 путем автоматического добавления 1 M NaOH или 5 M H 2 SO 4 . DO поддерживался примерно на уровне 30% насыщения (± 5%) и регулировался ручной регулировкой скорости мешалки (300–1250 об / мин). Культуры аэрировали через барботер с начальной скоростью 1,5 л / мин (1 VVM), которую увеличивали до 3 л / мин (2 VVM) во время ферментации для поддержания DO. Анализ выхлопных газов CO 2 и O 2 выполняли с помощью анализатора отходящих газов FerMac 368 (Electrolab Biotech, Tewkesbury, UK).Пенообразование контролировали с помощью датчика пены с пятикратным разбавлением пеногасителя Glanapon DB 870 (Busetti, Вена, Австрия). Данные ферментации регистрировали с использованием программного обеспечения для управления процессом IRIS (Infors). Во время ферментации каждые два часа отбирали образцы для анализа супернатанта культуры и биомассы дрожжей.
Аналитические методы
Сухая масса клеток (CDW)
Образцы ферментационного бульона (25 мл из биореакторов и 2 мл из микропланшетов) центрифугировали при 4700 g (25 мл) или 10000 g (2 мл) в течение 5 минут при 4 °. C и супернатант собирали для дальнейших анализов (сахара, органические кислоты, этанол, свободный аминный азот, белок).Затем дрожжевые клетки дважды промывали холодной дистиллированной водой, замораживали при -20 C и затем лиофилизировали с использованием Alpha 2-4 LDplus (Martin Christ, Osterode am Harz, Германия) при -60 ° C и вакууме 0,01 мбар. за 48 ч. После определения их веса для расчета CDW высушенные клетки использовали для анализа содержания белка, аминокислот, нуклеиновых кислот, липидов, волокон, минералов и золы, а также анализировали с помощью FTIR-спектроскопии.
Моносахариды, органические кислоты и этанол
Моносахариды (d-глюкоза, d-ксилоза), органические кислоты (молочная кислота, уксусная кислота) и этанол, присутствующие в ферментационном бульоне, были проанализированы с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с показателем преломления. обнаружение.Образцы разбавляли в 10 раз дистиллированной водой и 200 мкл фильтровали под вакуумом через 96-луночные фильтровальные планшеты (0,45 мкм). Образцы разделяли на аналитической колонке Rezex ROA-Organic acid H +, 300 × 7,8 мм 2 (Phenomenex, Торранс, Калифорния, США), снабженной защитной колонкой картриджа катион-H, с использованием температуры колонки 65 ° C, 5 мМ H 2 SO 4 в качестве элюента и скорость потока 0,6 мл / мин. Кроме того, моносахариды анализировали с помощью высокоэффективной анионообменной хроматографии (HPAEC) с использованием системы Dionex ICS 3000 (Dionex, Саннивейл, Калифорния, США), оснащенной колонкой CarboPac PA1, работающей при 30 ° C, и с импульсным амперометрическим детектированием (PAD ), где можно было количественно определить d-ксилозу, l-арабинозу, d-маннозу и d-галактозу.Моносахариды элюировали изократически при скорости потока 0,25 мл / мин, используя 1 мМ КОН, полученный с помощью генератора элюента. Данные ВЭЖХ собирали и анализировали с помощью Chromeleon 7.0.
Свободный азот амино
Анализ на основе нингидрина был проведен для того, чтобы проследить потребление свободного азота амино во время ферментации [21]. Нингидрин реагирует со свободными альфа-аминогруппами, что приводит к синему продукту, который можно количественно определить колориметрическим методом путем измерения оптической плотности при 575 нм.Глицин использовали для построения стандартной кривой с известным содержанием свободного аминного азота (0,04–0,4 г / л азота). 10 мкл (при необходимости разбавленных) образцов добавляли к 100 мкл реагента нингидрина с ацетатным буфером, pH 5,5 (содержащего 25 мкл / мл SnCl 2 ), смешивали и инкубировали при 100 ° C в течение 10 мин. Анализ выполняли в формате микропланшетов (два повтора), и оптическую плотность измеряли с помощью гибридного многомодового микропланшетного ридера Synergy h5 (BioTek, Winooski, Vermont, US)
Содержание белка
Общий азот измеряли по методу Кьельдаля ( Регламент Европейской комиссии [EC] №: 152/2009, стр. 15–19) с использованием Kjeltec TM 8400 (FOSS, Tecator, Höganäs, Швеция) после кислотного разложения в автодигесторе (FOSS, Tecator, Höganäs, Швеция).Содержание белка в образцах оценивали путем умножения общего азота на 6,25 раза.
Аминокислоты
Анализ содержания аминокислот (кроме триптофана) в лиофилизированных дрожжах проводили в соответствии с постановлением ЕС № 152/2009 (стр. 23–32) с использованием анализатора аминокислот Biochrom 30 (Biochrom Ltd). ., Кембридж, Великобритания). Триптофан анализировали в соответствии с постановлением ЕС №: 152/2009 (стр. 32–37) с использованием системы ВЭЖХ Dionex Ultimate 3000 (Dionex Softron GmbH, Гермеринг, Германия), соединенной с детектором флуоресценции RF-535 (Shimadzu., Киото, Япония). Все аминокислоты были количественно определены с использованием внешних стандартов (Dionex Ltd., Surrey, UK).
Нуклеиновые кислоты
Содержание нуклеиновых кислот в биомассе дрожжей определяли спектрофотометрически с помощью анализа дифениламина (ДНК) и анализа орцинола (РНК) после экстракции разбавленной хлорной кислотой [22]. Перед экстракцией 50 мг лиофилизированных дрожжевых клеток промывали 1,5 мл 0,9% физиологического раствора (холодный), а затем 1,5 мл 0,2 М HClO 4 (холодный). Впоследствии 1.Добавляли 5 мл 0,5 M HClO 4 , клетки инкубировали при 70 ° C в течение 15 минут, центрифугировали и супернатант сохраняли. К клеткам добавляли еще 1,5 мл 0,5 M HClO 4 с последующим перемешиванием, еще одной инкубацией при 70 ° C в течение 15 минут и центрифугированием. Супернатанты объединяли и разбавляли до 5,0 мл 0,5 М HClO 4 . HClO 4 -экстракты дрожжевых клеток и стандарты ДНК (ДНК тимуса теленка; Sigma D4522) смешивали с дифениламиновым реагентом 1: 1 (об: об) (исходный раствор 1.5 г дифениламина, 100 мл ледяной уксусной кислоты, 1,5 мл концентрированной серной кислоты и 1 мл раствора ацетальдегида) в 96-луночных планшетах, инкубировали при 30 ° C в течение ночи, оптическую плотность считывали при 600 нм на микропланшетном ридере Spectramax M2 e . (Molecular Devices, LLC, Сан-Хосе, Калифорния, США). HClO 4 -экстракты дрожжевых клеток и стандарты РНК (РНК из пекарских дрожжей; Sigma R6750) смешивали с раствором H 2 SO 4 / H 2 O (об. / Об.; 85/15) в 96-луночных планшетах и инкубировали при 40 ° C в течение 24 часов.Затем добавляли реагент орцинола (исходный раствор 0,35 мл 6% (мас. / Об.) Орцинола в 5 мл концентрированной HCl) и планшеты инкубировали при осторожном встряхивании при 100 ° C в течение 30 минут, после чего определяли поглощение при 500 нм. прочитать на микропланшетном ридере Spectramax M2 e (Molecular Devices).
Липиды
Общее содержание липидов в лиофилизированной биомассе дрожжей определяли с помощью ускоренной экстракции растворителем [23]. Экстракцию проводили при 125 ° C и 1500 psi смесью 70% петролейного эфира — 30% ацетона в ускорительном экстракторе растворителем Dionex ASE 350 (Dionex, Саннивейл, Калифорния, США).Затем растворитель помещали в стакан для сбора, который погружали в водяную баню с температурой 60 ° C для выпаривания под давлением N 2 . Через 10 мин в стакане для сбора оставались только липиды, и их помещали в вакуумную сушилку при 70 ° C на 30 мин. Наконец, образцы помещали в эксикатор и взвешивали липиды.
Минералы и зола
Минеральное содержание лиофилизированной биомассы дрожжей было проанализировано с помощью масс-спектрометрии с индуктивно связанной плазмой (ICP-MS) (Agilent 8800 QQQ, Санта-Клара, Калифорния, США).Образцы разлагали 65% -ной HNO 3 в высокопроизводительном микроволновом реакторе (UltraClave, MLS, Milestone, Sorisole, Италия) [24]. Для разложения галогенидов (анионов) образцы использовали концентрированный 25% (мас. / Мас.) Гидроксид тетраметиламмония. Анализ минералов был подтвержден с использованием сертифицированных стандартных образцов NCS DC73349 (Национальный аналитический центр черной металлургии, Пекин, Китай) и CRM GBW07603 (Национальный исследовательский центр CRM, Пекин, Китай). Зольность лиофилизированной биомассы дрожжей определялась в соответствии с техническим отчетом NREL / TP-510-42622 Национальной лаборатории возобновляемых источников энергии [25].
Инфракрасная спектроскопия с преобразованием Фурье (FTIR)
FTIR-анализ лиофилизированной биомассы дрожжей был выполнен с помощью FTIR-спектрометра Agilent серии 5500 (Agilent, Санта-Клара, США) с использованием кристалла алмаза типа IIA с одним отражением и ослабленным полным отражением ) аксессуар с образцом пресса. Примерно 10 мг лиофилизированных образцов дрожжей были измерены в спектральном диапазоне 4000–650 см, –1, с разрешением 8 см, –1, и 32 сканированием. Фоновые спектры (пустой кристалл) измеряли перед каждой пробой и использовали для коррекции.Кристалл алмаза приставки ATR (Attenuated Total Reflection) очищали 70% изопропанолом и дистиллированной водой после каждого измерения. Полученные необработанные спектры были подвергнуты EMSC (Extended Multiplicative Signal Correction) [26]. Обработку спектров проводили с помощью The Unscramble X 10.5 (CAMO Software, Осло, Норвегия).
Статистический анализ
Эксперименты по выращиванию в Duetz-MTPS и в ферментерах на 2,5 л проводили в трех и двух повторностях, соответственно.Представленные результаты являются средним значением для повторов, а стандартные отклонения показаны в виде столбцов ошибок на рисунках. Обработка данных и статистика выполнялись с помощью программного пакета Excel (Microsoft Excel 2013, Microsoft Corp., Редмонд, Вашингтон). ANOVA (α = 0,05) использовался для анализа различий в аминокислотном составе с использованием JPM v.14.1 (SAS, Кэри, Северная Каролина, США) и сравнения всех пар с использованием Tukey – Kramer HSD (Honest Significant Difference). Анализ главных компонентов (PCA) был выполнен с использованием The Unscrambler X, V10.5 (CAMO, Осло, Норвегия).
Повышение надоя молока с помощью дрожжей
Несколько исследований подтвердили, что добавление чистых дрожжей из Saccharomyces cerevisiae может увеличить надои и снизить загрязнение молока микотоксинами.
За последние десятилетия в молочном животноводстве произошли серьезные преобразования, которые включают улучшение питания, здоровья и благополучия животных, качества и добавленной стоимости конечного продукта. По данным FAO (2019), мировое производство молока в 2019 году достигло 852 млн тонн, увеличившись на 1.4% по сравнению с 2018 годом — это количество основных производителей из Индии, Пакистана, Бразилии, Евросоюза, Российской Федерации и США.
Однако в этой области существует множество проблем, которые могут привести к пикам стресса у животных и ухудшить производство и качество молока. Следовательно, очень важно, чтобы иммунная система дойных коров была усилена, чтобы они могли более эффективно реагировать на внезапные события, вызванные интенсивным производством на ежедневной основе.
S. cerevisiae: несколько положительных преимуществ
В этом контексте, помимо размышлений об улучшении иммунитета, мы должны думать о питании и здоровье рубца, учитывая, что рубец с хорошо питаемой, здоровой и должным образом стимулированной флорой обеспечивает более высокую продуктивность. нормы, связанные с улучшением здоровья животных.
Использование функциональных ингредиентов, которые обеспечивают улучшение здоровья животных и повышение продуктивности, как правило, становятся важными элементами в рационе молочного скота. RumenYeast — это чистые дрожжи из Saccharomyces cerevisiae , которые проходят процесс автолиза, в котором конечный продукт состоит из витаминов, пептидов, свободных аминокислот и функциональных углеводов, таких как MOS и β-глюканы. RumenYeast предлагает идеальное питание для микробиоты рубца, потому что, помимо улучшения здоровья кишечника и укрепления иммунной системы, он поддерживает pH и стимулирует целлюлозолитические бактерии, тем самым улучшая состояние рубца.
Несколько исследований показали, что RumenYeast может увеличить надои молока на +2 кг / корову в день (, рисунок 1, ), а также снизить уровень SCC (, таблица 1, ), а также снизить загрязнение молока микотоксинами (, рисунок ). 2 ).
Рисунок 1 — Производство молока коровами, которые получали рационы с RumenYeast во всем мире.
Посмотреть увеличенное изображение карты можно здесь
В исследовании Gonçalves et al. (2017) в Университете Сан-Паулу (Пирассунунга, Бразилия) дойным коровам вводили AFB1, чтобы оценить влияние различных дрожжевых добавок на выведение AFM1 с молоком.Афлатоксин вводили перорально — 2 капсулы, содержащие 120 мкг AFB1 каждая, — сразу после доения утром и днем (всего 480 мкг AFB1 в день) в течение 6 дней подряд (начиная с 1 дня эксперимента). Добавки вводили — 20 г / голову / день — в течение 7 дней подряд, начиная с 4-го дня эксперимента. Результаты показали, что RumenYeast работает лучше, чем другие продукты, поскольку снижает процентные уровни переноса AFM1 в молоко (, рис. 2, ).
Улучшение количества и качества молока
В текущем сценарии рынка молочной продукции увеличение количества производимого молока должно быть связано с качеством продукта, а это, в свою очередь, связано с благополучием животных.Сочетание правильного питания рубца с укреплением иммунной системы животных обеспечивает более высокую продуктивность и ежедневное качество молока, а также снижает опасения по поводу наличия остатков в молоке, что является важным фактором завоевания все более требовательного потребительского рынка.
Ссылки доступны по запросу
Лилиана Борхес и Мелина Бонато, НИОКР, ICC Brazil
Выращивание дрожжей для корма из норвежских елей
Крупномасштабные испытания кормления
Промышленный масштаб 1600 кг дрожжей, произведенных за один цикл ферментации из нескольких тысяч литров сахара, произведенного из норвежской ели.Дрожжи, источник микробного белка с содержанием белка 50-60%, будут использоваться в крупномасштабных испытаниях кормления свиней и атлантического лосося.
При координации с Foods of Norway сахар из норвежских елей производился компанией Borregaard, занимающейся биопереработкой. Это было использовано для выращивания дрожжей на производственном предприятии Lallemand в Эстонии, и эти процессы были расширены учеными из Норвежского университета естественных наук.
Завод по производству дрожжей Lallemand в Салутагузе, Эстония.Фото: LallemandРаскрытие потенциала дрожжей
«Мы работаем с этим с 2015 года. Идея возникла в результате более раннего эксперимента с Borregaard в 2011 году, когда мы обнаружили, что дрожжи для кормления лососем, полученные из древесного сахара, показали хорошие результаты и были здоровее. Тогда мы поняли, что у этого есть потенциал », — рассказывает All About Feed профессор Маргарет Оверланд, глава отдела продуктов питания Норвегии.
Дрожжи собирают с использованием технологии, которая включает превращение побочных продуктов деревьев в сахар путем термохимической обработки в сочетании с новой ферментной технологией.Затем используется технология ферментации с использованием специального штамма дрожжей для преобразования сахаров в дрожжи с последующей обработкой и сушкой для производства высококачественного дрожжевого порошка, богатого белком.
Новые связующие для кормовых гранул, полученные из лесной биомассыКормовые связующие высокоэффективны, но также дороги. Вот почему производители кормов ищут альтернативные варианты привязки кормов. Исследование показывает, что галакто-глюкоманнан, полученный из ели, может быть многообещающей альтернативой. Подробнее…
Испытания лосося и свиней
«Мы входим в захватывающий этап, когда мы будем оценивать дрожжи в рационах для лосося в морской воде и для поросят в условиях фермы», — говорит она, добавляя, что команда будет следить за всем производственно-сбытовая цепочка от древесной биомассы до конечных мясных и рыбных продуктов.Испытания на лосося начнутся в октябре 2021 года и продлятся до июня 2022 года, а испытания на поросятах начнутся в ноябре 2021 года и продлятся до апреля 2022 года.

 3 Питательные среды, их
3 Питательные среды, их  А так же могут применяться
отходы целлюлозно-бумажного производства;
А так же могут применяться
отходы целлюлозно-бумажного производства;