Реферат
Министерство образования и науки Российской Федерации
Кафедра техники и технологий машиностроения и пищевых производств
Рубцовский индустриальный институт (филиал) государственного образовательного учреждения высшего профессионального образования
«Алтайский государственный технический университет им. И. И. Ползунова»
Тема: «Технология производства хлебопекарных дрожжей».
Выполнил студент группы ТМО-31
Мерзлова А.С.
Проверил к.т.н. доцент
Апполонов А.А.
г. Рубцовск
СОДЕРЖАНИЕ
Введение
Основная часть 6
История возникновения хлебопекарных дрожжей 6
Характеристика продукции, сырья и полуфабрикатов 8
Стадии технологического процесса 9
Устройство и принцип действия технологической линии
производства хлебопекарных дрожжей 10
Устройство и принцип действия дрожжевого аппарата 13
2 Заключение 16
3 Список литературы 18
Введение
Хлебопекарные
дрожжи являются биологическими
разрыхлителями и им принадлежит ведущая
роль в формировании качества хлеба. Их
главная функция обусловлена самим
составом дрожжей, которые на 44-75% состоят
из белков, на 30-50% — из углеводов, и на
5-10% — из минеральных неорганических
веществ, на 5-12% — из азота.
Их
главная функция обусловлена самим
составом дрожжей, которые на 44-75% состоят
из белков, на 30-50% — из углеводов, и на
5-10% — из минеральных неорганических
веществ, на 5-12% — из азота.
Так
что будучи особыми белками дрожжи прежде
всего обладают всеми их свойствами. При
этом содержание витаминов (витамины
группы В — В1, В2, В6; РР- никотиновая
кислота, биотин, фоливоевая и
пара-аминобензойная кислоты, пантеонат
кальция, инозит и др.) в дрожжах во много
раз больше чем в овощах, молоке или
плодах. Особенно много витаминов
содержится в сухих дрожжах, так как
процесс удаления влаги при сушке и
обработка их ультрафиолетом не сказывается
на качественном и количественном
состоянии витаминов, а наоборот,
способствует их сохранению. Количество
витаминов, синтезируемыми отдельными
видами и штаммами дрожжей варьируются
в широких пределах и на сдвиги накопления
витаминов особенное влияние оказывает
характер источника углерода в питательной
среде и при выращивании дрожжей на
средах, содержащих витамины, увеличивается
и их содержание в готовых дрожжах за
счет адсорбции их из среды.
Наличие в дрожжах большой группы витаминов стимулирует не только хлебопекарные, но и ферментативные свойства дрожжей, так как являясь белками дрожжи сохраняют все их свойства.
Хлебопекарные
дрожжи относятся к определенному штамму
дрожжей Сахаромицетов, выращиваются
размножением чистой культуры этих
грибов в определенной питательной среде
– мелассе, которая является отходом
свекловично-сахарного производства
или же из отходов спиртовых заводов,
путем выделения отработанных дрожжей
из мелассы – спиртовой бражки. Меласса
– темная густая жидкость, в которой
содержатся сахароза, азотистые и
минеральные вещества. Процесс производства
хлебопекарных прессованных дрожжей
включает несколько технологических
операций: приготовление питательной
среды, выращивание дрожжей периодическим
или непрерывно-поточным методом в
ферментерах при аэрировании, сепарирование,
формовку, прессование и упаковку. Эта
смена условий для жизнедеятельности
обусловливает те разнообразные свойства,
которыми должны обладать хлебопекарные
дрожжи.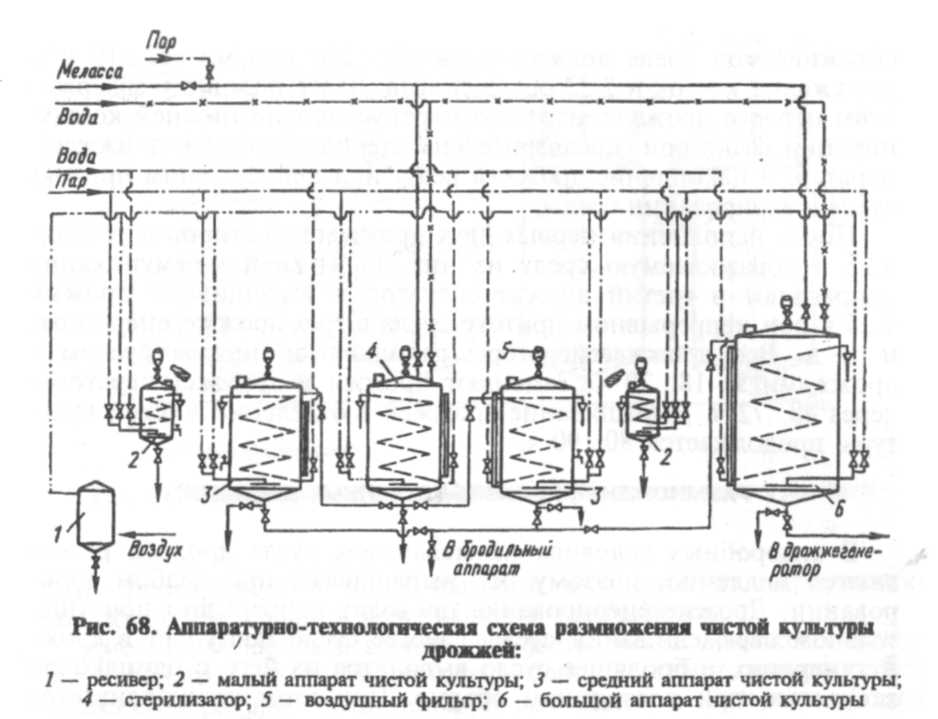
Для развития производства хлебопекарных дрожжей и увеличения производительности являются такие факторы как:
Повышение качества изготовляемой продукции.
Совершенствование технологического процесса.
Внедрение в производство лучших достижений наук и техники.
Создание высокопроизводитеных и малогабаритных технологических машин, обеспечивающих высокий технологический эффект работы и меньший удельный расход энергии.
Осуществление полной автоматизации технологического процесса.
Производство хлебопекарных прессованных дрожжей. Бесплатный доступ к реферату
Введение
Дрожжи это грибы, которые существуют повсюду или на протяжении большей части жизненного цикла в виде отдельных клеток.
Дрожжи обладают всеми основными свойствами и признаками грибковых организмов, являясь органотрофными эукариотами с поглощающим типом питания, но их одноклеточная структура влечет за собой ряд последствий.
Дрожжи растут и размножаются с большой скоростью, вызывая значительные изменения в окружающей среде. Самым известным для дрожжевого процесса алкогольной ферментации явилась причина широкого практического использования дрожжей с древних времен. Именно это свойство привело к тому, что дрожжи исторически всегда рассматриваются отдельно от других грибов. Автономия группы дрожжей в научных терминах также подтверждается тем фактом, что методы их исследования более похожи на бактериологические, чем микологические методы. Тем не менее, дрожжи сохраняют до сих пор независимость среди других грибов, скорее по традиции, чем по общему биологическому принципу. Постоянное обнаружение все большего числа новых переходных и промежуточных форм среди нитчатых грибов и дрожжей делает все более трудным и условным, чтобы нарисовать границы между ними.

Основная цель работы — описать общие характеристики пекарских дрожжей.
Для достижения этой цели мы должны выполнить следующие задачи:
— дать характеристику хлебопекарных дрожжей;
— рассмотреть опыт и перспективы производства хлебопекарных прессованных дрожжей;
— выявить основные компоненты питательной среды;
— охарактеризовать способы накопления биомассы дрожжей;
— проанализировать проблемы и задачи при производстве прессованных дрожжей
— провести анализ рынка хлебопекарных прессованных дрожжей в РФ и в мире.
Характеристика хлебопекарных дрожжей
Хлебопекарские дрожжи являются основным видом сырья для производства хлеба и хлебобулочных изделий.
Технологическая и функциональная роль дрожжей заключается в биологическом рыхлении теста двуокисью углерода, выделяемой во время алкогольной ферментации, давая испытание определенным реологическим свойствам, а также образование этилового спирта (этанола) и других продуктов реакции, участвующих в образовании вкус и аромат хлебобулочных изделий.
Дрожжи, используемые в производстве хлебобулочных изделий, относятся к виду Saccharomyces cerevisial. Это крупноячеистые овальные дрожжи, адаптированные к повышенной кислотности теста и его кислотообразующая микрофлора.
Дрожжи ферментируют глюкозу, фруктозу, сахарозу, мальтозу, простые декстрины; не бродить лактозу, крахмал, целлюлозу. Они поглощают этиловый спирт, молочную кислоту, уксусную кислоту. Дрожжевая клетка состоит из мембраны, цитоплазматической мембраны и цитоплазмы. Ее размер составляет в среднем 8-10 мкм. Оболочка представляет собой плотную, прочную и эластичную структуру, обеспечивающую постоянство формы ячейки и выдерживающую значительное осмотическое давление (до 2 МПа). Оболочка, имеющая селективную проницаемость, обеспечивает транспортировку питательных веществ, клетку и удаление из нее продуктов обмена. Цитоплазматическая мембрана расположена непосредственно под клеточной стенкой. Основная функция мембраны заключается в выявлении продуктов обмена. Кроме того, некоторые ферменты и происхождение ряда веществ, включая биосинтез компонентов клеточной стенки, локализуются в цитоплазматической мембране.

Рибосомы представляют собой ультрамикроскопические гранулы в форме нерегулярных шариков, состоящих из белка РНК. В рибосомах синтезируются белки и ферменты. Ядро находится в форме круглого или овального пузыря, окруженного оболочкой. Основной функцией ядра является хранение и передача генетической информации при делении клеток. Эндоплазматический ретикулум — это сложная мембранная сеть, которая образует множество каналов, пол которых различные вещества перемещаются из внешней оболочки в центр.

 Внутриклеточная влажность находится в свободной и связанной форме. Связанная вода, которая является частью коллоидов клетки, не является растворителем, она не замерзает хорошо, ее трудно испарить и не выжать. Связанная влага — это растворитель сухих веществ (с.в) клеточного сока.
Внутриклеточная влажность находится в свободной и связанной форме. Связанная вода, которая является частью коллоидов клетки, не является растворителем, она не замерзает хорошо, ее трудно испарить и не выжать. Связанная влага — это растворитель сухих веществ (с.в) клеточного сока.Согласно исследованиям, в дрожжевой клетке присутствуют фосфор, калий, кальций, магний, алюминий, сера, хлор, железо, кремний.
Состав органических веществ пекарских дрожжей (% от м.в.):
Азот 6-8
Белки 37-50
Жир 1,5-2,5
Нетоксичные вещества 35-45
Пепел 6-10
Состав дрожжевых белков содержит 24 аминокислоты. Состав дрожжевых углеводов включает (в% от dv): Trehalose 8.6 Mannan 15.2 Glucan 7.1 Гликоген 13.3 Алкогольная ферментация в тесте проводится с участием их ферментного комплекса, в частности зимнего комплекса, с помощью ряда промежуточных реакций в в соответствии с циклом Кребса.
Опыт и перспективы производства хлебопекарных прессованных дрожжей
В настоящее время отечественное производство дрожжей полностью обеспечивают российский рынок. Многие заводы провели техническое перевооружение и увеличили производство, но в общем, техническое состояние производства остается на низком уровне.
Многие заводы провели техническое перевооружение и увеличили производство, но в общем, техническое состояние производства остается на низком уровне.
Износ основного технологического оборудования составляет около 60%, из-за отсутствия финансирования практически внедрены передовые технологии, связанные с энергосбережением, более эффективным использованием сырья и решением экономических проблем.
При постоянном повышении цен на мелассы, тепловые и энергетические ресурсы и на железнодорожном транспорте сокращение стоимости дрожжевых заводов является проблематичным, лишая предприятия возможности для увеличения оборотных средств и обеспечения технического и социального развития.
Например, меласса приобретается по кредиту с процентной ставкой, которую компания рассчитывает с банком до следующего сельскохозяйственного года. Кроме того, цена на мелассы (вторичное сырье) выше, чем цена на сахарную свеклу (первичное сырье).
Требования к составу питательной среды
Для выращивания дрожжей в промышленности используются три вида гидролизных сред: гидролизат, бард и смесь барда с гидролизатом. Они служат источником основной составляющей дрожжей — углерода.
Они служат источником основной составляющей дрожжей — углерода.
В процессе жизнедеятельности дрожжи ассимилируют углерод из таких соединений, как соединения гидролиза, такие как сахара и органические кислоты (главным образом уксусные). Основное различие между этими средами заключается в количестве содержащихся в них питательных веществ и соотношении сахаров (PB) и органических кислот.
Таким образом, гидролизат содержит 3,0-3,5% РВ и только 03-0,5% органических кислот, что составляет всего около 10% от общего количества сахаров и кислот. Бард содержит РВ 0,6-0,7%, органические кислоты — около 0,2%, т. е. их доля в сумме источников углерода для дрожжей составляет до 25%. В смеси барда и гидролизата это соотношение может быть очень разнообразным, в зависимости от того, сколько гидролизата добавляется к барду. Состав сахара барда и гидролизата также различен.
Бард содержит только пентозные сахара, в гидролизате около 20% сахаров — пентозы, около 80% гексозы. По питательной ценности сахара и органических кислот не равны. Известно, что значение источника углерода как питательного вещества для микроорганизма и зависит от степени окисления атомов углерода, которые составляют молекулу этого вещества. С этой точки зрения все углеродные соединения в соответствии с их питательной ценностью могут быть расположены следующим образом. Двуокись углерода, где атом углерода полностью окислен, не может быть фактически источником энергии для микроорганизмов. Используя его в качестве строительного материала, микробы могут находиться только в присутствии других источников энергии (например, при фотосинтезе). Органические кислоты, содержащие карбоксил, где три валентности насыщены кислородом, и только один все еще может быть окислен
Известно, что значение источника углерода как питательного вещества для микроорганизма и зависит от степени окисления атомов углерода, которые составляют молекулу этого вещества. С этой точки зрения все углеродные соединения в соответствии с их питательной ценностью могут быть расположены следующим образом. Двуокись углерода, где атом углерода полностью окислен, не может быть фактически источником энергии для микроорганизмов. Используя его в качестве строительного материала, микробы могут находиться только в присутствии других источников энергии (например, при фотосинтезе). Органические кислоты, содержащие карбоксил, где три валентности насыщены кислородом, и только один все еще может быть окислен
Зарегистрируйся, чтобы продолжить изучение работы
. Питательная ценность кислот зависит от радикала. Такие кислоты, как муравьиная и щавелевая, практически не используются микроорганизмами.
Питательная ценность кислот зависит от радикала. Такие кислоты, как муравьиная и щавелевая, практически не используются микроорганизмами.
Уксусная кислота используется дрожжами, но выход биомассы ниже, чем при использовании сахаров. Сахара, которые содержат полуокисленные атомы углерода, включенные в группы -Ch3OH, -CHOH-, = СОН. Такие атомы легче всего подвержены окислительно-восстановительным превращениям, поэтому содержащиеся в них вещества имеют высокую питательную ценность для дрожжей. Согласно литературным данным, выход биомассы (абсолютно сухой) из сахаров может достигать 57_80%. В дополнение к сахару его также можно отнести к другим веществам, содержащим спиртовую группу — глицерин, маннит, винную кислоту, лимонную кислоту и т. Д. Соединения с большим количеством метильных (-Ch4 и метиленовых (-Ch3-) групп, таких как как углеводороды (газообразные и парафиновые ряды), высшие жирные кислоты, которые могут служить источником углерода для микроорганизмов и, в частности, для дрожжей. Выход биомассы из них более 100%, однако их потребление затрудняется тем, что эти вещества плохо растворяются в воде и, кроме того, они не могут без частичного окисления участвовать в реакциях внутри клетки, поэтому ассимиляция таких веществ идет в два этапа: сначала они окисляются, а затем полуокисленные продукты используются клеткой. Сахар к органическим кислотам также неравный в том, что в результате использования рН дрожжей (активная кислотность) среды изменяется по-разному. Если использование сахаров в сочетании с сульфатом аммония в качестве источника nitrog en — сильное подкисление культуральной среды; При обработке сахаров с аммиачной водой среда остается нейтральной; При использовании тузов с дрожжами в сочетании с любым источником азота (сульфат аммония, аммиачная вода) культуральная среда (бражка) подщелачивается.
Выход биомассы из них более 100%, однако их потребление затрудняется тем, что эти вещества плохо растворяются в воде и, кроме того, они не могут без частичного окисления участвовать в реакциях внутри клетки, поэтому ассимиляция таких веществ идет в два этапа: сначала они окисляются, а затем полуокисленные продукты используются клеткой. Сахар к органическим кислотам также неравный в том, что в результате использования рН дрожжей (активная кислотность) среды изменяется по-разному. Если использование сахаров в сочетании с сульфатом аммония в качестве источника nitrog en — сильное подкисление культуральной среды; При обработке сахаров с аммиачной водой среда остается нейтральной; При использовании тузов с дрожжами в сочетании с любым источником азота (сульфат аммония, аммиачная вода) культуральная среда (бражка) подщелачивается.
Гидролизат в барде отличается друг от друга разным содержанием вредных и полезных примесей в них. Бард — более мягкая и более полная окружающая среда. Это связано с тем, что бард уже прошел один биологический магазин — спирт, где некоторые из вредных примесей гидролизата адсорбировались спиртовыми дрожжами, часть его разрушалась, часть ее испарялась при перегонке спирта на колонне. Кроме того, из-за метаболизма алкогольных дрожжей бард содержит значительное количество биостимуляторов. Гидролизат практически не содержит их. У барда в плане сахара гораздо больше микроэлементов, потому что с равным количеством элементов, которые перешли в эти среды из дерева, содержание сахара в барде в 5-6 раз меньше, чем в гидролизате. Все эти особенности этих сред имеют большое значение для выращивания дрожжей и должны учитываться при разработке режима. Таким образом, тип окружающей среды зависит от выбора источника азота, количества минеральных добавок, выбора дрожжевой расы (все дрожжи могут расти на барде, на гидролизате без добавления биостимуляторов — только ауто-аусотрофный дрожжи типа Sapadida scottii, которые сами синтезируют биос из неорганических веществ) (определяется содержанием сахара в среде) и другими факторами.
Кроме того, из-за метаболизма алкогольных дрожжей бард содержит значительное количество биостимуляторов. Гидролизат практически не содержит их. У барда в плане сахара гораздо больше микроэлементов, потому что с равным количеством элементов, которые перешли в эти среды из дерева, содержание сахара в барде в 5-6 раз меньше, чем в гидролизате. Все эти особенности этих сред имеют большое значение для выращивания дрожжей и должны учитываться при разработке режима. Таким образом, тип окружающей среды зависит от выбора источника азота, количества минеральных добавок, выбора дрожжевой расы (все дрожжи могут расти на барде, на гидролизате без добавления биостимуляторов — только ауто-аусотрофный дрожжи типа Sapadida scottii, которые сами синтезируют биос из неорганических веществ) (определяется содержанием сахара в среде) и другими факторами.
Основные компоненты питательной среды (меласса, топинамбур)
Процесс приготовления раствора мелассы состоит из разбавления и очистки. Осветлите мелассу, чтобы удалить крупные взвешенные частицы, коллоиды, микроорганизмы и другие примеси.
Существует несколько способов очистки мелассы при производстве дрожжей. Выбор того или иного метода обычно происходит из-за устройства подготовительного отделения.
Механический метод. В настоящее время на большинстве дрожжевых растений меласса осветляется с помощью осветлителей, где взвешенные частицы разделяются центробежной силой. Этот метод очистки позволяет экономить мелассы, вспомогательные материалы, пар, кроме того, сокращается время для осветления.
Перед запуском на осветлитель мелассы взвешивают и разбавляют водой до определенной концентрации (коэффициент разбавления 1-3), добавляют хлорную известь со скоростью 2-3 кг (с содержанием 33% активного хлора) на 1 т. После того как раствор смешивают с хлорной извести, получается получасовое «хлорирование», затем добавляют серную кислоту до тех пор, пока не будет получен рН 4,5-5,0 и отправлен в осветлитель.
На некоторых предприятиях используется стерилизация мелассы. При этом его разбавляют горячей водой при температуре 80-90 ° C и направляют в стерилизатор. Стерилизацию проводят при температуре 105-125 ° С в течение 15-60 с, после того как раствор патоки охлаждают до 80-85 ° С и подают в осветлитель.
Стерилизацию проводят при температуре 105-125 ° С в течение 15-60 с, после того как раствор патоки охлаждают до 80-85 ° С и подают в осветлитель.
Кислотный метод. Этот метод используется при производстве дрожжей небольших емкостей (5-10 т / сут) и отсутствии осветлителей. В емкости для мусора собираются вода и меласса (для 1 т мелассы около 0,75 м3 воды). После перемешивания хлористую известь покрывают в аппарате со скоростью 0,6-0,9 кг активного хлора, затем перемешивают еще 30 минут и оставляют сусло в состоянии покоя на 30 минут. За это время микробы — вредители производства дрожжей — становятся без хлора и постепенно умирают.
После выдерживания добавляют мешалку, добавляют серную кислоту до достижения рН 5,0, перемешивают в течение 30 минут и добавляют воду к содержанию твердых веществ в мелассе 20-40% (в зависимости от концентрации, принятой на растении) и дает затор на 10-12 часов (пока меласса не станет прозрачной).
Дозировка раствора патоки осуществляется в соответствии с программой с помощью автоматических устройств или вручную.
Когда меласса осветляется с помощью неаккуратно-кислотного метода, потери мелассы составляют 1,8-1,4% от исходного объема.
Чтобы уменьшить потерю мелассы во время осветления при производстве дрожжей, они в основном переключились с метода осаждения на механические (с использованием осветлителей), что уменьшает потери до 0,14%.
Современная технология производства дрожжей предъявляет требования к составу патоки из-за необходимости увеличения урожая дрожжей на товарной стадии до 80-90% с точки зрения сырья и максимизации производства дрожжей из каждой линии дрожжеводства устройства.
Содержание сахаров в мелассе варьируется в широких пределах, но при выборе схем обработки учитывается патока, содержащая 46% сахаров.
В мелассе с повышенным содержанием углеводов (более 50%) для строительства дрожжевых клеток несахаров мало: зола, азот и биотип. В связи с этим отношение массы перечисленных веществ к массе сахаров значительно снижается, а избыток сахара расходуется не на накопление биомассы, а ферментируется с образованием спирта.
Нормализация состава нижней патоки
При обработке мелассы, содержащей недостаточное количество азотистого, растительного и зольного веществ, необходимо добавить недостающие компоненты. Нормализация состава питательной среды приводит к стабилизации выхода дрожжей и к улучшению качества готового продукта.
Когда дрожжи выращивают в соответствии с периодическими схемами, питательная среда нормализуется путем добавления источников биотипа (кукурузного экстракта или дестбобиотина), солей калия и магния в начале процесса выращивания. Полный экстракт кукурузы применяют в количестве 6%, а соли калия — 3,5% калия в мелассе, содержащей 46% сахара.
Нормализация питательной среды во время выращивания дрожжей непрерывной (например, ежедневной) схемой осуществляется следующим образом: кукурузный экстракт подается во время загрузки (складок) дрожжевого аппарата со скоростью 6 % и соли калия 3,5% (К2О) до мелассы, потребляемой в кумулятивном периоде.
Во второй раз кукурузный экстракт и соли калия добавляют в начале периода оттока, исходя из мелассы, обработанной в течение 6 часов. Кроме того, недостающие ингредиенты добавляют через 6 часов оттока среды, в зависимости от обрабатываемой патоки в течение следующих 6 часов.
Кроме того, недостающие ингредиенты добавляют через 6 часов оттока среды, в зависимости от обрабатываемой патоки в течение следующих 6 часов.
Способы накопления биомассы дрожжей
Для производства хлебопекарских дрожжей используются быстрорастущие расы верхней ферментации. В отечественной хлебопекарной промышленности используются расы № 14, Узловский № 1 и № 2, Краснодарский солеустойчивый, Ленинградская 14, Л-441. В полноценных расах дрожжей подъемная сила, т. е. длительность подъема теста до стандартной высоты (70 мм) в стандартной форме должна составлять до 45 мин, зимазная активность — до 50 мин, активность мальтазы — до 70 мин, сопротивление патока 100%, удельный темп роста — до 0,2 ч-1. Однако ни одна из используемых рас не сочетает в себе все необходимые функции, которые отвечали бы требованиям для пекарских дрожжей. Поэтому хлебопекарные заводы часто используют смеси разных дрожжевых рас. На некоторых растениях используется гибрид 1966 года (активность зимазная — 43 мин, активность мальтозная — 65 мин).
Чтобы увеличить ферментационную активность прессованных дрожжей, сокращая период адаптации дрожжевых клеток в тесте, их активация выполняется. Существует множество способов активировать дрожжи, основанные на улучшении состава питательной среды путем добавления, например, пивоварения ячменного солода, соевой муки, ферментных препаратов, минеральных солей. Ферментационные свойства и почкование дрожжей могут быть усилены аэрированием питательной среды, особенно если насыщение суспензии дрожжей кислородом осуществляется в магнитном поле. Эффективным является двухфазный метод активации сжатых дрожжей. В этом способе суспензию, содержащую воду и дрожжи в соотношении 1: 20, нагревают в течение 30 минут при 35 o C. Затем добавляют мучную суспензию, содержащую 10% муки, ферменты — амилоризин П10x (0,24 единицы OC / 100 г мука) и амилосубтилин Г10x (0,015 ед
Технология производства хлебопекарных дрожжей — реферат
СОДЕРЖАНИЕ1.
 ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВАДРОЖЖЕЙ
ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВАДРОЖЖЕЙ1.1Принципиальная схема производства
1.2Способы культивирования и показатели процесса
1.3 Основныерассчитываемые показатели
2. СЫРЬЕ ИВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ
2.1Основное сырье
2.2 Вспомогательныематериалы
3. ПРИГОТОВЛЕНИЕПИТАТЕЛЬНОЙ СРЕДЫ
3.1 Приготовлениераствора мелассы
3.2Технологические режимы переработки мелассы различного качества
4.ПОЛУЧЕНИЕ ДРОЖЖЕЙ ЧИСТОЙ И ЕСТЕСТВЕННО-ЧИСТОЙ КУЛЬТУРЫ
4.1 Схемаполучения маточных дрожжей по режиму ВНИИХПа
4.2 Выделениеи хранение маточных дрожжей
4.3 Показателикачества дрожжей ЧК и ЕЧК
5. ТЕХНОЛОГИЧЕСКИЕПРОЦЕССЫ И РЕЖИМЫ ВЫРАШИВАНИЯ ТОВАРНЫХ ДРОЖЖЕЙ
5.1Выращивание дрожжей в разбавленных средах
5.2 Процессдозревания дрожжей
5.3Выделение дрожжей
5.4Формовка, упаковка и транспортировка дрожжей
5.5Хранение дрожжей
5.6 Сушкадрожжей
1. ТЕХНОЛОГИЧЕСКАЯ СХЕМАПРОИЗВОДСТВА ДРОЖЖЕЙ
1.1 Принципиальная схема производства
Технологический процесс выращивания дрожжей складывается изотдельных основных этапов: приготовление питательной среды, выращиваниедрожжей, выделение, формовка и упаковка прессованных дрожжей, сушка и упаковкасушеной продукции.
Приготовление питательной среды.
Под питательной средой понимают растворы мелассы, а такжерастворы азот- и фосфорсодержащих солей. Густую мелассу из мелассохранилищ передаютв сборник 1, где хранится суточный запас ее. Из сборника 1 мелассу направляютна весы 2, откуда после взвешивания передают в сборник для разбавления мелассы 3,где ее разводят водой. Этот процесс называют разбавлением. Затем раствормелассы подают на кларификаторы 4, где происходит освобождение ее отмеханических примесей — этот процесс называют осветлением. Осветленную мелассунасосом перекачивают в приточные сборники для мелассы 7, откуда ее подают вдрожжерастильные аппараты.
Азот- и фосфорсодержащие соли растворяют отдельно вспециальных емкостях водой и используют для питания дрожжей в виде растворов,которые подают в дрожжерастильные аппараты из приточных сборников для солей 5,6. Для каждой соли используют отдельные резервуары как для растворения ее, таки для притока.
Выращивание дрожжей.
Этот этап является основным в производстве хлебопекарныхдрожжей. Выращиванием дрожжей называют процесс размножения клеток дрожжей,когда из небольшого количества засеваемых в питательную среду клетокпостепенно, путем ряда последовательных стадий получают большое количестводрожжей, используемых в ряде отраслей промышленности, и прежде всего вхлебопекарной.
Выращиванием дрожжей называют процесс размножения клеток дрожжей,когда из небольшого количества засеваемых в питательную среду клетокпостепенно, путем ряда последовательных стадий получают большое количестводрожжей, используемых в ряде отраслей промышленности, и прежде всего вхлебопекарной.
Процесс выращивания дрожжей складывается из двух этапов: полученияматочных итоварных дрожжей. Маточные дрожжи сначала получают в лабораториизавода, а затем в цехе чистых культур, для чего используют дрожжерастильныеаппараты 8 и 9. Прежде всего получают дрожжи чистой культуры (ЧК), а из них — дрожжиестественно-чистой культуры (ЕЧК). Чистой культурой называют дрожжи, выращенныеиз одной клетки, без примеси посторонних микроорганизмов. Первые стадииразмножения дрожжей ЧК проходят в лаборатории завода, затем в цехе чистыхкультур и, наконец, в производственном дрожжерастильном аппарате, предназначенномдля выведения чистой и естественно-чистой культуры. Естественно-чистойкультурой называют дрожжи, содержащие незначительное количество постороннихмикроорганизмов и используемые в качестве засевного материала для выращиваниятоварных дрожжей.
Товарные дрожжи на отечественных дрожжевых заводах получают вдве стадии: стадия Б —засевные дрожжи, которые выращивают в аппарате 10 истадия В — товарные дрожжи, которые выращивают в аппарате 11 с дозреванием ваппарате 12.
Выделение дрожжей.
Выросшие маточные и товарные дрожжи выделяют из культуральнойсреды (среды, в которой они размножались), промывают холодной водой и сгущаютдо концентрации 500—600 г/л на специальных машинах — сепараторах 13, 15. Дляпромывки дрожжей используют специальные бачки 14. Сгущенные дрожжи называютдрожжевым молоком. Их после сепарирования направляют в специальные сборникидрожжевого молока. Дрожжевое молоко маточных дрожжей помещают в сборники 23, атоварных дрожжей — в сборники 24. при сепарировании отделяется до 80% жидкости.
Окончательное отделение дрожжей от жидкости происходит наспециальных машинах, называемых вакуум-фильтрами или фильтр-прессами (16), вкоторые подают дрожжевое молоко из сборников. При этом дрожжи приобретаютплотную консистенцию и форму пластин или пластов различной толщины.
Формовка и упаковка дрожжей.
Пластины дрожжей от вакуум-фильтров или фильтр-прессовтранспортером подают в бункер 17 формовочно-упаковочного автомата 18, где ониформуются в бруски различной массы и упаковываются в специальную этикеточнуюбумагу.
Сушка и упаковка сушеной продукции.
На некоторых дрожжевых заводах прессованные дрожжи, минуяформовку, направляют в сушильные агрегаты (сушилки), где им придают формувермишели, измельчают и затем высушивают. Сушеные дрожжи имеют форму гранул.
Высушенные дрожжи упаковывают вручную в крафт-мешки сполиэтиленовым вкладышем, либо в ящики с подпергаментной бумагой илирасфасовывают на специальных машинах в герметичную упаковку – жестяные банки.
1.2 Способы культивирования и показатели процесса
При выращивании дрожжей применяют способы, различающиесярежимом подачи питательных веществ, воздуха и длительностью процесса. При этомразличают бесприточный, воздушно-приточный воздушно-проточный способы.
Бесприточный способ культивирования применяется при полученииматочных дрожжей. По этому способу все питательные вещества в воду подают сразупри загрузке аппарата. Воздух при этом либо не подают совсем, либо подаютпериодически, либо небольшое количество на протяжении всего периодакультивирования.
Воздушно-приточным называется способ, при котором дрожживыращивают с постоянной подачей воздуха и постепенным притоком питательнойсреды в дрожжерастильный аппарат. Такой режим называется периодическим. Егообычно используют пи получении последних стадий маточный дрожжей, а такжетоварных дрожжей.
Воздушно-проточным называется способ, при котором дрожживыращивают с постоянной подачей воздуха и одновременным притоком питательнойсреды в дрожжерастильный аппарат и оттоком культуральной среды с дрожжами вотборочный. При этом в течение 6-7 часов дрожжи накапливаются вдрожжерастильном аппарате – этот период называется накопительным. Через 6-7часов начинается отток среды с дрожжами из дрожжерастильного аппарата вотборочный аппарат – отточный период, или отборочный, который длится 20-30часов и более – удлиненный или непрерывный режим.
Накопительный период протекает в основном в дрожжерастильномаппарате, куда непрерывно подается питательная среда и воздух. При этомдрожжевые клетки так же, как и при периодическом способе, проходят лагфазу ифазу логарифмического роста, которая длится непрерывно. В первые часынаблюдается синхронное отпочковывание дочерних клеток с невысоким коэффициентомчасового прироста (1,08-1,10), затем прирост увеличивается и к 5-му и 6-му часукоэффициент часового прироста достигает величины прироста достигает величины1,20-1,25. в культуральной среде пи этом накапливается максимально возможноеколичество дрожжей, так называемая «рабочая биомасса», после чего начинаетсяпериод непрерывного размножения, или отборочный период.
В этот период в основном дрожжерастильном аппарате клеткинаходятся в стадии логарифмического роста и устанавливается постоянноесоотношение клеток по величине и ферментативной активности. Количество крупныхклеток составляет 20%, средних 55% и мелких не более 25-30%. Отборочный периодможет длиться бесконечно долго при соблюдении следующих условий:
— обеспечение дрожжевых клеток необходимыми питательными иростовыми веществами, а также кислородом в достаточном количестве;
— непрерывный вывод из дрожжерастильного аппарата продуктовобмена (метаболизма) клеток, тормозящих их рост и размножение;
— непрерывный отбор из основного дрожжерастильного аппаратаприрастающей биомассы.
Стационарная фаза развития дрожжей в непрерывном процессенаступает лишь в отборочном аппарате, куда питательные вещества не поступают иоткуда непрерывно отбирается прирастающая биомасса.
Таким образом, выращиваемые в основном аппарате дрожжихарактеризуются активностью ферментных систем, т.е. способностью к активномуросту и размножению с постоянной, установленной для данного аппарата иперерабатываемого сырья скоростью. От правильного ведения этого процесса вотборочном аппарате засвистит в основном качество дрожжей.
1.3 Основные рассчитываемые показатели
Выход дрожжей
Основным показателем эффективности материальных затрат идрожжевой промышленности является выход дрожжей. Под выходом дрожжей понимаютколичество дрожжей, отнесенное к переработанной мелассе и выраженное в процентах.Выход дрожжей В рассчитывают по формуле:
В=Д*100/М
где Д — количество полученных дрожжей, кг; М — количествоизрасходованной мелассы, кг.
Выход дрожжей на разных заводах различен и зависит отконструкции оборудования, технологической схемы, качества сырья и материалов,снабжения электроэнергией, водой, паром и т. д.
Расчет расхода мелассы на 1 т дрожжей
На дрожжевых заводах при расчете расхода мелассы с содержанием46% сахара за основу берут выход и выработку дрожжей, которые запланированывышестоящей организацией в зависимости от технического состояния предприятия иего мощности.
Расход мелассы М по заводу, а также по каждой стадиирассчитывают по формуле
М=Д*100/В
где Д — количество дрожжей, кг; В — выход дрожжей, %.
2. СЫРЬЕ И ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ
2.1 Основное сырье
Основным источником питательных веществ для дрожжей являетсясвекловичная меласса, представляющая собой густую сиропообразную жидкость.
Характеристика мелассы
В состав мелассы входят сахара (углеводы), несахара и вода.Основной частью углеводов мелассы является сахароза С12Н22О11,количество которой колеблется в пределах 40—50% в отдельных случаях 54-56%.Кроме сахарозы в мелассе содержится инвертный сахар и раффиноза. Инвертныйсахар (смесь глюкозы С6Н12О6 и фруктозы С6Н12О6) мелассы частично поступает изсвеклы, где он содержится в количестве 0,1-0,2%. Содержание инвертного сахаразначительно увеличивается в подгнившее и замороженной свекле. Значительна ячасть инвертного сахара образуется в результате гидролитического расщеплениясахара в процессе сахароварения.
Продукты инверсии – глюкоза и фруктоза – снижают содержаниесахарозы и ухудшают качество мелассы, так как в процессе сахароварения онипревращаются в кислоты и красящие вещества. Рафиноза находится в свекле в количестве0,01-0,03%. Она устойчива к высоким температурам и действию щелочей припроизводстве сахара, поэтому полностью переходит в мелассу и ее содержаниедостигает иногда 2%. Рафиноза С18Н32О16 представляет собой трисахарид,состоящий из галактозы, фруктозы и глюкозы.
В дрожжевом производстве содержание углеводов в мелассеучитывают по сумме сбраживаемых сахаров, которая представляет собой общееколичество сахарозы, инвертного сахара и 1/3 рафинозы.
Несахара мелассы состоят из органических и неорганических веществ.Неорганические вещества содержат углекислые, сернокислые, хлористые,азотнокислые и в малом количестве фосфорнокислые соли калия, натрия, кальция,магния, железа, аммония.
Общее количество неорганических веществ определяют по составузолы, которое колеблется в зависимости от почвенных и климатических условийвыращивания свеклы.
При выращивании хлебопекарных дрожжей большое значение длянакопления биомассы имеет не только абсолютное содержание золы, но исоотношение зольных веществ и сахаров. Так, в полноценной мелассе на каждые 100 г углеводов должно приходиться не менее 15 г золы, или 8—10% по отношению к мелассе.
В состав органических несахаров мелассы входят азотсодержащиеи безазотистые соединения. Азотсодержащие вещества состоят из продуктов распадабелков — аминокислот, амидов и аммонийного азота, усваиваемых дрожжами. Большаячасть азота является азотом бетаина, который дрожжами не усваивается.
Безазотистые вещества состоят из органических кислотщавелевой, янтарной, глутаровой и др.), летучих органических кислот (уксусной,муравьиной, масляной, пропионовой), а также из карамелей — продуктовконденсации углеводов, образовавшихся под воздействием высоких температур впроцессе получения сахара.
Вода в мелассе содержится в свободном и в связанном состояниив количестве около 20%. Кроме того, в мелассе имеются ростовые вещества — биотин, пантотеновая кислота, инозит, аневрин, рибофлавин, пиридоксин,никотиновая и фолиевая кислоты и микроэлементы: кобальт (Со), бор (В), железо(Ре), мед (Сu) марганец (Мn), молибден (Мо). цинк (Zn).
Большую роль в развитии дрожжей играет реакция (рН) мелассы иналичие в ней вредных примесей. Полноценной мелассой считается мелассанейтральная, слабощелочная (рН 7,1—8,5) и слабокислая (рН 6,3—6.9). Кислаямеласса (рН ниже 6,5) не пригодна для длительного хранения. Наличие большого количествакрасящих веществ в мелассе тормозит рост дрожжей и ухудшает их качество.
Содержание в мелассе таких вредных примесей, как сернистыйангидрид и летучие кислоты, в настоящее время не имеет столь большого значения,как раньше, поскольку за последние годы мелассы с повышенным содержаниесернистого ангидрида практически совсем не встречаются, а большая часть летучихкислот находится в мелассе в связанном состоянии в виде солей, значительноменее вредных для дрожжей.
Мелассу, поступающую на дрожжевые заводы, можно разделить, натри основные группы:
— меласса нормальная, соответствующая установленной норме;
— неполноценная меласса, содержащая недостаточное количествовеществ, необходимых для нормального роста дрожжей;
— дефектная меласса, содержания вредные примеси, тормозящиерост дрожжей (летучие кислоты, сернистый ангидрид, активные нитритообразующиебактерии), меласса с повышенной цветностью.
Нормальная меласса перерабатывается в дрожжевом производстве попринятым технологическим режимам без нормализации состава, т. е. в основном бездобавления активаторов роста и калийного питания.
Влияние состава мелассы на накопление биомассы и качестводрожжей
При выращивании дрожжей на мелассе важно знать количество вней азота, усваиваемого растущими клетками количество ростовых и зольныхвеществ.
Азотистые вещества. Меласса, содержащая недостаточноеколичество азотистых веществ, является неполноценным сырьем для производствадрожжей критерием оценки пригодности мелассы для производства являетсясодержание легкоусваиваемого азота аминокислот. В мелассе содержится 17аминокислот, при этом преобладают аспарагиновая и глютаминовая, ускоряющие ростдрожжей.
Ростовые вещества (биотин). Для нормального развития дрожжейобязательно требуется наличие в среде веществ, стимулирующих накопление биомассы(биотина, инозита и пантотеновой кислоты). Все эти ростовые вещества содержатсяв свекловичной мелассе в следующих количествах (мкг/кг): инозит 5 770 000—8 000000, пантотеновая кислота 50 000—110 000, биотин 40—140. При этом количествоинозита и пантотеновой кислоты обычно соответствует или несколько превышает токоличество, которое необходимо для быстрого накопления биомассы с высокимвыходом готовой продукции на единицу сырья. Содержание же биотина даже вмелассах.хорошего качества обычно не достигает требуемой нормы (200—250 мкг/кг). Поэтому при оценке пригодности свекловичной мелассы содержание биотина являетсяочень важным показателем.
Содержание биотина в мелассе, поступающей на дрожжевыезаводы, колеблется в широких пределах — от 40-140 мкг/кг и в среднем составляет83 мкг/кг, причем партии мелассы с более высоким содержанием биотина (115-140мкг/кг) встречаются редко. Таким образом, по содержанию биотина свекловичнаямеласса не удовлетворяет требованиям современного дрожжевого производства.
Дрожжи, выращенные на средах с недостатком биотина, обладаютслабой ферментной системой, и поэтому их рост замедляется. Дрожжи, богатыебиотином, подготовлены к быстрому размножению, так как биотин облегчаетусвоение ими неорганического азота из среды и этим содействует образованию белковыхвеществ в дрожжевой клетке. Такие дрожжи содержат готовые ферментные системы, активнойгруппой которых является биотин.
Зольные вещества (калий). Нормализация состава мелассы врезультате добавления различных источников биотина взывает значительноеускорение роста дрожжей. Однако при переработке некоторых партий мелассынаблюдается понижение стойкости готовой продукции, что происходит отнедостаточного содержания калия в мелассе. При этом питание нарушается — вдрожжевую клетку в процессе роста не поступают зольные элементы. А между тем всоставе золы дрожжевой клетки калия содержится 23—40%.
Калий может находиться в мелассе не только в свободном, но ив связанном состоянии, поэтому он не весь участвует в обменных реакциях привыращивании дрожжей.
Присутствие ионов калия в мелассной среде требуется дляпроявления активности многих ферментов, которые участвуют вокислительно-восстановительных реакциях и принимают активное участие в процессероста и размножения дрожжей.
Из практики работы дрожжевых заводов известно, что намелассах с низким содержанием калия рост и размножение дрожжевых клетокотклоняется от нормы: замедляются новообразования клеток, появляются дрожжевыеклетки с двумя-тремя почками. При этом понижается выработка дрожжей и вконечном итоге сокращается их выход.
2.2 Вспомогательные материалы
В культуральную среду для активного роста дрожжей необходимодобавлять азот, фосфор, калий, магний, ростовые вещества, а также питьевую водуи воздух.
Серная кислота h3SO4 применяется для подкрепления мелассного раствора приосветлении, для регулирования рН культуральной среды в процессе выращиваниядрожжей и для очистки от бактериальной инфекции засевных дрожжей. В дрожжевомпроизводстве применяют серную кислоту техническую контактную улучшенную (ГОСТ2184—67) и аккумуляторную (ГОСТ 667—73) с содержанием моногидрата 92,5—94,0%,мышьяка не более 0,0001%.
Пеногасители применяются для гашения пены, которая образуетсяв процессе выращивания дрожжей в дрожжерастильных аппаратах. В дрожжевомпроизводстве обычно для гашения пены применяют техническую олеиновую кислотумарок А и Б (ГОСТ 7580—55), которая содержит не менее 95% жирных кислот вбезводном продукте, не более 0,5% влаги и имеет температуру застывания не более10—16°С.
Дезинфицирующие вещества: хлорная известь, натр едкийтехнический, сода кальцинированная, формалин, молочная кислота, кислота борная,перекись водорода, фурацилин, сульфанол и т.д.
Борная кислота Н3ВО3 в виде бесцветных блестящих кристаллов или кристаллическогопорошка белого цвета, полностью растворимых в воде, содержит не менее99,0—99,8% борной кислоты (ГОСТ 9656—75). Применяется вместе с молочнойкислотой для обработки засевных дрожжей и для подавления микрофлоры мелассногораствора, так как смесь указанных кислот обладает большей антибактериальнойактивностью, чем при использовании каждой кислоты в отдельности.
Перекись водорода (водный раствор Н2О,) — бесцветнаяпрозрачная жидкость с содержанием 27,5—40% перекиси водорода (ГОСТ 177—71).Обладает антибактериальной активностью и применяется для подавления ростабактерий в засевных дрожжах.
Воздух. В дрожжевом производстве для аэрации бродящейжидкости используется большое количество воздуха, который может содержать значительноеколичество микроорганизмов (до нескольких тысяч в 1 м3). В связи с этим забор воздуха должен производиться выше конька крыши завода. Воздухнеобходимо очищать фильтрами иохлаждать. Недостаточная очистка воздуха, подаваемого на производство, можетявиться причиной увеличения численности бактерий в культуральной жидкости.
Воздух производственных помещений, обычно обсемененныйбактериями и дрожжевыми клетками, служит причиной попадания микроорганизмов впроизводственные среды и готовую продукцию.
3. ПРИГОТОВЛЕНИЕ ПИТАТЕЛЬНОЙ СРЕДЫ
3.1 Приготовление раствора мелассы
Процесс приготовления раствора мелассы состоит из разбавленияи осветления ее. Осветляют мелассу с целью удаления грубых взвешенных частиц,коллоидов, микроорганизмов и других примесей.
Существует несколько способов осветления мелассы в дрожжевомпроизводстве. Выбор того или иного способа обычно обусловлен устройствомподготовительного отделения.
Механический способ. В настоящее время на большинстведрожжевых заводов мелассуосветляют с помощью кларификаторов, где взвешенные частицы отделяются поддействием центробежной силы. Указанный способ осветления позволяет экономитьмелассу, вспомогательные материалы, пар, кроме того, сокращается время наосветление.
Перед пуском на кларификатор мелассу взвешивают и разбавляютводой до определенной концентрации (кратность разбавления 1—3), добавляютхлорную известь из расчета 2— 3 кг (при содержании 33% активного хлора) на 1 тее. После перемешивания раствора с хлорной известью дают получасовую «хлорнуювыдержку», затем добавляют серную кислоту до получения рН 4,5 — 5,0 инаправляют на кларификатор.
На некоторых предприятиях применяют стерилизацию мелассы. Приэтом ее разбавляют горячей водой температурой 80—90°С и направляют в стерилизатор.Стерилизацию проводят при температуре 105—125°С в течении 15 — 60 с, после раствормелассы охлаждают до 80-85°С и подают на кларификатор.
Отстойный кислотохолодный способ. Этот способ применяют надрожжевых производствах небольших мощностей (5-10 т/сут) и при отсутствиикларификаторов. В заторный чан набирают воду и мелассу (на 1 т мелассы около 0,75 м3воды). После размешивания в аппарат засыпают хлорную известь из расчета0,6-0,9кг активного хлора, затем размешивают еще 30 мин и оставляют затор всостоянии покоя в течение 30 мин. За это время микробы — вредители дрожжевогопроизводства — под действием хлора становятся неактивными и постепенно гибнут.
После выдержки включают мешалку, добавляют серную кислоту дополучения рН 5,0, размешивают 30 мин и добавляют воду до содержания сухихвеществ в мелассе 20-40% (в зависимости от принятой на заводе концентрации) идают затору отстояться в течение 10-12 часов (пока меласса не станетпорзрачной).
Дозировка раствора мелассы осуществляется по программе спомощью автоматических устройств или вручную.
При осветлении мелассы отстойным кислотохолодным способом потеримелассы составляют 1.8-1,4% от исходного объема.
Для снижения потерь мелассы при осветлении в дрожжевомпроизводстве в основном перешли с отстойного метода m механический (с помощью кларификаторов), что снижает потериее до 0,14%.
3.2 Технологические режимы переработки мелассы различногокачества
Современная технология производства дрожжей предъявляет ксоставу мелассы требования, обусловленные необходимостью повысить выход дрожжейв товарной стадии до 80—90°/о в расчете на сырье и максимально увеличитьвыработку дрожжей с каждой линии дрожжерастильных аппаратов.
Содержание сахаров в мелассах колеблется в широких пределах,однако при выборе схем переработки принимают во внимание мелассу, содержащую46% сахаров.
В мелассе с повышенным содержанием углеводов (более 50%) малонеобходимых для построения дрожжевых клеток несахаров: золы, азота и биотипа. Всвязи с этим значительно понижается отношение массы перечисленных веществ кмассе сахаров, и избыток сахара расходуется не на накопление биомассы, а сбраживаетсяс образованием спирта.
Нормализация состава неполноценной мелассы
При переработке меласс, содержащих недостаточное количествоазотистых, ростовых и зольных веществ, необходимо добавлять недостающиекомпоненты. Нормализация состава питательной среды приводит к стабилизациивыхода дрожжей, и к улучшению качества готовой продукции.
При выращивании дрожжей по периодическим схемам питательнуюсреду нормализуют путем добавления источников биотипа (кукурузного экстрактаили дестпобиотина), калийных и магниевых солей в начале процесса выращивания.Полноценный кукурузный экстракт подают из расчета 6%, а калийные соли израсчета 3,5% калия в мелассе, содержащей 46% сахара.
Нормализация питательной среды при выращивании дрожжей понепрерывной (например, суточной) схеме осуществляется следующим образом: кукурузныйэкстракт подают во время загрузки (складки) дрожжерастильного аппарата из расчета6%, а калийные соли 3,5% (К2О) к мелассе,расходуемой в накопительном периоде. Второй раз кукурузный экстракт и калийныесоли добавляют в начале периода оттока среды из расчета на мелассу, перерабатываемуюв течение 6 ч. В дальнейшем недостающие ингредиенты добавляют по истечении 6 чоттока среды из расчета на мелассу, перерабатываемую в течение следующих 6 ч.
4. ПОЛУЧЕНИЕ ДРОЖЖЕЙ ЧИСТОЙ И ЕСТЕСТВЕННО-ЧИСТОЙ КУЛЬТУРЫ
Производство дрожжей начинают с получения чистой культурыдрожжей. На большинстве отечественных предприятий чистую культуру дрожжей(маточные дрожжи) получают по режиму ВНИИХПа.
4.1 Схема получения маточных дрожжей по режиму ВНИИХПа
Питательные среды. Дрожжи чистой и естественно чистойкультуры должны обладать высокой энергией размножения, поэтому для ихвыращивания используют питательные среды, богатые органическим азотом,ростовыми и минеральными веществами и микроэлементами. К числу такихпитательных сред относится солодовое сусло, поэтому оно и является основойпитательной средой, используемой для размножения дрожжей в лабораторныхстадиях. В лаборатории завода дрожжи получают в четыре стадии.
В первых трех лабораторных стадиях дрожжи выращивают на витаминизированнойсреде, которую готовят следующим образом. К 2000 мл солодового сусла сконцентрацией 16— 18% СВ добавляют 450 мл томатного или морковного сока,50 гглюкозы, 50 г мальтозы и 50 мл автолизата дрожжей (2%). Общую концентрациюсреды доводят водой до I2-14%СВ, а рН до 4,8—5,0.
Вместо солодового сусла для приготовления питательной средыможно использовать солодовый экстракт. Томатный или морковный сок можнозаменить виноградным, однако при этом глюкозу не добавляют, так как в этом сокеона содержится в достаточномколичестве для размножения дрожжей.
Питательную среду разливают в стерильную посуду: в четырепробирки по 5 мл витаминизированного сусла, в четыре маленькие колбы — по 50мл, в четыре большие колбы—по 500 мл. Среду стерилизуют в автоклаве всоответствии с общими правилами микробиологической техники (0,05 МПа в течение30 мин). Среду, которая не содержит сахаров (например, дрожжевую воду),стерилизуют при давлении 0,1 МПа в течение 60 мин.
Простерилизованную среду проверяют на стерильность, для чегопомещают ее в термостат при температуре 30сС на 72 ч. Ее считаютстерильной и используют для получения ЧК в том случае, если она за это время непомутнеет. Стеклянную посуду и фильтры стерилизуют сухим паром в сушильномшкафу при 160 С в течение 60 мин.
В последней лабораторной стадии дрожжи выращивают на смешаннойсреде. Для ее приготовления берут 10 л солодового сусла или витаминизированнойсреды плотностью 12—14% СВ, добавляют 5 л раствора мелассы, содержащей 30—32 СВ, 25 г диаммонийфосфата и 5 л воды. Среду разливают по 7 л в две колбы. Карлсберга и стерилизуют в автоклаве при 0.05 МПа в течение 6.0 мин.
В цехе чистых культур и в производственной стадии дрожжи ЧК иЕЧК выращивают на растворе мелассы с добавлением азотного и фосфорного питания,ростовых веществ и. минеральных солей.
Выращивание дрожжей ЧК в лабораторных условиях. Размножениечистой культуры начинают из чистой культуры дрожжей, получаемой в пробирках изВНИПХПа, или из музейной культуры дрожжевого завода. Дрожжи ЧК можно такжеполучать из сушеных дрожжей, что в настоящее время имеет место на рядеотечественных заводов, выпускающих сушеные дрожжи.
Выращивание дрожжей в цехе ЧК. Осуществляют его в триследующие стадии — стадия малого инокулятора (МИН), стадия большого инокулятора(БИН), стадия ЧК-1. Объемы этих аппаратов от стадии к стадии увеличиваются,возрастает и количество дрожжевой массы.
Все стадии цеха ЧК являются бесприточными, т. е. все питательныевещества и воду подают в начале процесса выращивания (при загрузке).
Выращивание дрожжей ЧК в производстве (стадия ЧК-II). В отличие от предыдущих стадий впроизводстве дрожжи выращивают по воздушно-приточному способу. Основные питательныевещества (раствор мелассы, азот, фосфорсодержащие соли) и воду в аппарат подаютнепрерывно, а ростовые и минеральные вещества (хлористый калий, сернокислыймагний и др.) — во время загрузки аппарата. Эта стадия обычно проходит ваппарате общим объемом 30 или 50 м3. Активную кислотность (рН)регулируют при помощи раствора аммиака, подаваемого взамен сернокислого аммонияв равноценном по азоту количестве, поддерживая ее в пределах 4,5—5,0.
Получение дрожжей ЕЧК. Дрожжи чистой культуры служат засевнымматериалом для выращивания дрожжей естественно-чистой культуры.
Раньше дрожжи ЕЧК получали в три стадии, из которых двепервые вели по бесприточному режиму, а последнюю — по воздушно-приточному. Внастоящее время рекомендован более перспективный способ получения дрожжей ЕЧК вдве стадии. Этот способ имеет ряд преимуществ по сравнению с прежним. При этомспособе сокращается длительность цикла, снижается вероятность инфицированиякультуры, сокращается количество рабочих, высвобождаются емкости, улучшаетсякачество культуры (ее ферментативная и генеративная активность, а такжестойкость к хранению).
При современном двухстадийном получении дрожжей на первойстадии их выращивают в цехе ЧК по бесприточному режиму, на второй — в производственномотделении по воздушно-приточному способу.
Стадия ЕЧК-1. Известно, что выращивание дрожжей на инфицированнойкультуре понижает экономический эффект использования сырья и качество готовойпродукции. Для очистки засеваемых в дрожжерастильный аппарат дрожжей отбактериальной инфекции маточные дрожжи подвергают кислотной обработке сернойпли молочной кислотой. Кислотную •обработку производят в специальной емкости,снабженной мешалкой, куда помещают 100 л дрожжевого молока (50 кг дрожжей с 25% СВ) и при непрерывной работе мешалки добавляют либо 0,6—1,0 лпредварительно разведенной (1:4) концентрированной серной кислоты (плотность1,84). чтобы кислотная баня составляла 25—30%, либо 2.5 л 40%-ной молочной кислоты. Среду выдерживают в течение 40—60 мин при непрерывном перемешивании,после чего засевают в дрожжерастильный аппарат, который предварительно былзагружен питательной средой.
В аппарат вместимостью 7,5 м3 при загрузке набирают около 4 м3 воды и добавляют 600 кг стерильной мелассы в виде раствора плотностью 35—40% СВ; 8.3 кг сернокислого аммония; 4.3 кг диаммонийфосфата; 1,5 кг хлористого калия; 0,5 кг сернокислого магния и 0,12 г дестиобиотина. Содержимое аппарата хорошо перемешивают, добавляют воду с таким расчетом, чтобыпосле засева дрожжей начальная плотность культуральной среды составила 10% СВ,а объем 5,6 м3.
Процесс выращивания ведут при температуре 28—З0ºС, рН4,5—5,0 и постоянной аэрации (30 м3/ч на 1 м3 среды) до сбраживания культуральной среды до плотности 3,0—3,5% СВ. В результатеполучают 230 кг дрожжей, которые служат засевным материалом второй стадии.
Стадия ЕЧКII. Еепроводят в аппарате вместимостью 30 или 50 м3 при температуре 28—3ОºС; рН среды поддерживают на уровне 4,5 и регулируют при помощи растворааммиака, подаваемого вместо сернокислого аммония. В течение всего процессасреду аэрируют воздухом.
4.2 Выделение и хранение маточных дрожжей
Дрожжи ЧК по окончании дозревания направляют насепарирование. Выделение дрожжей проводят на отдельных сепараторах подвухступенчатой схеме. Отсепарированные на первом сепараторе дрожжи непрерывнобез задержки передают па второй сепаратор для сгущения. Холодную воду дляпромывания дрожжей подают в промежуточный сборник после первого сепарирования ина второй сепаратор. Промытые и пущенные до концентрации 400—600 г/л дрожжи,называемые; дрожжевым молоком, направляют в сборник, в котором они хранятся притемпературе не выше 6°С.
Дальнейшее сгущение дрожжевого молока производят нивакуум-фильтрах.
Дрожжи ЕЧК хранят обычно в прессованном виде либо в видедрожжевого молока (взвеси дрожжей в воде), а также в высушенном состоянии при оптимальнойтемпературе 2—4°С.
В последнее время метод хранения дрожжей Ч и ЕЧК в виде дрожжевогомолока нашел широкое признание в промышленности. Он является наиболееперспективным, так как позволяет сохранить ценные для маточных дрожжей свойства- генеративную активность и чистоту культуры.
Генеративная активность маточных дрожжей, сохраняемых в прессованномвиде, стабильна лишь в течение первых 10 сут, при дальнейшем хранении онаухудшается. Например, если величина генеративной активности в исходных маточныхдрожжах составляла 0.233, то через 10 сут хранения в прессованном виде онаувеличилась до 0,237, а через 20 сут понизилась до 0,230 и через 30 сут — до0,226. При хранении же дрожжей в виде дрожжевого молока генеративная активностьдрожжей в течение всего периода храпения улучшается и через 10 сутувеличивается до 0,238, через 20 сут—до 0,248 и через 30 сут — до 0,250.
При хранении маточных дрожжей в виде дрожжевого молокасохраняется лучше также ферментативная активность и чистота культуры, в товремя как при хранении дрожжей в прессованном виде наряду с понижениемгенеративной активности наблюдается и постепенное нарастание бактериальноймикрофлоры дрожжей, которая достигает иногда 50% (по соотношению колоний привысеве на чашки Петри). Посторонняя микрофлора в основном состоит измолочнокислых бактерий и плесневых грибов.
4.3 Показатели качества дрожжей ЧК и ЕЧК
Маточные дрожжи должны представлять собой чистую культурусахаромицетов без примеси посторонних дрожжевых грибов и бактерий, особенногнилостных.
При микрокопировании видны крупные округлые и овальные клеткиравномерной величины. При посеве их на жидкую среду, содержащую уксуснокислыйнатрий, через 5 сут не должна появляться пленка (признак наличия несахаромицетов),а на твердых средах — не должны появляться колонии дрожжеподобных грибов ибактерий.
Дрожжи ЧК должны содержать 1,3% фосфора и 2,5% азота, адрожжи ЕЧК — 1.0% фосфора и 2,0% азота и обладать высокой генеративнойактивностью. Скорость роста активных маточных дрожжей составляет 0,200—0,350.Генеративная активность дрожжей ЧК зависит от способа их культивирования.Дрожжи дыхательного типа (аэробные, полученные по воздушно-приточному способу)обладают более высокой способностью к размножению и росту по сравнению сдрожжами бродильного типа (анаэробными, полученными при небольшой аэрациисреды). При этом формируются клетки, содержащие различное количество биотина,метахроматина, РНК (рибонуклеиновой кислоты), ДНК (дезокенрибонуклеиновойкислоты), полифосфатов и различающиеся по составу. Активные маточные дрожжидолжны иметь следующие показатели:
— дрожжи ЧК — подъемная сила 35 — 40 мин, мальтазнаяактивность 70 — 90 мин, осмочувствительность не более 20 мин,
— дрожжи ЕЧК — подъемная сила 40—50 мин, мальтазнаяактивность 70 — 100 мин, осмочувствительность не более 10 мин.
Стойкость хороших маточных дрожжей обычно превышает 72 ч.
Кроме того, дрожжи чистой и естественно-чистой культурыдолжны содержать не менее 10% крупных клеток, не более 25% мелких клеток, неболее 10 % почкующихся клеток.
5. ТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ И РЕЖИМЫ ВЫРАШИВАНИЯ ТОВАРНЫХДРОЖЖЕЙ
5.1 Выращивание дрожжей в разбавленных средах
На отечественных заводах товарные хлебопекарные дрожживыращивают обычно по схеме ВНИИХПа в две стадии(засевная стадия Б и товарная В)при кратности разбавления сырья 17. При этом для заводов с отечественным оборудованиемприменяют несколько иной режим выращивания дрожжей, чем для заводов, гдеустановлено оборудование из Польской Народной Республики. Это связано ссепарированием засевных дрожжей стадии Б на этих заводах.
Выращивание дрожжей на заводах с отечественным оборудованием
Стадия Б. Засевные дрожжи получают в дрожжерастильныхаппаратах общим объемом 30 м3. Загрузку аппарата осуществляют вследующем порядке: в дрожжерастильный аппарат набирают воду, добавляют в видерастворов мелассу, сернокислый аммоний; затем подают 215 кг дрожжей ЕЧК в виде дрожжевого молока. По окончании засева подают ростовые вещества, хлористыйкалин и начинают подачу питательных.
В процессе выращивания дрожжей температуру поддерживают науровне 30ºС, количество воздуха — 80 м3/ч на 1 м3 среды в аппарате. В этой стадии за 11 ч накапливают 1100 кг дрожжей. Дозревание дрожжей в стадии Б не предусматривается.
Стадия В. Товарные дрожжи получают в дрожжерастильныхаппаратах вместимостью 100 м3. Засевным материалом служит всесодержимое аппарата Б.
Дрожжи получают по технологической схеме с 20 или 12-часовымпериодом размножения. В дрожжерастильном аппарате В в течение первых 7 ч повоздушно-приточному способу накапливают «рабочую» биомассу (накопительныйпериод). 3атем начинают непрерывный отток ее в отборочный аппарат (периодотборов), где дрожжи в условиях небольшой аэрации и без добавления питательныхвеществ дозревают в течение 1 ч, после чего поступают на сепараторы для выделения.
Одновременно с оттоком в дрожжерастильный аппарат попрограмме поступают питательные вещества (растворы мелассы, солей и вода). Внеобходимых случаях подают ростовые вещества, соли калия и магния. Количествосреды, отбираемой ежечасно, соответствует количеству жидкости, поступающей вдрожжерастильный аппарат, поэтому уровень среды в нем остается постоянным.Количество дрожжей в основном дрожжерастильном аппарате должно быть такжепостоянным (прирост дрожжей отбирают в отборочный аппарат).
В дрожжерастильный аппарат объемом 100 м3 набирают соду, осветленный раствор мелассы, раствор сернокислого аммония, послечего передают все содержимое аппарата Б; одновременно подают воздух. После этогов аппарат подают ростовые вещества и хлористый калий и начинают приток мелассыи солей. Расход воздуха в аппарате составляет 100 м3/ч на 1 м3 среды. В начале процесса рН среды устанавливают 4,5, в конце 5,5—5,8. К концу накопительногопериода накапливается 3400 кг дрожжей и заполняется весь полезный объемаппарата стадии В.
С 8-го часа начинают постепенный отбор культуральной среды вотборочный аппарат по 11 м3/ч где аэрация среды понижена (расходвоздуха составляет 40—50 м3/ч на 1 м3 среды). В период отбора в основной дрожжерастильный аппарат ежечасно подают в виде растворовмелассу, сернокислый аммоний, диаммонийфосфат. Период отборов длится 12 при20-ти часовом периоде размножения дрожжей и 4 часа – при 12-ти часовом периоде.
При работе завода по режиму с 20-ти часовым периодомразмножения с одного аппарата получают 9300 кг дрожжей.
Выращивание дрожжей на заводах с оборудованием производстваПНР.
На заводах установлены дрожжерастильные вместимостью 100 м3. Дрожжи выращивают по 12-часовой схеме с четырьмя отборами.
Товарные дрожжи выращивают также в две стадии.
Стадия Б. Дрожжи выращивают в аппарате общим объемом 100 м3. Аппарат загружают в следующем порядке: в дрожжерастильный аппарат набирают воду,добавляют в виде растворов мелассу, сернокислый аммоний. Затем подают 620 кг дрожжей ЕЧК в виде дрожжевого молока. Затем добавляют ростовые вещества, хлористый калий иначинают приток питательных растворов. Хлористый калий и сернокислый магнийрасходуют в зависимости от содержания этих веществ в мелассе и воде и добавляютв начале процесса выращивания дрожжей.
Дрожжи стадии Б сепарируют на отдельных сепараторах и хранятв сборниках дрожжевого молока.
Стадия В.накопительный период товарной стадии длится 7 часов.За это время накапливают 4000 кг дрожжей как при работе завода по 12-, так и20-ти часовой схеме.
В дрожжерастильный аппарат объемом 100 м3набираютводу и подают в виде растворов мелассу, сернокислый аммоний и 1200 кг дрожжей стадии Б в виде дрожжевого молока.
С 7-го часа начинают период отбора среды, который продолжается4 ч при работе по схеме с 12-часовым периодом размножения и 12 ч — с 20-часовымпериодом. Ежечасно в отборочный аппарат отбирают 11 м3 среды. В дрожжерастильный аппарат подают и виде растворов мелассу, сернокислыйаммоний и воду. Ростовые вещества и КС1 подают на 6-ом и 12-ом часу брожения(20-часовой период). Всего получают 6000 кг товарных дрожжей при работе по схеме с 12-часовым периодом размножения и 10 000 кг дрожжей по схеме с 20-часовым периодом.
5.2 Процесс дозревания дрожжей
Процесс выращивания дрожжей заканчивается их дозреванием. Отстадии дозревания в большой степени зависит качество хлебопекарных дрожжей. Вовремя этого процесса происходит перестройка ферментных систем с активногосинтеза биомассы на обменные процессы, поддерживающие лишь нормальные функцииклетки.
К концу процесса выращивания дрожжей, когда подачапитательных веществ прекращена, в дрожжерастильном аппарате находятся дрожжевыеклетки, разные по возрасту, с различной биологической активностью (старые, ужедавшие несколько поколений дочерних клеток, и молодые, только чтоотпочковавшиеся, а также зрелые клетки). Соотношение их может быть различным, иэто в большой степени от режима ведения технологического процесса и активностиисходной культуры. Дочерние клетки находятся в стадии формирования ферментныхсистем. Молодые клетки обладают активной ферментной системой, направленной насинтез белка. В период почкования они отличаются пониженной стойкостью. Для синтезаони используют питательные вещества, содержащиеся в бражке. В созревших клеткахферментные системы уравновешены. Такие клетки при определенных условиях могутдолго сохранять присущие им свойства, поэтому процесс дозревания долженобеспечить максимальное число зрелых клеток (почкование должно завершиться).
Особенно большое значение режим дозревания дрожжейприобретает при работе по воздушно-проточному способу, так как в отборочныйаппарат все время поступают клетки с активной ферментной системой, направленнойна синтез биомассы.
В процессе дозревания клетки потребляют остаточныепитательные вещества. Завершается процесс почкования. Отпочковавшиеся клеткивырастают, и биомасса увеличивается в основном за счет роста клеток.
5.3 Выделение дрожжей
По окончании процесса выращивания и дозревания дрожживыделяют из культуральной среды сначала на сепараторах, затем несколько разпромывают холодной водой, сгущают и получают дрожжевое молоко с концентрациейдрожжей 300-700 г/л. Далее его направляют на вакуум-фильтры для окончательноговыделения дрожжей.
Сепарирование. Известно несколько способов выделения ипромывания дрожжей.
— промывание дрожжей в одном промывном аппарате с непрерывнойподачей воды и непрерывным отделением промывной воды на сепараторах ведут до пор,пока дрожжи не будут отмыты от бражки. Затем подача воды в промывной аппаратпрекращают, отмытое дрожжевое молоко сгущают и подают сначала в сборники молока,а затем на окончательное выделение.
— промывание в двух промывных аппаратах. Дрожжевое молоко,полученное после отделения бражки от дрожжей, промывают сначала в одном, потомв другом промывном аппарате, после чего сгущают на тех же сепараторах инаправляют в сборники дрожжевого молока, а оттуда уже на фильтр-прессы дляокончательного отделения дрожжей от промывной воды.
— двухступенчатое сепарирование. Дрожжи сепарируют и сгущаютна разных сепараторах. Культуральную среду дрожжей дрожжерастильного аппаратаподают на первую ступень сепараторов. Отсепарированные дрожжи черезпромежуточную емкость, в которую подают холодную воду для промывания,перекачивают на вторую ступень, где происходит дополнительная промывка исгущение дрожжей. Промытые и сгущенные дрожжи направляют в сборники дрожжевогомолока, в которых его хранят при температуре, не превышающей 6ºС (оптимальнаятемпература составляет 2 — 4 С).
— трехступенчатое сепарирование. Отделение дрожжей от среды,промывание и сгущение дрожжевого молока происходят на разных сепараторах. Напервой ступени происходит отделение дрожжей от бражки. Непромытые дрожжи черезпромежуточную емкость, в которую одновременно поступает холодная вода дляпромывки, подают на вторую ступень сепараторов, где дрожжи отделяют отпромывной воды. Затем они поступают во вторую промежуточную емкость, в которуютакже подают холодную воду. Здесь происходит повторная промывка дрожжей, послечего вместе с промывной водой они насосом подаются на третью ступеньсепараторов, где происходит сгущение дрожжей до концентрации 450-700 г/л.
Наиболее эффективными по сравнению с первыми двумя являютсяступенчатые схемы сепарирования, при которых обеспечивается лучшее промывание,сгущение и высокое качество готовых дрожжей.
5.4 Формовка, упаковка и транспортировка дрожжей
Отпрессованные на вакуум-фильтре или фильтр-прессе дрожжипоступают в формовочную машину, где их при необходимости увлажняют для приданиятребуемой консистенции дрожжевой массы.
Дрожжи направляют в упаковочно-расфасовочные автоматы,формующие дрожжевую массу в виде прямоугольных брусков 1000. 500. 100 и 50 г.
5.5 Хранение дрожжей
На отечественных дрожжевых заводах хлебопекарные дрожжи восновном хранят в холодильных камерах, завернутые в специальную бумагу, притемпературе 1—4ºС и относительной влажности воздуха 82—96%.
5.6 Сушка дрожжей
Сушеные хлебопекарные дрожжи получают из прессованныхдрожжей. Высушивание дрожжей является одним из эффективных способов сохраненияих ферментных систем, поскольку они не могут сохраняться длительное время впрессованных дрожжах.
Сущность процесса сушки дрожжей заключается и удалении водыиз прессованных дрожжей. При этом влажность их снижается с 72 до 8—10%.
Основной задачей процесса сушки является удаление толькосвободной влаги. Если удалить из клетки химически связанную влагу, то нарушитсяструктура протоплазмы и клетка погибнет.
Химически связанная влага п является той остаточной влагойсушеных дрожжей (7—8%), которая не удаляется при сушке.
Известен ряд способов сушки дрожжей: в малоподвижном слое, вовзвешенном состоянии, распылением, сублимацией, в условиях остаточногодавления.
Во всех сушильных устройствах сушка дрожжей происходитнагретым воздухом. Однако температура воздуха различна, что обусловливаетсяконструкцией сушилок. Например, в вакуум-сушилке температура дрожжей ЗО°С впервом периоде сушки сохраняется при нагреве сушильного воздуха до 60°С за счетсильного испарения влаги. В камерной и ленточной сушилках испарение происходитмедленнее, чем в вакуумной, поэтому поддерживать в дрожжах температуру 30°Сможно при нагреве поступающего в сушилку воздуха только до температуры 45—48С.В распылительной сушилке вследствие очень быстрой сушки дрожжей перегрева ид ненаблюдается даже при температуре входящего воздуха 140°С.
Процесс сушки дрожжей состоит из следующих операции подачипрессованных дрожжей в формовочную машину, формовки их в виде гранул, подачигранул дрожжей в сушилку, процесса высушивания, подачи сушеных дрожжей в «бункер для остывания, упаковки готовой продукции
6. ПРИЛОЖЕНИЕ
/>
Технологическая схема дрожжевого производства с использованиембражки: 1 — сборники для мелассы: 2 — весы; 3 — сборник для разбавлениямелассы;4 — кларификатор: 5 — сборник для раствора диаммонийфосфата; 6 — сборникдля раствора сернокислого аммония; 7 — приточные сборники для осветленноймелассы; 8 — отделение чистой культуры дрожжей; 9 — дрожжерастильный аппаратдрожжей ЧК и ЕЧК; 10 — дрожжерастильный аппарат I стадии товарных дрожжей: 11 — дрожжерастильный аппарат II стадии товарных дрожжей; 12 — отборочный аппарат; 13, 15 — дрожжевой сепаратор; 14 — промывные бачки: 16 — фильтр-пресс или вакуум-фильтр: 17 — бункер: 18 — формовочно-упаковочныйавтомат: 19 — песчаный фильтр; 20 — сборник для бражки, направляемой в оборот; 21- аппарат СВЧ для стерилизации бражки, направляемой в оборот; 22 — мерник длябражки; 23 — сборник дрожжевого молока маточных дрожжей; 24 — сборникдрожжевого молока товарных дрожжей.
2. ДРОЖЖИ ИСПОЛЬЗУЕМЫХ ДЛЯ ПРОИЗВОДСТВА ХЛЕБОПЕКАРНЫХ ДРОЖЖЕЙ. Микробиология дрожжевого производства
Похожие главы из других работ:
Активация дрожжей
1.2 Общая характеристика дрожжей
Дрожжи — одноклеточные, немицелиальные грибы, относящиеся к классу аскомицетов — Ascomycetes (сумчатые грибы). Форма клеток дрожжей разнообразна: шаровидная, полушаровидная, овальная, удлиненно-овальная, цилиндрическая, лимоновидная (апикулярная)…
Активация дрожжей
1.5 Методы активация прессованных дрожжей
Для повышения бродильной активности прессованных дрожжей, периода сокращения адаптации дрожжевых клеток в тесте желательно проводить их активацию. В настоящее время известно ряд способов активации дрожжей…
Использование процесса отстаивания при производстве столовых вин
1.6 Снятие с дрожжей
Переливание производят сифоном (резиновой трубкой) или декантацией (переливая через край), при этом стараются не задеть осадка. Трубку опускают, не доходя 3 см до дрожжевого осадка, а сливают только прозрачное вино…
Особенности технологии приготовления хлеба
1.4 Дрожжи
Для производства хлебобулочных изделий на хлебопекарных предприятиях применяют дрожжи прессованные (ГОСТ 171), вырабатываемые специализированными и спиртовыми заводами, сушеные (ГОСТ 28483 и ТУ 10-0334585-90), дрожжевое молоко (ОСТ 18-369-81) [14,19]…
Особенности хлебопекарного производства
4. Классификация оборудования хлебопекарных предприятий
Всё оборудование х/п предприятий делиться на 4 группы: I Технологическое II Энергетическое III Санитарно-техническое IV Вспомогательное Технологическое оборудование — это машины и аппараты…
Пицца. Расчет ценности и химический состав
2.2 Дрожжи
Хлебопекарные дрожжи — вид биологического разрыхлителя теста. Тесто с таким разрыхлителем называется дрожжевым тестом. Используются в основном в хлебопечении для теста из пшеничной муки и теста из смеси пшеничной и ржаной муки, а также…
Пищевые добавки, используемые в хлебопечение
1. Классификация пищевых добавок и хлебопекарных улучшителей.
В зависимости от функционального назначения и технологических свойств применяемые пищевые добавки и хлебопекарные улучшители классифицируют по следующим группам. Пищевые добавки для производства мучных изделий: 1…
Приготовление мучных кондитерских изделий
1. ДРОЖЖЕВОЕ ТЕСТО И ИЗДЕЛИЯ ИЗ НЕГО. СПОСОБЫ ЗАМЕСА ТЕСТА: ОПАРНЫЙ, БЕЗОПАРНЫЙ. ИХ ХАРАКТИЕРИСТИКА. РОЛЬ ДРОЖЖЕЙ В ОПАРЕ. ОПРЕДЕЛНИЕ ГОТОВНОСТИ. ОБМИНКА, ЕЕ НАЗНАЧЕНИЕ
В кондитерских цехах предприятий общественного питания применяют опарный и безопарный способы приготовления теста. Способ приготовления выбирается в зависимости от количества, добавляемой сдобы…
Технология производства пива
4.2 Дрожжи пивные
Пивные дрожжи из аппарата чистых культур или из последней бутылки перед передачей в цех (при ручном разведении) анализируют методом микроскопирования в капле метиленовой сини с добавлением 10% раствора NaOH или KOH…
Технология производства хлеба «Деревенский» и слойки «Презент»
2.1.2 Дрожжи
Для производства хлебобулочных изделий применяют в качестве разрыхлителя: дрожжи хлебопекарные прессованные по ГОСТ 171. Прессованные дрожжи хранят при температуре от 0 до +4° C в холодильном шкафу марки «Ариада» КХ-4.6…
Хлебопекарные дрожжи: их признаки, свойства, применение
1. Общая характеристика дрожжей
Термином «дрожжи» обозначают одноклеточные эукариотические микроорганизмы. В группу дрожжей объединяются грибы, которые существуют преимущественно в виде отдельных клеток…
Хлебопекарные дрожжи: их признаки, свойства, применение
3. Характеристика прессованных дрожжей
Хлебопекамрные дромжжи — вид биологического разрыхлителя теста. Тесто с таким разрыхлителем называется дрожжевым тестом. Используются в основном в хлебопечении для теста из пшеничной муки и теста из смеси пшеничной и ржаной муки, а также…
Хлебопекарные дрожжи: их признаки, свойства, применение
4. Характеристика сухих активных дрожжей (сушеные дрожжи)
Для производства сухих активных дрожжей используются специальные расы прессованных дрожжей. Дрожжи, предназначенные для высушивания, выращивают при особых условиях, а перед высушиванием обрабатывают пластификаторами…
Хлебопекарные дрожжи: их признаки, свойства, применение
5. Характеристика быстродействующих сухие (инстантных) дрожжей
Термин «инстантные» произошел от английского слова instant, что означает немедленный. Инстантные дрожжи являются относительно новым продуктом (начало промышленного производства 1972 г)…
Хлебопекарные дрожжи: их признаки, свойства, применение
6. Характеристика жидких дрожжей (дрожжевое молоко)
Дрожжевое молоко представляет собой водную суспензию клеток сахаромицетов. Качество дрожжевого молока должно удовлетворять требованиям ТУ 10-033-4585-3 «Молоко дрожжевое. Технические условия» указанным в таблице 9 [6]…
|
№ |
Наименование разделов УД, ПМ |
Вид задания |
Наименование темы |
Форма контроля |
Источник |
|
Раздел 1.Физиология и метаболизм дрожжей. | |||||
|
|
Тема 1.1 Общая характеристика хлебопекарных дрожжей |
Подготовка сообщений по темам: |
Ученые микробиологи |
Сообщение, реферат, бюллетень, презентация
|
Интернет сайт http://freepapers.ru |
|
|
Характеристика дрожжевой клетки. |
И. П. Бабьева, И.Ю.Чернов «Биология дрожжей», учебное пособие; Е.А. Скиба «Технология производства дрожжей», учебное пособие; Белов Н.И., Славская И.Л., Макаров С.Ю. «Технология спирта и хлебопекарных дрожжей», учебно-практическое пособие. Интернет энциклопедия «Википедия» | |||
|
|
Факторы среды, влияющие на дрожжевую клетку. | ||||
|
|
Морфология дрожжей. | ||||
|
|
Физиология дрожжевой клетки. | ||||
|
|
Работа с литературными источниками и Интернетом |
Опрос, тест | |||
|
|
Работа с конспектом |
Проверка тетрадей |
Лекции | ||
|
Раздел 2. Технология производства хлебопекарных дрожжей. | |||||
|
|
Тема 2.1. Производство хлебопекарных дрожжей. |
Подготовка сообщений по темам: |
Схема производства хлебопекарных дрожжей. |
Сообщение, реферат, бюллетень, презентация
|
Е.А. Скиба «Технология производства дрожжей», учебное пособие; учебное пособие; Белов Н.И., Славская И.Л., Макаров С.Ю. «Технология спирта и хлебопекарных дрожжей», учебно-практическое пособие. Интернет энциклопедия «Википедия» |
|
|
Выращивание дрожжей на производстве. | ||||
|
|
Требования к качеству дрожжей. | ||||
|
|
.Свойства дрожжевого теста. | ||||
|
|
Питание дрожжей. | ||||
|
|
Работа с литературными источниками и Интернетом. |
Опрос, тест | |||
|
Работа с конспектом. |
Проверка тетрадей |
Лекции | |||
|
|
Тема 2.2. Оборудование дрожжевого производства |
Подготовка сообщений по темам |
Оборудование дрожжевого производства. |
Сообщение, реферат, бюллетень, презентация
|
Е.А. Скиба «Технология производства дрожжей», учебное пособие; учебное пособие; Белов Н.И., Славская И.Л., Макаров С.Ю. «Технология спирта и хлебопекарных дрожжей», учебно-практическое пособие. Интернет энциклопедия «Википедия» |
|
|
Средства механизации в дрожжевом производстве. | ||||
|
|
Дрожжевые сепараторы. Сушилки. | ||||
|
|
Автоматизация технологических процессов в дрожжевом производстве. | ||||
|
|
Работа с литературными источниками и Интернетом. |
Опрос, тест | |||
|
Работа с конспектом. |
Проверка тетрадей |
Лекции | |||
|
Раздел 3. Микробиология хлебобулочных и мучных кондитерских изделий. | |||||
|
|
Тема 3.1. Микробиология хлебобулочных и мучных кондитерских изделий
|
Подготовка сообщений по темам |
Факторы, влияющие на жизнедеятельность микрофлоры теста. |
Сообщение, реферат, бюллетень, презентация
|
Е.А. Скиба «Технология производства дрожжей», учебное пособие; учебное пособие; Белов Н.И., Славская И.Л., Макаров С.Ю. «Технология спирта и хлебопекарных дрожжей», учебно-практическое пособие. Интернет энциклопедия «Википедия», интернет источники. |
|
|
Особенности технологии хлебобулочных изделий. | ||||
|
|
Особенности технологии мучных кондитерских изделий. | ||||
|
|
Микроорганизмы, сохраняющиеся в изделиях во время выпечки. | ||||
|
|
Микрофлора теста. | ||||
|
|
Работа с литературными источниками и Интернетом. |
Опрос, тест | |||
|
|
Работа с конспектом. |
Проверка тетрадей |
Лекции | ||
|
Тема 4. Санитарный режим и техника безопасности в дрожжевом производстве | |||||
|
|
Тема 4.1. Санитарный режим и техника безопасности в дрожжевом производстве |
Подготовка сообщений по темам |
Санитарный режим. |
Сообщение, реферат, бюллетень, презентация
|
Е.А. Скиба «Технология производства дрожжей», учебное пособие; учебное пособие; Белов Н.И., Славская И.Л., Макаров С.Ю. «Технология спирта и хлебопекарных дрожжей», учебно-практическое пособие. Интернет источники. |
|
|
|
2. Санитарные правила в дрожжевом производстве. | |||
|
|
|
3. Борьба с коррозией в дрожжевом производстве. Агрессивные среды. | |||
|
|
|
5.Техника безопасности при работе с кислотами и щелочами. | |||
|
|
6.Работа с литературными источниками и Интернетом. |
Опрос, тест, участие в декадах, конкурсах, олимпиадах по предмету | |||
|
7.Работа с конспектом. |
Проверка тетрадей |
Лекции | |||
Реферат: Биология дрожжей
Министерство науки и образования РФМуниципальное общеобразовательное учреждение«Средняя общеобразовательная школа №1» РефератВыполнила:Дмитриева Екатерина,ученица 11а классаРуководитель:Мелехина Елена Борисовна,учитель биологии
Узловая, 2007
Содержание
Введение
1. История дрожжей
2. Распространение дрожжевых грибов в природе
3. Жизненные формы дрожжей
4. Дрожжевая клетка. Цитология
5. Морфология дрожжей
6. Половое размножение и жизненные циклы дрожжей
7. Особенности метаболизма
8. Дрожжи – возбудители заболеваний человека
9. Промышленное использование дрожжей
Заключение
Список используемой литературы
Введение
Еще с древнейших времен человек научился использовать дрожжи в своих целях: печь хлеб, изготовлять вино и пиво. Люди «общались» с ними, не зная их природы и происхождения. Много веков человек использовал эти организмы в своих целях, даже не зная, что это — живые существа. И лишь несколько веков назад великий ученый Левенгук с помощью микроскопа увидел их. Началось изучение дрожжей, постоянно сообщалось о новых открытиях и исследованиях, которые продолжаются и по сей день.
Начиная писать этот реферат, я задала себе такой вопрос: «Что мне известно о дрожжах?» И, подумав, поняла, что практически ничего. В природе нашей планеты много загадок, и, конечно, жизнь на Земле сложна и разнообразна. И мне стало интересно, почему дрожжи, так часто встречающиеся в хозяйстве, заслужили внимание многих ученых. Что особенного в этих организмах?
Благодаря этому реферату я хочу подробно изучить дрожжи, рассмотреть их жизненные циклы, узнать, как их используют люди, познакомиться с историей развития знаний о этих организмах. Я считаю, что любое живое существо в этом мире по-своему интересно и каким-либо образом отличается от других организмов. Изучение биологии дрожжей поможет мне расширить свой кругозор, узнать что-то новое.
1. История дрожжей
Всю историю тесного общения человека со своими постоянными одноклеточными микроскопическими спутниками — дрожжами можно условно разделить на отдельные периоды.
Уже в ХХ веке до нашей эры человек сумел «приручить» дрожжи, даже не зная об их существовании. Дрожжи работали на человека, производя различные бодрящие напитки, содержащие этиловый спирт. Напиток, напоминающий современное пиво («буза»), был известен уже в Древнем Египте. Там же возник способ приготовления хлеба из кислого дрожжевого теста. Это стало ясно после того, как в раскопках храма и гробниц фараона Эхнатона и его супруги – легендарной Нефертити, живших во второй половине XIV века до нашей эры, археологи натолкнулись на скопление форм для выпечки хлеба и кувшинов для пивоварения. В Китае уже в Х веке до нашей эры умели отгонять спирт из дрожжевой бражки для получения крепких спиртных напитков. Европейцы пристрастились к спиртному несколько позже: производство виски началось в Ирландии в ХI веке, а в ХIII веке в Европе широко распространилось пивоварение. Венцом этого периода можно считать первое описание дрожжей, которые в 1680 г. увидел в капле бродящего пива под микроскопом голландец Антонии Ван Левенгук (см. приложение №1). Хотя он и не связал процесс образования пива с жизнью этих мельчайших «анималькулей», но его рисунки до сих пор поражают точностью изображения дрожжевой клетки(см. приложение №2). После этого ничего нового о дрожжах не появлялось целых 150 лет.
Второй период занимает весь ХIХ век, начиная с 30-х годов. Это период зарождения научных знаний о дрожжах, когда были сделаны первые научные описания дрожжей (Каньяр де Латур во Франции, Теодор Шванн и Фридрих Кютцинг в Германии), способов их размножения, спорообразования, жизненных циклов. Именно в этот период дрожжи были названы сахарными грибами — Saccharomyces. Важнейшим событием этого периода было исследование Луи Пастером в 1860-1876 гг. спиртового брожения и доказательство его биохимической природы. В 1881 г. Эмилем Хансеном в Дании были впервые получены чистые культуры дрожжей. Использование чистых культур преобразило виноделие и пивоварение, превратив их из вида искусства в крупную отрасль промышленности. Исследования братьев Бюхнер в Германии (1890-е гг.) по сбраживанию сахара бесклеточными экстрактами дрожжей положили начало развитию энзимологии и биохимии. В самом конце ХIХ в. Хансеном и Клекером в Дании была создана первая классификация дрожжей.
Третий период охватывает XX век. Он характеризуется дифференциацией научных направлений в области изучения дрожжей. В первой четверти прошлого века создается эволюционно-филогенетическое направление в систематике дрожжей (А. Гийермон во Франции, 1909-28 гг.), организуется первая коллекция дрожжевых культур. С 1931 г. началось издание серии определителей дрожжей в Дельфте (Голландия). В 1954 г. вышел первый отечественный определитель дрожжей В.И. Кудрявцева.
Открытие радиационного мутагенеза Г.А. Надсоном и С.Г. Филипповым в 1925 г. заложило основы радиобиологии и стимулировало исследования по генетике дрожжей. Они касались доказательств существования чередования поколений в жизненном цикле дрожжей с изменением плоидности. Было показано, что аскоспоры Saccharomyces cerevisiae гаплоидны, и конъюгация спор или их потомков приводит к восстановлению диплоидного состояния, характерного для вегетативной стадии сахаромицетов. О. Винге разработал метод тетрадного анализа с изоляцией 4 спор аска с помощью микроманипулятора. Впоследствии дрожжи Saccharomyces cerevisiae оказались прекрасным модельным объектом для генетических исследований, и со времени этих работ генетика дрожжей развивалась очень бурно. Были выполнены тысячи работ как теоретического, так и прикладного характера, касающиеся конструирования генетически измененных штаммов дрожжей для биотехнологической промышленности.
Вторая половина XX в. отличается еще большей дифференциацией разделов зимологии, выделением новых направлений. Возникают функциональная морфология и цитология дрожжей (В.И. Бирюзова в СССР, Матиль в Швейцарии, Е. Штрейблова в Чехословакии), молекулярная генетика и генетическая систематика (работы японских, американских, канадских ученых, в СССР – исследования Г. И. Наумова), морская зимология (А.Е. Крисс, М.И. Новожилова в СССР), экология и закономерности распределения дрожжей Появляются новые отрасли на стыке разных направлений, растут запросы и потребности биотехнологии, широко использующей дрожжевые организмы в самых разных производствах. Дрожжи все больше вовлекаются в работы по созданию векторных систем для получения ценных продуктов биологического синтеза.
Существенно изменились представления о разнообразии дрожжей и подходы к их классификации. Неуклонно растет число известных видов дрожжевых грибов, периодически издаются определители, среди которых мировую известность получила серия определителей голландской школы — крупных сводок с описанием всех известных видов дрожжей. Редакторами выходящих с интервалом10-15 лет изданий этого определителя были крупнейшие зимологи Дж. Лоддер, Н. Крегер Ван Рий, Дж. Фелл, Х. П. Куртцман. Начиная с 80-х гг. периодически переиздается еще один определитель, под редакцией Дж. Барнетта, составленный на более формальзованной основе, основанный на использовании компьютерных технологий идентификации. В нашей стране исследования в области систематики дрожжей связаны в основном с именами И.П. Бабьевой, В.И. Голубева, Г.И. Наумова.
Особенно сильное влияние на изучение дрожжей, также как и большинства других групп микроорганизмов, оказало бурное развитие в конце XX в. молекулярной биологии. В современной систематике дрожжей широко используются методы геносистематики, основанные на непосредственном сравнении геномов и секвенировании нуклеотидных последовательностей. Применение единых молекулярно-биологических методов позволило еще больше сблизить подходы к таксономии дрожжевых и мицелиальных грибов, установить связи между дрожжевыми анаморфами и мицелиальными телеоморфами, разработать новые критерии для создания единой филогенетической системы всего царства Mycota. В то же время, новые знания породили и новые научные проблемы, в частности, проблему соотношения новейших молекулярных методов с традиционными, основанными на морфологических и физиологических подходах к изучению дрожжей. Практически полностью расшифрован геном Saccharomyces cerevisiae, что открывает огромные перспективы геномики дрожжей, новые горизонты их биотехнологического использования. Таким образом, наука о дрожжах, проделав более чем полуторавековой путь, продолжает интенсивно развиваться и в XXI веке.
2. Распространение дрожжевых грибов в природе
Особенности распространения дрожжей в природе стали интересовать микробиологов начиная с самых первых исследований процессов традиционного виноделия. Первоначально изучение дрожжей ограничивалось теми видами и штаммами, которые вызывали брожение при приготовлении пива и вина. Однако уже в конце XIX в. М. Бейеринк высказывал мысль о том, что эти культурные виды представляют собой селекционированные формы «диких» дрожжей, широко распространенных в природе. Естественно, возник вопрос об источниках их попадания в бродящие субстраты. Первые исследования, выполненные основателями зимологии Э. Хансеном и А. Клекером, были посвящены именно этой теме: поиску природных источников винных дрожжей Saccharomyces cerevisiae. В нашей стране этому вопросу также уделяли внимание крупнейшие микробиологи, например Г.А. Надсон. Сахаромицеты были найдены на ягодах винограда, однако, как оказалось, преобладают здесь совсем иные виды дрожжей, не участвующие в последующем сбраживании виноградного сока. Еще реже встречались сахаромицеты в окружающих субстратах, в частности, в почве под виноградниками. Уже в ранних работах высказывалось предположение, что почва не является средой, в которой возможно активное развитие дрожжевых грибов, а служит для последних лишь своеобразной «ловушкой», где дрожжи могут сохраняться определенное время в жизнеспособном состоянии и служить источником спор для инфицирования винограда нового урожая. Таким образом возникло понятие «круговорота дрожжей» в природе. Под «дрожжами» в то время подразумевались одноклеточные аскомицетовые грибы, родственные сахаромицетам и способные к активному брожению. . Расширяющиеся микологические исследования приводили к обнаружению все новых видов дрожжевых грибов, в том числе и таких, которые существенно отличались от типичных сахаромицетов. Оказалось, что многие из одноклеточных грибов, выделяемых из природных источников, не образовывали аскоспор и вообще не были способны к сбраживанию сахаров. Для таких дрожжей была создана серия формальных родов (Torulopsis, Candida, Rhodotorula, Cryptococcus), виды которых часто обнаруживаются в самых различных природных субстратах, включая почву, растения, разнообразные растительные остатки и природные воды. Стало понятным, что дрожжи распространены довольно широко, и их развитие далеко не ограничивается субстратами традиционных бродильных процессов. Однако, при этом существенно изменилось и содержание самого понятия «дрожжи». Дрожжами стали называть любые одноклеточные грибы, не обязательно вызывающие спиртовое брожение. В то же время, несмотря на существенные отличия между сахаромицетами и небродящими дрожжевыми грибами, достаточно долго сохранялось представление о дрожжах как самостоятельной филогенетической линии грибов. Лишь после обнаружения у несовершенных дрожжей рода Rhodotorula полного жизненного цикла, типичного для телиоспоровых гетеробазидиомицетов, термин «дрожжи» окончательно утратил таксономическое содержание. Тем не менее, вплоть до настоящего времени дрожжи продолжают рассматриваться в качестве единой группы, представляющей собой особую жизненную форму, или экоморфу грибов. Дело в том, что все дрожжи обладают очень сходным обликом за счет роста преимущественно в виде одиночных клеток. Кроме того, с одноклеточной организацией дрожжей сопряжены многие их физиологические особенности, в частности узкий спектр усваиваемых соединений, отсутствие способности к гидролизу труднодоступных полимеров, особенно таких, как целлюлоза и лигнин, быстрый рост за счет потребления простых углеводов. Особенно характерен этот набор признаков для аскомицетовых дрожжей. Все это делает их более приспособленными к обитанию в жидких и мелкодисперсных средах, богатых легкодоступными источниками углерода, в то время как мицелиальные грибы получают преимущество при росте на плотных поверхностях. Одноклеточность у грибов — вторичное явление в их эволюции, которое возникало независимо в разных группах аско- и базидиомицетов как реакция на существование в жидких и полужидких средах с относительно высокой концентрацией легкодоступных источников питания. Вскоре после открытия Пастером дрожжевой природы спиртового брожения было показано, что дрожжи постоянно обитают на поверхности ягод винограда и других сладких плодов, в цветочном нектаре, в кишечнике многих ксилофагов, проложенных ими галереях и личиночных камерах, в измельченной древесине, в кишечниках самых разных беспозвоночных, на наземных частях растений, в почве и т.д.
Специализация на выполнении неодинаковых функций приводит у разных групп дрожжевых грибов к формированию характерного комплекса морфологических и физиологических свойств. Это дает возможность говорить о различных жизненных формах дрожжей. В общей экологии термином «жизненная форма» обозначается внешний облик, определенный морфологический тип организма, сформировавшиеся в результате приспособления к определенной среде обитания. Как уже отмечалось, дрожжи в современном понимании представляют собой определенную жизненную форму грибов. У микроорганизмов приспособления носят в основном физиологический характер, и при выделении таких экологических групп необходимо учитывать физиологические характеристики, поэтому правильнее говорить не о жизненных формах, а о морфо-физиологических группах. Среди дрожжей можно выделять следующие жизненные формы:
· Сахаробионты — «настоящие» дрожжи, наиболее типичным представителем которых является Saccharomyces cerevisiae. Они обладают комплексом свойств, свидетельствующим об их приспособленности к существованию в средах, обогащенных легкодоступными источниками углерода. Отсутствие пигментации, развитых мицелиальных структур, хламидоспор, слизистых капсул, а также способность к более или менее интенсивному брожению и узкий спектр усваиваемых соединений углерода — характерный набор свойств этих дрожжей. Кроме сахаромицетов к сахаробионтам следует относить представителей родов Debaryomyces, Kluyveromyces, Torulaspora, Zygosaccharomyces, а также большинство видов из родов Pichia и Candida.
· Фитобионты — адаптированы к обитанию на поверхности живых частей растений и, как правило, образуют каротиноидные пигменты. Они часто имеют в цикле развития хламидоспоры или хламидоспороподобные клетки, устойчивые к высушиванию. Характерный признак многих видов — образование баллистоспор, рассеивающихся токами воздуха. Наиболее типичные представители фитобионтов — роды Sporobolomyces и Sporidiobolus, некоторые виды родов Rhodotorula и Cryptococcus.
· Сапробионты обладают относительно высокой гидролитической активностью и принимают участие в деструкции растительных остатков на средних и поздних стадиях. К типичным сапробионтам относятся некоторые виды рода Trichosporon, Cystofilobasidium capitatum, группа несовершенных видов базидиомицетового аффинитета, классифицируемых в роде Cryptococcus (Cryptococcus podzolicus, Cryptococcus humicolus).
· Педобионты — дрожжи, наиболее приспособленные к обитанию на твердых поверхностях почвенных частиц. Они обладают слизистыми капсулами, которые создают межклеточную среду, сохраняющую благоприятный режим влагообмена и питания в условиях временного иссушения почвы. Эти дрожжи способны накапливать большое количество запасных веществ, главным образом в форме липидов, которые обеспечивают переживание длительных периодов голодания. Для них также характерна способность к усвоению соединений азота в очень низкой концентрации. Типичные представители педобионтов — все виды липомицетов. По-видимому, к педобионтам можно также отнести некоторые виды криптококков, в частности Cryptococcus terreus, Cryptococcus aerius, Cryptococcus terricola.
Дожжевая клетка имеет все основные структуры, которые присущи любой эукариотической клетке, но в то же время она обладает особенностями, свойственными грибам, а именно, сочетанием признаков как растительной, так и животной клеток: клеточная стенка у них ригидная, как у растений, но в клетке отсутствуют хлоропласты и накапливается гликоген, как у животных.
Компоненты дрожжевой клетки
Ядро
В дрожжевой клетке в фазе между делениями всегда имеется только одно ядро. В световом микроскопе его можно увидеть после специальной окраски или с помощью фазово-контрастного устройства при высоких разрешениях. На электронно-микроскопических снимках ультратонких срезов дрожжевых клеток ядро выглядит как более или менее округлая органелла, окруженная двойной мембраной. В ней есть поры в виде округлых сквозных отверстий, которые образуются в результате слияния двух ядерных мембран. Однако ядерные поры — не просто отверстия, они заполнены сложноорганизованными структурами, которые называют комплексом пор ядра. Считается, что основная функция ядерных пор — транспорт готовых рибосомных субъединиц в цитоплазму. Ядерная оболочка многофункциональна, но в основном играет роль барьера, отделяющего содержимое ядра и регулирующего транспорт макромолекул между ядром и цитоплазмой. Основные функциональные единицы ядра — молекулы ДНК, несущие основную генетическую информацию о клетке. ДНК составляет основную часть хроматина — основного компонента ядра. Число хромосом в ядре разных видов дрожжей может быть различным, оно колеблется от 2 до 16.
Митохондрии
В митохондриях имеется собственная митохондриальная ДНК (мДНК), а также весь аппарат белкового синтеза, включая матричную РНК и 70S рибосомы (в отличие от 80S рибосом в цитоплазме). мДНК у дрожжей составляет 5-20% от всей ДНК клетки. Число митохондрий в одной дрожжевой клетке варьирует в пределах 1-20 в разные периоды роста и в зависимости от условий. Как правило, 1-2 митохондрии в клетке более крупные, чем остальные и имеют разветвленную форму. Реконструкция ультратонких срезов клетки позволяет предположить, что в некоторых случаях (в подготовительный период почкования) клетка содержит всего одну вытянутую и сильно разветвленную митохондрию. Митохондрии способны к самовоспроизведению.
Цитоплазаматическая мембрана
На поперечном срезе под электронным микроскопом мембрана у дрожжей выглядит как трехслойная структура. Она представляет собой два слоя фосфолипидов , в которые погружены белковые молекулы, то есть построена по общему для всех клеточных мембран принципу. Однако, имеются различия, касающиеся химического состава. У Saccharomyces cerevisiae основными фосфолипидами мембран являются лецитин, фосфатидилэтаноламин и фосфатидилсерин. На их долю приходится около 90% всех липидов мембраны. В состав мембраны дрожжей входят стероиды — эргостерол, зимостерол и др. Белки представлены в основном ферментами, которые участвуют в трансмембранном переносе веществ, расщеплении полисахаридов и синтезе внеклеточных структур. . Функции цитоплазматической мембраны многообразны: регуляция биосинтеза клеточной стенки, активный транспорт транспорт в клетку специфических молекул органических веществ, транспорт ионов K+ и Na+ и др.
Вакуоли
В фазово-контрастном микроскопе в клетках дрожжей хорошо видны светлые и прозрачные структуры круглой формы. Это вакуоли (см. приложение 3). Обычно их 1-3 в клетке. Каждая вакуоль окружена одинарной мембраной и содержит различные ферменты, липиды, низкомолекулярные продукты метаболизма (аминокислоты), ионы металлов. В вакуолях сосредоточена большая часть ионов калия. Иногда в вакуоли видны «пляшущие» за счет броуновского движения плотные гранулы. Это так называемые метахроматические гранулы, «пляшущие тельца» (dancing bodies), или волютин . Гранулы эти состоят из полимеризованных остатков фосфатов, а по периферии они покрыты комплексными соединениями из РНК, белков и липидов. Волютин — это резерв полифосфатов в клетке. Основная функция вакуолей — разобщение процессов синтеза и распада белков и нуклеиновых кислот. Они выполняют также роль депо для хранения некоторых запасных веществ и ферментов, участвуют в регуляции тургорного давления. Также в клетке присутствуют: клеточная стенка, которая защищает протопласт от осмотического разрыва и придает клетке определенную форму; капсула (слизистый полисахаридный чехол вокруг клетки), цитоплазма и липиды.
5. Морфология дрожжей
Макроморфологические признаки очень изменчивы и сильно зависят от состава среды и условий культивирования, поэтому они имеют весьма ограниченное значение в систематике дрожжей. . Дрожжевые культуры, растущие на плотных средах, по консистенции бывают чаще всего пастообразными, а также слизистыми, иногда полностью стекающими на дно пробирки, вязкими, клейкими, кожистыми или крошащимися. Слизистый рост характерен для многих анаморфных базидиомицетовых дрожжей родов Cryptococcus (см. приложение 4), Rhodotorula (см. приложение 5), Sporobolomyces, образующих большое количество внеклеточных полисахаридов, а также для аскомицетовых почвенных дрожжей рода Lipomyces (см. приложение 6). У большинства аскомицетовых дрожжей колонии пастообразные, сухие, культура при росте на скошенном агаре не стекает на дно пробирки. Для дрожжеподобных грибов, образующих как одиночные клетки, так и мицелий, характерны колонии с ворсинчатым краем, который хорошо просматривается при просвечивании. У большинства дрожжей колонии белые, часто приобретающие при старении кремовый или слегка коричневатый оттенок. У некоторых аскоспоровых дрожжей, например из рода Lipomyces, старые колонии при обильном спорообразовании темнеют и становятся бурыми или шоколадными. Многие дрожжи образуют пигменты, окрашивающие их колонии в различные цвета. Наличие каротиноидных пигментов , придающих колониям красную, розовую, оранжевую или желтую окраску, характерно для базидиомицетовых дрожжей родов Rhodotorula, Sporobolomyces и др. Аскомицетовые дрожжи Metschnikowia pulcherrima образуют диффундирующий в среду красно-вишневый пигмент пульхерримин. Так называемые «черные дрожжи», формируют темно бурые или черные колонии за счет накопления меланоидных пигментов . Микроморфология дрожжей включает признаки, характеризующие отдельные клетки (форма, размеры), а также способы вегетативного и бесполого размножения и образуемые при этом структуры.. Морфогенез дрожжевой клетки тесно связан со способом вегетативного размножения. Различают два принципиально различных способа образования вегетативных клеток у дрожжей — артрический (талломный) и бластический (зародышевый). При артрическом способе мицелий дрожжеподобных грибов одновременно распадается на отдельные одноклеточные элементы — артроспоры . Они образуются за счет расчленения гифы по поперечным септам после разрушения первичной стенки гифы в местах сочленения. Такой способ вегетативного размножения характерен для дрожжеподобных грибов Endomyces, Galactomyces, Arxula, Trichosporon, причем у двух последних родов образование артроспор сопряжено с их последующим почкованием. Бластический тип вегетативного размножения — это образование почек, что наиболее характерно для дрожжей. Почка представляет собой вырост на материнской клетке, который по мере увеличения в размерах отшнуровывается от нее. На материнской клетке при этом остается шрам почкования, а на отделившейся почке — шрам рождения. Шрамы почкования , или почечные рубцы, сохраняются на материнской клетке весь период ее жизни, а шрамы рождения со временем становятся малозаметными. Форма дрожжевых клеток довольно разнообразна (см. приложение 7) и этот признак тесно связан со способом почкования. У видов, размножающихся многосторонним почкованием, клетки имеют сферическую, округлую, овальную или яйцевидную форму. При биполярном почковании клетки приобретают апикулятную (лимоновидную) или грушевидную форму. У делящихся дрожжей клетки более или менее цилиндрические. Специфическую угловатую форму имеют клетки дрожжей рода Trigonopsis, серповидную — Metschnikowia lunata. Клетки дрожжей, образующие почки на стеригмах, зачастую приобретают форму, делающую их похожими на простекобактерии. У многих видов дрожжей в определенных условиях роста материнские и дочерние клетки после почкования не разъединяются, а продолжают почковаться. В результате возникают структуры, имитирующие мицелий. Такой мицелий называют ложным, или псевдомицелием (см. приложение 8). В отличие от истинного (септированного) мицелия, в нитях псевдомицелия между клетками обычно хорошо заметны перетяжки, а апикальные (концевые) клетки всегда короче предшествующих. Псевдомицелий, состоящий только из клеток одного типа, сходных по форме и размерам, называют примитивным (рудиментарным). Сложный псевдомицелий состоит из клеток более чем одного типа, обычно в нем резко различаются длинные клетки, составляющие псевдогифы, и расположенные на них одиночные или собранные гроздьями круглые, овальные или клиновидные почки, которые в этом случае называются бластоспорами (см. приложение 9). Образование псевдомицелия характерно для многих аскомицетовых дрожжей, например из родов Candida, Pichia.
Диморфизм и плеоморфизм
Для дрожжей, как и для других грибов, известны явления диморфизма и плеоморфизма. Мицелиально-дрожжевой диморфизм проявляется в том, что один вид может расти в двух формах — одноклеточной и мицелиальной. Например, у базидиомицетовых дрожжей обычно гаплоидная фаза одноклеточна, а диплоидная (дикариотическая) — мицелиальная. . О явлении плеоморфизма говорят, когда в жизненном цикле одного вида существуют два или несколько видов бесполого размножения. Плеоморфизм у дрожжевых грибов выражается в том, что наряду с основным типом вегетативного размножения почкованием или делением некоторые дрожжи образуют особые бесполые структуры, предназначенные специально для распространения или сохранения вида, например:
· баллистоспоры (см. приложение 10). Это экзогенные споры (конидии), которые формируются на заостренных кончиках особых выростов — стеригм, и при созревании с силой отстреливаются за счет капельно-экскреторного механизма. Способность к образованию баллистоспор, рассеиваемых через воздушную среду, свойственна дрожжам, обитающим на наземных частях растений. Примерами могут служить дрожжи родов Sporidiobolus, Sporobolomyces и др.;
· эндоспоры , представляющие собой бесполые эндогенные клетки, формирующиеся чаще всего в гифах мицелиальных дрожжей (например, Trichosporon) из участков цитоплазмы, которые отделяются мембраной и затем образуют клеточную стенку. Процесс можно трактовать как эндогенное почкование. Количество эндоспор в одной клетке строго не фиксировано. После разрушения мицелия эндоспоры освобождаются и начинают почковаться. Эндоспоры ни по структуре, ни по устойчивости не отличаются от вегетативных клеток;
· хламидоспоры (см. приложение 11). Это крупные сферические или овальные клетки, которые образуются как из одиночных дрожжевых вегетативных клеток, так и на мицелии, по одной или цепочками. Хламидоспоры на мицелии образует, например, Candida albicans. Из дрожжевых клеток формируются хламидоспоры в старых культурах Lipomyces, Cryptococcus, Metschnikowia, Phaffia. Хламидоспоры отличаются утолщенной многослойной клеточной стенкой и высокой концентрацией запасных веществ. Биологическая функция таких структур заключается в длительном сохранении жизнеспособности в условиях голодания или низкой влажности. В средах с легкодоступными источниками энергии такие хламидоспоры прорастают путем почкования, или образуют трубки прорастания. В других случаях хламидоспоры выступают как структуры, в которых проходит кариогамия и мейоз, что ведет к образования асков (например, у Metschnikowia pulcherrima) или базидий (у базидиомицетовых дрожжей Leucosporidium, Mrakia, Rhodosporidium). В последнем случае такие структуры называют телиоспорами.
6. Половое размножение и жизненные циклы дрожжей
Половое размножение — это сложная цепь событий, включающая контакт двух гаплоидных клеток, их слияние (сначала слияние цитоплазмы — плазмогамия, а затем сразу же или со значительной задержкой слияние ядер — кариогамия), образование диплоидной зиготы, ядро которой затем либо делится мейотически с восстановлением гаплоидного состояния, либо дает начало диплоидному поколению клеток. Таким образом, половое размножение связано со сменой ядерных фаз. У дрожжей, как и у всех грибов, чередование ядерных фаз сопряжено с образованием половых гаплоидных спор – аскоспор (см. приложение 12) или базидиоспор (см. приложение 13). Весь ход событий в развитии организма от одной стадии до этой же стадии в следующем поколении составляет жизненный цикл, или онтогенез. Полный жизненный цикл включает вегетативную стадию, в течение которой клетки размножаются при помощи митотического деления, и половой цикл, включающий мейотическое деление ядра. У мицелиальных грибов вегетативное размножение занимает обычно одну из стадий жизненного цикла: у аскомицетов — преимущественно гаплоидную, у базидиомицетов — дикариотическую. У дрожжей вегетативное размножение может происходить в любой фазе жизненного цикла. На этом основании различают гаплоидные виды, у которых вегетативное размножение происходит в гаплоидной фазе, диплоидные виды, размножающиеся вегетативно в диплофазе, а также гапло-диплоидные, образующие стабильные как гапло-, так и диплофазы, или же смешанные популяции гаплоидных и диплоидных клеток. У дрожжей встречаются различные типы полового процесса . У большинства видов в половом процессе у дрожжей участвуют обычные соматические, то есть неспециализированные клетки. Такой тип полового процесса называется соматогамией. Существуют разновидности соматогамии:
· гологамия — слияние (копуляция) двух морфологически сходных соматических клеток,
· педогамия — слияние материнской и дочерней клетки-почки,
· адельфогамия - слияние сестринских клеток-почек.
· У некоторых видов аскомицетовых дрожжеподобных грибов половой процесс представляет собой типичную для большинства аскомицетов гаметангиогамию — копуляцию специальных клеток мицелия — гаметангиев. Копулировать могут не любые две клетки, а лишь клетки, относящиеся к различным типам спаривания.
Термин «тип спаривания» используется вместо термина «пол» в том случае, когда копулирующие клетки не имеют морфологических отличий, а различаются лишь физиологически. У одних дрожжей при вегетативном размножении происходит разделение клеток на различные типы спаривания (обозначаемые a и α), и, следовательно, в потомстве одной клетки возможен половой процесс. Такие дрожжи называют гомоталличными. У других клетки не способны переключаться с одного типа спаривания на другой, и половой процесс в потомстве одной клетки невозможен. В этом случае дрожжи называют гетероталличными. Половой процесс у таких дрожжей происходит только при объединении клеток из популяций a и α типов спаривания.
Дифференциация пола у дрожжей
Особенности половой дифференциации и конъюгации клеток при половом размножении наиболее хорошо изучены у дрожжей Saccharomyces cerevisiae. При половом размножении могут конъюгировать не любые две клетки, а только клетки различных типов спаривания. Эти клетки различаются между собой только по одному генетическому локусу, обозначаемому mat (mating — спаривание). Локус mat может находиться в двух аллельных состояниях: mat a и mat α. Клетки, несущие локус mat a или mat α, обозначаются соответственно как a- и α-клетки. Локусы mat a и mat α ответственны за образование так называемых половых факторов (соответственно a- и α-фактора), которые представляют собой олигопептиды. a-Фактор, образуемый а-клетками, способен блокировать процесс митотического деления у α-клеток. α-Фактор, образуемый α-клетками, блокирует митотическое размножение у а-клеток. Поэтому конъюгация возможна только при взаимодействии а- и α-клеток, но не а х a или α х α. После конъюгации а- и α-клеток образуется диплоидная клетка (зигота), имеющая генотип а/α. Только такие клетки способны к мейотическому делению с образованием половых спор. В процессе мейотического деления а/α клетки образуется 4 гаплоидных ядра, два из которых а-типа, а два — α-типа. Поэтому в типичном четырехспоровом аске две аскоспоры принадлежат к а-типу, а две — к α-типу. Более сложные случаи генетической детерминации пола наблюдаются у базидиальных дрожжей. У видов в родах Rhodosporidium, Leucosporidium, Sporidiobolus тип спаривания не биполярный, а тетраполярный, так как определяется не двумя (а и α), а четырьмя аллелями, которые принято обозначать как А, а, В, в. В этом случае скрещивание возможно лишь между штаммами, которые различаются всеми четырьмя аллелями: АВ ґ ав или Ав ґ аВ. В комбинациях ав ґ ав или АВ ґ АВ спаривание невозможно. При взаимодействии штаммов, различающихся только по одному локусу: АВ ґ аВ, АВ ґ Ав, ав ґ Ав или ав ґ аВ, иногда наблюдается копуляция клеток, но дикариотический мицелий, как правило, не развивается.
К аскомицетам относят дрожжи, половые споры которых формируются эндогенно внутри особых вместилищ — сумок, или асков. В отличие от мицелиальных аскомицетов, большая часть жизненного цикла которых проходит в гаплоидной фазе, а диплоидна только молодая сумка, среди аскоспоровых дрожжей есть виды с разными типами онтогенеза: гаплоидным, диплоидным и гапло-диплоидным. При этом аском может стать либо непосредственно зигота (Schizosaccharomyce, Zygosaccharomyces), либо отдельная диплоидная вегетативная клетка (Saccharomyces, Saccharomycodes), либо сумка развивается как новообразование с участием так называемых «активных» почек, выполняющих функцию гамет (Lipomyces). Аски могут также формироваться из хламидоспор (см. приложение 11), из клеток псевдомицелия (см. приложение 8), или на истинном мицелии. В любом случае формирование аска происходит из диплоидной клетки после мейотического деления ядра. Мейоз представляет собой два следующих друг за другом деления ядра с однократным удвоением хромосом. Перед вторым делением хромосомы не удваиваются, поэтому в результате происходит редукция числа хромосом и возникают четыре гаплоидных ядра. Затем в районе ядерных бляшек начинают формироваться мембраны, которые постепенно разрастаются и охватывают часть цитоплазмы будущего аска. После образования аскоспор остается небольшое количество «неиспользованной» цитоплазмы. Между двумя листками мембран закладывается клеточная стенка аскоспоры. Аскоспоры отличаются от вегетативных клеток более толстой и многослойной клеточной стенкой, меньшим развитием внутриклеточных мембранных систем, отсутствием вакуолей. Эти особенности связаны с пониженной метаболической активностью аскоспор. Обычно аскоспоры содержат большое количество запасных веществ, чаще всего — липидов. Аскоспоры дрожжей — это типичные покоящиеся споры, способные более или менее длительный период существовать в неактивном состоянии. Однако, устойчивость аскоспор к ряду повреждающих факторов, например, к повышенным температурам, обычно не намного выше, чем у вегетативных клеток. Форма аскоспор у дрожжей очень разнообразна. Они могут быть круглыми, овальными, бобовидными, чечевицеобразными, серповидными, игловидными и т.д. Кроме того, аскоспоры могут иметь на поверхности клеточной стенки различные скульптурные образования, которые хорошо выявляются в электронном микроскопе. За счет таких образований аскоспоры могут быть бородавчатыми, сатурновидными, напоминающими грецкий орех и пр. Морфология асков зависит от способа их образования, типа полового процесса (гологамия или педогамия), количества и формы аскоспор. Количество аскоспор в аске у разных видов может быть от одной до нескольких десятков. Наиболее часто встречаются аски с 1,2,4 и 8 аскоспорами. Аски различаются также временем существования. У большинства дрожжей аски устойчивые и разрушаются только в очень старых культурах. Но есть виды с быстро разрушающимися асками . Морфология асков, аскоспор, тип полового процесса имеют большое таксономическое значение. Эти признаки используются в систематике дрожжей при выделении таксонов родового уровня. . Рассмотрим несколько примеров жизненных циклов аскомицетовых дрожжей.
· Гаплоидные . У таких дрожжей вегетативное размножение происходит в гаплоидной фазе, а диплоидная стадия очень короткая: образовавшееся диплоидное ядро сразу же делится мейотически с восстановлением гаплоидного состояния. Schizosaccharomyces pombe. Половой процесс — гологамия. Две морфологически сходные гаплоидные вегетативные клетки образуют выросты, с помощью которых происходит контакт, а затем слияние содержимого клеток. Возникает диплоидная зигота, которая вегетативно не размножается, а ядро ее сразу переходит к мейотическому делению. Образующиеся четыре гаплоидных ядра включаются в аскоспоры. После освобождения из аска аскоспоры прорастают и дают начало длительной стабильной вегетативной фазе. Lipomyces tetrasporus. Половой процесс — адельфогамия. Роль гамет здесь выполняют активные почки. Такие почки формируются на гаплоидных вегетативных клетках на поздних стадиях роста после периода вегетативного размножения. Обычно две почки на одной материнской клетке выполняют функцию гамет и копулируют между собой, образуя зиготу, которая затем разрастается в виде мешка и отделяется перегородкой от несущей ее клетки. Ядро зиготы делится мейотически и она превращается в четырехспоровый мешковидный аск, прикрепленный к материнской клетке, на которой может затем формироваться вторая и третья сумки.
· Диплоидные . У этих дрожжей вегетативно размножаются только диплоидные клетки. Гаплофаза ограничена молодыми асками и аскоспорами. . Saccharomycodes ludwigii. У этих дрожжей диплоидизация происходит при слиянии аскоспор. Четыре гаплоидные аскоспоры прорастают и начинают копулировать попарно, когда они еще находятся в аске. Образовавшиеся диплоидные клетки размножаются вегетативно, образуя стабильную и длительную диплофазу. При соответствующих условиях, когда снимается контроль митотического деления ядра, диплоидная клетка вступает в митотический цикл и превращается в аск с 4 аскоспорами. Hanseniaspora uvarum. Жизненный цикл сходен с описанным выше за исключением того, что споры не копулируют, но ядро в зрелой споре после освобождения ее из сумки в условиях, обеспечивающих вегетацию, делится мейотически. Образовавшиеся два гаплоидных ядра сливаются, образуя уже диплоидную клетку, способную к вегетативному размножению. Сходный цикл наблюдается и у почвенных дрожжей Williopsis saturnus.
· Гапло-диплоидные . Существуют дрожжи, у которых вегетативное размножение может происходить как в гаплоидной, так и в диплоидной фазах. Длительность той или другой фазы зависит от вида и от условий роста. Saccharomyces cerevisiae. Эти дрожжи вегетируют преимущественно в диплоидном состоянии, но у них имеется короткая вегетативная гаплоидная фаза. Диплоидная клетка в условиях дефицита легкодоступных источников углерода прекращает почковаться, и ядро ее делится мейотически. В результате она превращается в аск с 4 гаплоидными аскоспорами, которые после освобождения из аска прорастают и образуют гаплоидное поколение. Гаплоидные клетки обычно мельче диплоидных и имеют более округлую форму. Шрамы почкования у них сближены, почки образуются группами в одном локусе. После нескольких циклов почкования две клетки конъюгируют и сливаются, восстанавливая диплоидное состояние.
Базидиомицетовые дрожжи
В отличие от аскоспоровых дрожжей, все дрожжи, которые относят к базидиомицетам, образуют в ходе полового размножения специальные клетки — базидии, несущие экзогенные споры (базидиоспоры). Значительную часть жизненного цикла занимает дикариотическая фаза, представленная дикариотическим мицелием с пряжками. Большинство видов гетероталличны и поэтому многие из них долгое время были известны только в гаплофазе как несовершенные дрожжи. Жизненные циклы базидиомицетовых дрожжей также достаточно разнообразны. Активное исследование жизненных циклов базидиомицетовых дрожжей началось лишь в конце 60-х — начале 70-х годов XX в., после того как японский миколог Исао Банно опубликовал результаты открытия полового цикла у хорошо известных и ранее считавшихся несовершенными красных дрожжей Rhodotorula glutinis. Ему удалось подобрать типы спаривания среди большого числа проверенных штаммов, и в результате их скрещивания он наблюдал образование дикариотического мицелия, на котором формировались структуры, морфологически сходные с хламидоспорами, то есть крупные клетки с сильно утолщенными оболочками и большим запасом внутриклеточных липидов. Именно в них затем происходило слияние двух ядер и последующий мейоз с восстановлением гаплоидного состояния. Эти клетки получили название телиоспор. При прорастании они образовывали промицелий с поперечными септами, делящими его на 4 клетки. Эти клетки отпочковывали гаплоидные споридии. Совершенная стадия Rhodotorula glutinis была названа Банно Rhodosporidium toruloides. Позже сходный цикл был описан для некоторых баллистоспоровых дрожжей и для нескольких видов несовершенного рода Candida. Их телиоспоровые стадии получили соответственно родовые названия Sporidiobolus и Leucosporidium. Сейчас похожие полные или не завершенные жизненные циклы известны для многих базидиомицетовых дрожжей. Они различаются формой телиоспор, характером их прорастания и морфологией базидий. . Другой тип жизненного цикла базидиомицетов с дрожжевой анаморфой известен для дрожалковых грибов порядка Tremellales. Эти грибы известны достаточно давно, так как в онтогенезе этих организмов есть стадия образования макроскопических плодовых тел, которые в природе обычно развиваются на старой древесине, на стволах мертвых деревьев. То, что базидиоспоры дрожалковых грибов способны к почкованию, было замечено микологами еще в конце XIX в., однако наличие самостоятельной дрожжевой фазы в цикле развития тремелловых было установлено после детального изучения видов рода Tremella в 1960-х гг. В культурах отдельные базидиоспоры гетероталличных видов дают начало дрожжевым стадиям. Мицелий обычно развивается только при смешивании штаммов совместимых типов спаривания. Смешение соответствующих типов спаривания приводит к быстрой реакции клеток на выделяющиеся феромоны; почкование прекращается, развиваются конъюгационные трубки, через которые клетки копулируют, происходит плазмогамия и развивается мицелиальная дикариотическая стадия. У многих видов в подходящих условиях вскоре после формирования дикариотического мицелия начинается развитие плодовых тел. В плодовых телах образуются 2-4-клеточные гетеробазидии . Освободившиеся базидиоспоры могут размножаться вегетативно почкованием или формированием баллистоспор. Характеристики жизненного цикла играют большую роль в систематике базидиомицетовых дрожжей. Однако очень часто у базидиомицетовых дрожжей, изолируемых из природных местообитаний, не удается наблюдать полный жизненный цикл при культивировании на лабораторных средах, поэтому их идентификация и классификация вызывают большие трудности. Значительные успехи в систематике таких анаморфных базидиомицетовых дрожжей достигнуты в последние десятилетия, особенно в связи с внедрением в таксономическую практику молекулярно-биологических методов. Как оказалось, группирование базидиомицетовых дрожжей на основе молекулярно-биологических признаков, в частности нуклеотидных последовательностей рРНК, часто не совпадает с характеристиками их жизненного цикла, особенно такими, как способность к образованию телиоспор, морфология базидий. Поэтому классификация базидиомицетовых дрожжей еще далека от завершенности и требует дальнейших исследований.
7. Особенности метаболизма
Хотя дрожжи и не так разнообразны по своему метаболизму, как бактерии, различные виды дрожжей могут катаболизировать разные соединения углерода и азота и образовывать различные конечные продукты. При росте в аэробных условиях при низком содержании глюкозы в среде дрожжи получают АТФ за счет процессов дыхания, как это делает большинство аэробных организмов. Полное окисление углеродного субстрата до углекислого газа и воды может происходить у дрожжей в цикле трикарбоновых кислот , и в пентозофосфатном цикле . При функционировании каждого из этих циклов в клетке происходит образование восстановленных пиридиннуклеотидов. Они могут быть использованы либо для процессов восстановления в ходе биосинтеза, либо для получения АТФ путем окислительного фосфорилирования . В последнем случае НАД·Н становится донором электронов для электронно-транспортной цепи, в которую у дрожжей входят такие белки-переносчики электронов, как флавопротеиды и цитохромы, локализованные на внутренней мембране митохондрий. Наиболее известное свойство многих дрожжей — способность к спиртовому брожению. Многие виды дрожжей могут переключаться с бродильного метаболизма на дыхательный и обратно в зависимости от условий: при наличии кислорода брожение ингибируется и дрожжи начинают дышать, в отсутствие кислорода включается механизм спиртового брожения. Так как кислородное дыхание — энергетически более выгодный процесс, чем брожение, то выход биомассы дрожжей в расчете на единицу используемого субстрата выше при выращивании их в аэробных условиях, чем в анаэробных. Это явление называется эффектом Пастера . . Спиртовое брожение может идти не только в анаэробных условиях. Если выращивать дрожжи в присутствии кислорода, но при высоком содержании глюкозы в среде, то в этом случае дрожжи также сбраживают глюкозу. Таким образом, глюкоза подавляет процессы аэробного дыхания. Это явление получило название эффекта Кребтри , или катаболитной репрессии. Многие дрожжи вообще не способны бродить. По соотношению между этими двумя процессами в метаболизме можно выделить следующие группы дрожжей:
· Дрожжи, существующие только за счет брожения и не способные расти в аэробных условиях. К ним относится, например, вид Arxiozyma telluris, обитающий в кишечном тракте грызунов.
· Активные бродильщики : интенсивно сбраживают различные субстраты, но в аэробных условиях переключаются на дыхательный обмен. Представители — Saccharomyces cerevisiae, Schizosaccharomyces pombe.
· Слабые бродильщики — в основном существуют за счет аэробного дыхания, но в анаэробных условиях могут бродить, однако значительно менее интенсивно, чем виды из предыдущей группы. Это аскомицетовые дрожжи из родов Pichia, Debaryomyces, а также все способные к брожению базидиомицетовые дрожжи.
· Дрожжи, существующие только за счет дыхания и не способные расти в анаэробных условиях . К этой группе относятся аскомицетовые дрожжи из рода Lipomyces и многие несовершенные дрожжи базидиомицетового аффинитета — Cryptococcus, Rhodotorula, Sporobolomyces.
Субстраты брожения
Все бродящие дрожжи сбраживают глюкозу и фруктозу, поскольку именно с этих сахаров начинается гликолитическое расщепление. Кроме глюкозы и фруктозы могут сбраживаться другие соединения. В основном к ним относятся гексозы и олигосахариды, включающие остатки гексоз. Из моносахаридов наиболее часто сбраживается галактоза, из дисахаридов — сахароза, мальтоза, трегалоза. Значительно реже встречаются дрожжи, сбраживающие лактозу и мелибиозу. Долгое время не были известны дрожжи, способные интенсивно сбраживать пентозы. Такие виды были описаны только к началу 80-х годов XX в. К ним относятся, например, Pichia stipitis (несовершенная стадия — Candida shehatae), Pachysolen tannophilus. Брожение ксилозы начинается с восстановления ее до ксилита с помощью фермента ксилозоредуктазы. Затем ксилит окисляется ксилитдегидрогеназой до ксилулозы, которая фосфорилируется с образованием ксилулозо-5-фосфата. Последний может вступать в реакции пентозофосфатного пути, где происходит перестройка углеродного скелета ксилулозо-5-фосфата с образованием интермедиатов гликолиза.
8. Дрожжи — возбудители заболеваний человека
Среди дрожжей нет облигатно-патогенных видов, которые могут размножаться только в организме человека. Однако, в природных местообитаниях встречаются факультативно-патогенные и условно-патогенные дрожжи, которые могут вызывать серьезные заболевания у людей с ослабленным иммунитетом. К таким заболеваниям относятся:
Кандидоз
Основным возбудителем кандидоза является Candida albicans. Однако это заболевание могут вызывать и другие виды: C. tropicalis, C. parapsilosis, C. glabrata, C. krusei, реже C. lusitaniae, C. guilliermondii, C. rugosa и др. Все они являются несовершенными дрожжеподобными грибами аскомицетового аффинитета. Их довольно часто можно встретить в различных природных местообитаниях. Многие из них также относятся к компонентам нормальной микрофлоры человека, то есть постоянно обитают в теле здоровых людей. Их часто можно выделить с кожи, слизистых оболочек, из фекалий. Важной особенностью всех этих видов является их способность к росту при 37°C, те есть при температуре тела человека. Массовое развитие дрожжей в теле человека приводит к кандидозу. Заболевание возникает в основном у людей с ослабленной иммунной системой. Наиболее распространенными причинами являются злокачественные новообразования, травмы, ожоги и серьезные хирургические вмешательства, длительное лечение антибиотиками широкого спектра действия, преждевременные роды; трансплантация органов и тканей, которая обычно сопровождается применением препаратов, подавляющих естественный иммунитет. Повышенные шансы заболеть кандидозом имеют недоношенные новорожденные и лица пожилого возраста с наличием тяжелых заболеваний, а также наркоманы, использующие нестерильные шприцы. В последнее время кандидоз особенно часто развивается у больных СПИДом. Кандидоз встречается во всем мире. Клинические формы кандидоза могут быть очень разнообразными. Они варьируют от поверхностных поражений слизистых оболочек, кожи и ногтей до обширных поражений различных внутренних органов и тканей. Распространенной формой кандидоза является т.н. «молочница», при которой поражаются слизистые оболочки рта и горла. При этом на языке и слизистой оболочке рта появляются кремово-белые пятна, которые распространяются на небо и глотку. Поскольку возбудитель при этом проглатывается, в отсутствие лечения возможно инфицирование легких и желудочно-кишечного тракта. Сходные с молочницей симптомы возникают при поражении слизистых оболочек половых органов. При поверхностном кандидозе могут также поражаться крупные складки кожи, особенно под молочными железами, паховые и межъягодичные области, заушные складки. На коже возникают омертвевшие белые участки, которые превращаются в мокнущие красные эрозии. Больных при этом беспокоит зуд, жжение. При поражении дрожжами внутренних органов возникают особенно тяжелые формы кандидоза, характеризующиеся высокой летальностью, достигающей 30-70%. В зависимости от локализации возбудителя в теле у больных могут развиваться кандидозная пневмония, кандидозный менингит, поражения различных внутренних органов. Основным способом лечения кандидозов является применение антимикотиков — антигрибных препаратов. Среди них наиболее распространены амфотерицин В, флуконазол, итраконазол. Очень большое значение имеет точная идентификация возбудителя, так как разные виды Candida, вызывающие кандидоз, имеют различную чувствительность к этим препаратам. Для этого возбудитель должен быть выделен из тела больного с помощью посева проб пораженных тканей на питательные среды и получен в виде чистой культуры. Некоторые виды при росте на питательных средах очень близки по морфологическим и физиологическим характеристикам и для их точной идентификации приходится применять современные молекулярно-биологические методы.
Криптококкоз
Криптококкоз (торулез, европейский бластомикоз) — заболевание, вызываемое несовершенными дрожжами базидиомицетового аффинитета Cryptococcus neoformans. Дрожжи этого вида можно встретить в природных местообитаниях, но наиболее часто его обнаруживают в помете голубей, воробьев и других птиц, при этом сами птицы не болеют. В сухом помете криптококки могут сохраняться в течение многих месяцев. Cryptococcus neoformans обнаруживали также на слизистых оболочках здоровых людей. . Инфицирование человека обычно происходит воздушно-пылевым путем. Наиболее опасным проявлением криптококкоза является менингоэнцефалит, при котором поражается центральная нервная система. Заболевание начинается приступами головной боли, которые постепенно усиливаются и становятся нестерпимыми. Появляются признаки паралича, сознание нарушается. Развитие болезни ведет к постепенному истощению организма, затем коматозному состоянию. Смерть наступает от паралича дыхания через 4-6 месяцев. Смертность при криптококковом менингите достигает 100%. У многих больных, кроме поражения центральной нервной системы, развивается криптококкоз легких. Он протекает в виде пневмонии, которая по симптомам очень похожа на пневмонии другой этиологии. При диссеминированной форме криптококкоза могут поражаться самые различные органы. Встречаются также поражения кожи и слизистых оболочек, которые протекают относительно легко. Также как и в случае кандидоза, наибольшие шансы заболеть криптококкозом имеют люди с нарушением клеточного иммунитета, обусловленным СПИДом, лейкозом, отторжением трансплантанта при пересадке органов и тканей, а также длительным применением иммуносупрессантов. Для лечения криптококкоза используют различные антимикотики, такие как амфотерицин, флуконазол, подавляющие у грибов синтез эргостерина, и 5-фторцитозин, ингибирующий у них синтез нуклеиновых кислот. Для большей эффективности эти препараты используют комбинированно, что обусловлено также и частым обнаружением резистентных к ним штаммов. Обнаружение последних вынуждает медиков вести непрерывный поиск новых антифунгальных агентов.
Malassezia
Дрожжи рода Malassezia — облигатные симбионты человека и теплокровных животных, обитающие на поверхности их кожи и на волосяном покрове. В других местообитаниях эти организмы не встречаются. Первые описания этих грибов относятся к середине XIX в. Они были обнаружены в образцах кожи людей, больных так называемым пестрым лишаем. При микроскопировании кожных чешуй в них наблюдали короткие гифы, проникающие в слой эпидермиса. Первые попытки культивировать эти грибы были безуспешными. В образцах кожи и волос можно также нередко наблюдать присутствие дрожжевых клеток, которые также не культивируются на обычных средах для дрожжей. Этот организм, вызывающий образование перхоти, получил название Pityrosporum. Вырастить эти организмы в культуре удалось в 20-х гг. XX в. Оказалось, что для роста им необходимы добавки жирных кислот, например оливкового масла. Позже при культивировании Pityrosporum обнаружилось, что эти дрожжи способны к образованию гиф, которые по морфологии идентичны гифам Malassezia. Таким образом было доказано, что Pityrosporum и Malassezia — это дрожжевая и мицелиальная стадия одного и того же гриба. . Дрожжи рода Malassezia вместе с различными бактериями относятся к компонентам нормальной микрофлоры человека и постоянно обнаруживаются на разных участках кожи здоровых людей. Обычны они и на коже домашних и диких теплокровных животных, причем плотность заселения кожи этими дрожжами коррелирует с количеством выделяемого сального секрета. Однако при различных нарушениях иммунной системы виды рода Malassezia могут вызывать различные заболевания кожи. Из них наиболее известен упомянутый выше пестрый лишай, или питириаз . Это хроническое неконтагиозное заболевание, распространенное главным образом в тропических странах. Оно выражается в массовом развитии гиф Malassezia, которые проникают в слой эпидермиса, нарушая пигментацию и нормальную структуру поверхностного слоя кожи. Другим заболеванием, вызываемым этим грибом, является фолликулит, который характеризуется наличием воспалений в виде множества фолликул — мелких нарывов, распространяющихся по спине, груди, предплечьям и сопровождающихся сильным зудом. Фолликулит также встречается наиболее часто в странах с теплым климатом. Еще одно заболевание кожи, вызываемое дрожжами рода Malassezia — себоррейный дерматит . Они могут выступать в качастве важного аллергена при таком распространенном в последнее время аллергическом заболевании, как атопический дерматит. Заболевания, ассоциированные с Malassezia, являются в основном хроническими и характерны для людей с подавленной иммунной системой и предрасположенными к аллергии. Лечение их направлено на устранение дрожжей с помощью различных антимикотиков. У здоровых людей при нормальном функционировании сальных желез присутствие Malassezia на коже незаметно. Более того, они могут играть положительную роль, конкурируя с болезнетворными микроорганизмами.
9. Промышленное использование дрожжей
Дрожжи были первыми микроорганизмами, которые человек стал использовать для удовлетворения своих потребностей. Основное свойство дрожжей, которое всегда было привлекательным для человека — это способность к образованию довольно больших количеств спирта из сахара. Первое упоминание о получении спиртных напитков в Египте, так называемой «бузы », представляющей собой разновидность пива, относится к 6000 г. до н. э. Этот напиток получали в результате сбраживания пасты, полученной при раздавливании и растирании проросшего ячменя. Приготовление бузы можно считать рождением современного пивоварения. Из Египта технология пивоварения была завезена в Грецию, а оттуда в Древний Рим. В этих же странах активно развивалось виноделие. Крепкие спиртные напитки, полученные перегонкой бражки, по-видимому, были впервые получены в Китае около 1000 г. до н. э. В Европе процесс производства спирта был завезен значительно позже. Известно, что получение виски было налажено в Ирландии в XII в. Сейчас промышленное производство спиртных напитков существует в большинстве стран мира и представляет собой крупную отрасль промышленности. Другая группа процессов, в которых издавна используются дрожжи, также связана с их способностью к спиртовому брожению: образование углекислого газа под действием дрожжей — важнейший этап в приготовлении хлеба, приводящий к заквашиванию теста. Этот процесс также очень древний. Уже к 1200 г. до н. э. в Египте была хорошо известна разница между хлебом из кислого и пресного теста, а также польза от применения вчерашнего теста для заквашивания свежего.
Традиционные процессы
Виноделие, пивоварение и хлебопечение существуют уже несколько тысячелетий. Естественно, что за это время были отселекционированы сотни видов заквасок, которые используются для приготовления самых различных сортов вина и пива. Однако лишь в начале XIX в. были высказаны предположения, что за спиртовое брожение, вызываемое этими заквасками, ответственны присутствующие в них дрожжи, увиденные впервые в 1680 г. Антони ван Левенгуком. Окончательным доказательством роли дрожжей в сбраживании сахаров считается работа Пастера, опубликованная им в 1866 г. К концу ХIХ в. стало известно, что сахаромицеты, выделенные из различных заквасок и различных сортов вина и пива, различаются по физиологическим свойствам, например, по способности к сбраживанию различных сахаров. В дальнейшем на основании таких физиологических различий в роде Saccharomyces было описано несколько десятков видов. Однако в последние годы методами молекулярной и генетической таксономии было показано, что большинство этих «видов» на самом деле представляют собой различные физиологические расы нескольких близких биологических видов, главным образом Saccharomyces cerevisiae. Это такие «виды», как, например, Saccharomyces vini, Saccharomyces ellipsoides, Saccharomyces oviformis, Saccharomyces cheresiensis, Saccharomyces chevalieri и десятки других, которые сейчас переведены в разряд синонимов Saccharomyces cerevisiae. Большинство этих «видов» — это отселекционированные веками расы — такой же продукт человеческой деятельности, как сорта культурных растений. В природе их найти иногда просто невозможно. Однако, недавно Г.И.Наумов обнаружил, что дикие популяции Saccharomyces cerevisiae распространены на Дальнем Востоке в сокотечениях дуба. Он предположил, что Дальний Восток — центр видообразования этих дрожжей. Кроме Saccharomyces cerevisiae в природных местообитаниях обнаружены еще несколько очень близких видов-двойников: Saccharomyces bayanus, Saccharomyces paradoxus и Saccharomyces cariocanus, Saccharomyces kudriavzevii, Saccharomyces mikatae, а также их межвидовые гибриды. Дрожжи используются также при изготовлении множества других традиционных пищевых продуктов. Например, специальные расы дрожжей входят в состав заквасок, использующихся для приготовления кефира . Дрожжи применяются в сыроварении при получении некоторых сортов сыра . В Восточной Азии широко распространены многочисленные закваски для получения разнообразных традиционных соусов, в состав которых входят специфические виды дрожжей, не встречающиеся в других местообитаниях. В быту большую популярность получил «чайный гриб» — специфическая бактериально-дрожжевая ассоциация, с помощью которой получают легкий, освежающий напиток. Двадцатый век с его безудержным развитием промышленности резко расширил и области применения дрожжей. Они стали выращиваться в больших масштабах в качестве источника белка и витаминов для сельскохозяйственных животных. Дрожжи — основной источник технического этанола. С помощью дрожжей сейчас получают большой спектр соединений, использующихся в разных областях человеческой деятельности. К ним относятся витамины, различные полисахариды, липиды, которые могут служить заменителями растительных масел, разнообразные ферменты, используемые в пищевой промышленности. Развитие генетической инженерии позволило использовать легко культивируемые дрожжи для получения многих полезных веществ животной и растительной природы, например инсулина.
Виноделие
В основе получения вина лежит сбраживание фруктозы и глюкозы виноградного сока с образованием этилового спирта. Собранный виноград давят и получают так называемое виноградное сусло, или муст, в котором содержится 10-25% сахара. При производстве красного вина кожица и косточки винограда остаются в соке в течение всего процесса брожения, тогда как для приготовления белых вин их удаляют после раздавливания ягод и сбраживается только сок. В традиционных процессах приготовления вина сбраживание муста ведется с помощью дрожжей, присутствующих на винограде. При этом в брожении участвует множество видов дрожжей, сменяющих друг друга, такие как Hanseniaspora, Brettanomyces, Saccharomyces. В современном виноделии для сбраживания в основном используют чистые культуры специальных рас сахаромицетов. При этом присутствующие в сусле «дикие» дрожжи сначала убивают, обычно пропуская через муст двуокись серы. После окончания брожения молодое вино необходимо осветлить и дать ему созреть. Эти процессы для высококачественных вин могут занимать несколько лет. В процессе созревания вина происходит рост бактерий, которые удаляют из него яблочную кислоту, а также различные биохимические изменения, которые улучшают вкусовые качества вина. При производстве некоторых сортов вин в качестве исходного сырья используется не виноградный сок, а уже готовое вино. Такое, так называемое вторичное виноделие, включает процессы дображивания и модификации вин с использованием специальных рас дрожжей. К наиболее известным продуктам вторичного виноделия относятся шампанские вина . Шампанское получают из смеси вин (купажа), в которую добавляют сахар и дрожжи, после чего выдерживают в замкнутом объеме для вторичного брожения (шампанизации). Традиционные процессы шампанизации проводятся в бутылках, на крупных заводах — в больших емкостях. При шампанизации происходит растворение и химическое связывание образующейся углекислоты, которая при открывании бутылки в результате перепада давления освобождается и придает вину неповторимую игристость. Дрожжи вносят в производство вина двойной вклад: они ответственны за образования этанола в напитке, а также за накопление в нем множества вторичных соединений, от которых зависит его вкус и аромат. Такие соединения называются органолептическими. Часть из них образуется непосредственно в ходе брожения, часть — при химических превращениях компонентов вина в ходе его созревания. В винах обнаружены сотни органолептических соединений. Многие из них присутствуют в очень малых количествах и с трудом поддаются идентификации. Еще сложнее определить вклад всех этих соединений в окончательный букет вина, поскольку для каждого вещества характерна своя концентрация, при которой его присутствие можно уловить с помощью обоняния (так называемый порог запаха).
Пивоварение
Технология приготовления пива включает несколько этапов. Пиво производят из зерна, которое в отличие от винограда содержит в основном крахмал, плохо усваиваемый дрожжами. Поэтому перед сбраживанием этот крахмал необходимо осахарить (гидролизовать). Традиционно в различных странах для производства пива использовали различные виды зерновых: в Европе — ячмень, в Азии — рис, в Америке — кукурузу. При осахаривании ячменя обычно пользуются амилазами самого ячменя, которые образуются в большом количестве при прорастании зерна. Для гидролиза рисового крахмала на Востоке традиционно используют некоторые штаммы мицелиальных грибов (Mucor, Aspergillus). Проросший и высушенный ячмень (так называемый солод ) затем высушивают в печи. При этом в результате карамелизации сахаров образуются окрашенные соединения, которые придают пиву характерный цвет. Высушенный солод размалывают, смешивают с водой и варят, в результате чего получается так называемое пивное сусло . В результате всех этих процессов часть крахмала исходного зерна гидролизуется до мальтозы, глюкозы и других сахаров, другая часть, фракция декстринов, не расщепляется и поэтому не утилизируется дрожжами и остается без изменений в течение всего последующего процесса брожения. Концентрация декстринов обусловливает плотность пива (светлое или темное). После осахаривания зерно высушивают, размалывают, кипятят, фильтруют. В процессе варки сусла в него обычно добавляют хмель придающий пиву характерный горьковатый привкус. Полученное пивное сусло сбраживают чистыми культурами дрожжей Saccharomyces cerevisiae. В пивоварении различают два типа брожения: верховое (теплое) и низовое (холодное). Вызывающие их дрожжи различаются рядом свойств и ранее рассматривались как различные виды: верховые Saccharomyces cerevisiae и низовое Saccharomyces carlsbergensis. Дрожжи низового брожения функционируют при температуре 6-10°C, в то время как верховое брожение протекает при 14-25°C. В конце брожения низовые дрожжи оседают на дно сосуда, образуя плотный осадок, а верховые дрожжи всплывают на поверхность, образуя так называемую «шапку». Подъем дрожжей верхового брожения на поверхность обусловлен более интенсивным брожением, при котором образуются пузырьки углекислого газа, поднимающие дрожжевые клетки. . Важное технологическое свойство дрожжей, используемых в пивоварении — так называемая флоккуляционная способность. Флоккуляция — слипание клеток друг с другом на заключительных стадиях брожения, в результате чего образуются хлопья, быстро оседающие на дно сосуда. От флоккуляционной способности дрожжей в значительной степени зависят степень сбраживания сусла, осветление пива и количество собранных дрожжей в конце брожения. Для максимального превращения сахара в этанол необходимо, чтобы дрожжи оставались суспендированными в бродящей жидкости. С другой стороны, флоккуляция дрожжей после того, как брожение закончилось или достигло желаемой стадии, очень облегчает удаление дрожжей из напитка. Другими словами, дрожжи должны флоккулировать только на определенной стадии брожения. Хотя важность процесса флоккуляции в изготовлении алкогольных напитков была оценена уже более ста лет назад, физиологический механизм этого явления был изучен лишь в последние десятилетия. В слипании клеток участвуют присутствующие в растворе ионы двухвалентного кальция, взаимодействующие с карбоксильными и фосфодиэфирными группами на поверхности клеточных стенок дрожжей.
Различные продукты, получаемые из дрожжей
В последние десятилетия разнообразие биотехнологических процессов, в которых используются дрожжи, резко увеличилось. Еще более разнообразны перспективы использования дрожжей: в различных разработках, патентах и т.п. упоминается более 200 видов. Сейчас дрожжи используются для получения различных ферментных препаратов, органических кислот, полисахаридов, многоатомных спиртов, витаминов и витаминных добавок, а также во множестве других мелкомасштабных процессах. Промышленно важные органические кислоты, продуцируемые микроорганизмами, являются либо конечными продуктами (молочная, масляная, пропионовая кислоты у анаэробных бактерий), либо интермедиатами метаболизма. Последние можно получать с помощью дрожжей. В наибольших масштабах производится лимонная кислота, в основном с помощью Aspergillus niger, с использованием в качестве субстрата мелассы. Однако, ее можно получать и с помощью дрожжей на более дешевых субстратах, таких как парафины нефти или этанол. Сейчас разработаны технологии получения и многих других кислот, например, изолимонной из Candida catenulata, фумаровой из Candida hydrocarbofumarica, яблочной из Pichia membranaefaciens и др. Многоатомные спирты (глицерин, ксилит, эритрит, арабит) — широко применяются в химической и пищевой промышленности. Перспективным считается способ получения сахароспиртов, таких как глицерин, эритрит и ксилит, с использованием ксеротолерантных дрожжей рода Zygosaccharomyces. Эти дрожжи способны расти в средах с высоким осмотическим давлением, синтезируя при этом большое количество внутриклеточных полиолов, которые служат осмопротекторами. Другой способ касается получения ксилита — важного полиола для пищевой промышленности. Ксилит накапливается как побочный продукт при сбраживании ксилозы дрожжами Pachysolen tannophilus. Применение дрожжей как источников витаминов началось в 1930-е годы. Одним из первых промышленных процессов получения витаминов было выделение эргостерина из Saccharomyces cerevisiae с последующим облучением ультрафиолетом для перевода в витамин D. Затем у дрожжей была открыта способность к сверхсинтезу некоторых витаминов группы В, в частности рибофлавина. Некоторые красные дрожжи используются для получения каротиноидов, в частности β-каротина, служащего предшественником витамина A, астаксантина, используемого в качестве кормовой добавки в рыбоводстве. Кроме производства индивидуальных витаминов уже много лет в мире практикуется получение автолизатов и гидролизатов дрожжей, питьевых дрожжей , которые используются как источник витаминов и как вкусовые добавки.
1. Бабьева И.П. Дрожжи в биогеоценозах разных природных зон. В кн.: «Почвенные организмы как компоненты биогеоценоза», Москва: Наука, 1984
2. Бабьева И.П. Дрожжи. В кн.: «Мир растений», Москва: Просвещение, 1990, т. 2
3. Бабьева И.П., Голубев В.И. «Методы выделения и идентификации дрожжей». М.: Пищевая промышленность, 1979
4. Бабьева И.П., Горин С.Е. Почвенные дрожжи. Москва: Изд‑во МГУ, 1987
5. Берри Д. Биология дрожжей. Москва: Мир, 1985
6. Квасников Е.И., Щелокова И.Ф. Дрожжи. Биология. Пути использования. Киев: Наукова Думка, 1991
7. Кудрявцев В.И. Систематика дрожжей. Москва: Изд‑во АН СССР, 1954
8. Новое с систематике и номенклатуре грибов. Ред. Ю.Т.Дьяков, Ю.В.Сергеев. Москва: Национальная академия микологии. Медицина для всех, 2003, 494 с.
9. Бабьева И.П., Чернов И.Ю. «Биология дрожжей» Москва:, 2004.
Похожие рефераты:
Выделение чистых культур дрожжевых грибов из шишек хмеля
Технология производства сухих дрожжей
Грибы — особое царство живой природы
Роль материнского генома в развитии потомка
Грибы и их использование
Грибковые заболевания кожи
Клетка
Строение растительной клетки. Ткани растений
Технология производства хлебопекарных дрожжей
Технология производства пива
Производство кормовых дрожжей на сахаросодержащих средах гидролизатах растительной биомассы
Все о клетке
Грибы
Микробиология и иммунология
Отдел красные водоросли
Размножение, рост и индивидуальное развитие организмов
Шпоры по анатомии и физиологии человека
Шпаргалки (биология) для выпускных экзаменов в 11 классе
реферат на тему питатели хлебопекарных производств
Технология хлебопекарного производства
Технология хлебопекарного производства План 1. Характеристика предприятия 2. Характеристика продукта. Биологический объект
Реферат: Производство формового хлеба —
2011-6-2 · на тему: «Производство формового хлеба» Выполнил: Безручко А.Ю. Студент: 3-го курса Факультет: АКС и УП Специальность: 501 Шифр: 070046 Проверил: Муратов В.Г. Одесса – 2010 Реферат
Реферат Технология производства крупы
2021-2-14 · На тему: « Технология производства кофе». Мичуринск 2012 Содержание Введение 1. Кофе в зернах 1.1 Виды и особенности
Реферат: Приготовление хлеба из пшеничной муки
2014-2-10 · Использование муки из зерна не хлебопекарных и бобовых культур (рисовой мучки, кукурузной, гороховой и фасолевой муки) Работы, похожие на Реферат: Приготовление хлеба из пшеничной
Российская База Рефератов Реферат
Российская База Рефератов Реферат: Технология приготовления хлеба Таблица№ 3.1 Показатели Бункера ВНИЭКИ продмаша Бункера ВНИИХПа Бункера Гипропищепрома ХБГ ХБГ-2 А1-ХБУ-26 А1-ХБУ-39 А1-ХБУ-52
Реферат: Оборудование для первичной
Другие файлы: Оборудование для переработки мяса Содержит сведения об оборудовании для первичной переработки мясного сырья, продуктов убоя, производства колбасных и копченых мясных продуктов, перераб…
Реферат: Модернизация тестомесильной машины
2011-6-2 · Влажностью не менее 39% при выработке различных сортов сдобных булочных изделий на хлебопекарных предприятиях малой мощности и в кондитерских цехах.
Влияние сахарозы и мальтозы на размножение
На протяжении многих лет в бродильной промышленности для производства хлебопекарных дрожжей, приготовления пива, вина, спирта, получения различных напитков брожения используют дрожжи вида Saccharomyces cerevisiae [1, 2].
Рабочие площадки. Бесплатный доступ к реферату
2021-3-23 · Рабочие площадки – реферат на тему. Бесплатный доступ к базе с возможностью скачать оригинал реферата. Бесплатный доступ к реферату
Дипломы, курсовые, рефераты, контрольные
2021-5-11 · Фабрика основана в декабре 1956 года и стала самым крупным предприятием по выпуску верхней одежды в Восточной Сибири. В 1992 году фабрика преобразована в открытое акционерное общество. В 1998;1999 гг. совместно с
Реферат: Производство формового хлеба —
2011-6-2 · на тему: «Производство формового хлеба» Выполнил: Безручко А.Ю. Студент: 3-го курса Факультет: АКС и УП Специальность: 501 Шифр: 070046 Проверил: Муратов В.Г. Одесса – 2010 Реферат
Производства пищевых продуктов — allRefs.net
2021-2-6 · Производства пищевых продуктов Философия Общие принципы переработки сырья. На сайте allRefs.net есть практически любой реферат, курсовая работа, конспект, лекция, диплом, домашняя работы и пр. учебный материал.
Диплом, курсовая, контрольная работа на заказ
2021-3-26 · Диплом, курсовая, контрольная работа на заказ Заказ диплома, курсовой, реферата и любой другой студенческой работы
Реферат: Производство формового хлеба —
2011-6-2 · на тему: «Производство формового хлеба» Выполнил: Безручко А.Ю. Студент: 3-го курса Факультет: АКС и УП Специальность: 501 Шифр: 070046 Проверил: Муратов В.Г. Одесса – 2010 Реферат
Производства пищевых продуктов — allRefs.net
2021-2-6 · Производства пищевых продуктов Философия Общие принципы переработки сырья. На сайте allRefs.net есть практически любой реферат, курсовая работа, конспект, лекция, диплом, домашняя работы и пр. учебный материал.
Диплом, курсовая, контрольная работа на заказ
2021-3-26 · Диплом, курсовая, контрольная работа на заказ Заказ диплома, курсовой, реферата и любой другой студенческой работы
Влияние различных ферментативных обработок на извлечение твердых веществ, белков и углеводов
Для определения содержания твердых веществ, белков и углеводов в автолизате реакционную смесь
нагревали на водяной бане при 100 ° C в течение 10 минут для дезактивации фермента. и центрифугировали (3500 об / мин)
10 мин.
Ферментный гидролиз. Свежие пекарские дрожжи суспендировали в 10 мл дистиллированной воды для достижения концентрации 50% (мас. / Об.). Суспензии дрожжей помещали в стеклянные сосуды объемом 100 мл, погруженные в водяную баню с регулируемой температурой и встряхивателем.Начальный pH доводили до 6,0 с помощью NaOH (10 M), и раствор so-
нагревали на водяной бане при 100 ° C в течение 10 минут для дезактивации эндоферментов дрожжей. При использовании дрожжей ac-
гидролиз проводят без термической обработки. Добавляли папаин (0,5, 1,0, 2,5 и 5,0
%) или литиказу (0,005, 0,010, 0,020 и 0,025%). Гидролиз проводили при 60 ° C.
Время гидролиза и скорость встряхивания были такими же, как для автолиза. После всех ферментативных обработок гидролизат нагревали (кипящая водяная баня, 10 мин) и центрифугировали.
Аналитические методы
Общее количество твердых веществ в свежих дрожжах и YE определяли по сухой массе после сушки
при 105 ° C до достижения постоянной массы. Общее содержание твердых веществ выражали в% твердых веществ
, рекуперированных в YE, по отношению к общему количеству твердых веществ, присутствующих в свежих дрожжах.
Общее содержание сырого протеина определяли методом Лоури14.
Для определения содержания углеводов использовали «основной фильтрат».Он был получен из «основного раствора» путем осаждения насыщенным раствором свинцового ацетата.15 И стандарт
,, и образцы были проанализированы антрон-сернокислотным методом.16
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Эффекты лечения папаином по восстановлению твердого вещества, белков и углеводов
Инактивированные дрожжи. Chaoet al. сообщили, что наиболее эффективные ферменты, способствующие автолизу дрожжей
, принадлежат к группе сульфгидрил-протеаз, в которую входят папаин,
фицин и бромелайн.17 Папаин оказался наиболее эффективным среди этих трех протеаз.
В настоящем исследовании дрожжевые клетки обрабатывали различными концентрациями папаина
, и влияние различных доз ферментов на извлечение твердого вещества и белка
показано на рис. 1. Каждый результат представляет собой среднее значение из трех повторностей.
измерения. Также показаны результаты, полученные в процессе автолиза.
Высвобождение твердых веществ и восстановление белка увеличивалось с увеличением времени инкубации
и дозировки папаина.Когда использовалась концентрация папаина 0,5%, не было
существенной разницы между гидролизом и автолизом. Более низкие концентрации —
внутриклеточных компонентов были получены с использованием этой концентрации папаина,
по сравнению с процессом автолиза. Следовательно, эндоферменты дрожжей проявляют большую эффективность в протеолизе, чем 0,5% папаина. Оптимальная дозировка папаина
составила 2,5%. Максимальное содержание твердого вещества, белка и углеводов,
, полученное через 72 часа гидролиза, с этой концентрацией папаина составляло: 59.84%,
56,75 мг / мл и 9,83 мг / мл соответственно. Дальнейшее увеличение дозировки папаина
до 5,0% привело к незначительному увеличению восстановления, что не было пропорционально увеличению дозировки фермента. Это указывает на то, что активные центры фермента
были насыщены при концентрации 2,5%. Следовательно, дальнейшее увеличение дозы фермента не оказало значительного влияния на высвобождение белка.
Максимальная концентрация углеводов, полученная при гидролизе папаина
дрожжевых клеток, была ниже 10 мг / мл.Приблизительно такое же содержание было примерно
ПРОИЗВОДСТВО ЭКСТРАКТА ДРОЖЖЕЙ 453
Простой и быстрый протокол получения дрожжевого экстракта из Saccharomyces cerevisiae, пригодный для приготовления бактериальных питательных сред
Iran J Pharm Res. Осень 2016; 15 (4): 907–913.
Омид Зарей
a Биотехнологический исследовательский центр, Тебризский университет медицинских наук, Тебриз, Иран.
b Кафедра фармацевтической биотехнологии, фармацевтический факультет, Тебризский университет медицинских наук, Тебриз, Иран.
c Студенческий исследовательский комитет, Тебризский университет медицинских наук, Тебриз, Иран.
Сиавуш Дастмалчи
a Биотехнологический исследовательский центр, Тебризский университет медицинских наук, Тебриз, Иран.
d Кафедра медицинской химии фармацевтического факультета Тебризского университета медицинских наук, Тебриз, Иран.
Марьям Хамзех-Мивехруд
a Биотехнологический исследовательский центр, Тебризский университет медицинских наук, Тебриз, Иран.
d Кафедра медицинской химии фармацевтического факультета Тебризского университета медицинских наук, Тебриз, Иран.
a Биотехнологический исследовательский центр, Тебризский университет медицинских наук, Тебриз, Иран.
b Кафедра фармацевтической биотехнологии, фармацевтический факультет, Тебризский университет медицинских наук, Тебриз, Иран.
c Студенческий исследовательский комитет, Тебризский университет медицинских наук, Тебриз, Иран.
d Кафедра медицинской химии фармацевтического факультета Тебризского университета медицинских наук, Тебриз, Иран.
* Автор, ответственный за переписку: E-mail: [email protected]; [email protected]
Поступила в редакцию 2015 фев; Принята в печать 2015 г., май.
Авторские права © 2016 Фармацевтический факультет Университета медицинских наук и служб здравоохранения имени Шахида Бехешти Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 3.0 /), который разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях PMC.Abstract
Дрожжи, особенно Saccharomyces cerevisiae, — одни из самых старых организмов с широким спектром применения благодаря своей уникальной генетике и физиологии. Дрожжевой экстракт, то есть продукт дрожжевых клеток, широко используется в качестве питательного ресурса в питательных средах для бактерий.
Целью этого исследования было разработать простой, быстрый и рентабельный процесс производства дрожжевого экстракта. В этой процедуре для получения дрожжевого экстракта использовались механические методы, такие как высокая температура и давление. Рост бактерий, питаемых полученным дрожжевым экстрактом, контролировали, чтобы оценить качество продукта. Результаты показали, что качество полученного дрожжевого экстракта было очень многообещающим, сделанное на основании модели роста бактериальных клеток в средах, приготовленных из этого продукта, и было сопоставимо с качеством трех коммерческих дрожжевых экстрактов с точки зрения свойств роста бактерий.Одним из основных преимуществ нынешнего метода было то, что не использовались химические вещества и ферменты, что привело к снижению стоимости производства. Этот метод очень прост и рентабелен, и его можно реализовать в разумные сроки, что делает его пригодным для использования в исследовательских лабораториях. Кроме того, его можно масштабировать для производства больших партий для промышленного применения.
Ключевые слова: Пекарские дрожжи, Дрожжевой экстракт, Рост бактерий, Saccharomyces cerevisiae
Введение
Дрожжи — важные эукариотические микроорганизмы, принадлежащие к царству грибов.С исторической точки зрения, они использовались для самых разных целей с тысячи лет назад, таких как ферментация, выпечка и биоремедиация (1-3), а также широкий спектр исследовательской деятельности в биологических науках благодаря своей уникальной генетике и физиологии. (4-8). Кроме того, содержащиеся в дрожжах питательные клетки, известные как «дрожжевой экстракт», также используются для многих важных целей. Дрожжевой экстракт — это обработанный дрожжевой продукт, который содержит растворимые компоненты дрожжевых клеток и широко используется в пищевой промышленности в качестве пищевого ароматизатора, добавок и витаминных добавок, а также в качестве источника питания для бактериальных питательных сред, используемых в микробиологии и биотехнологии (9-10).Более того, важность использования дрожжевого экстракта в промышленной ферментации для производства микробной биомассы или продуктов доказана многочисленными исследованиями (11-14). Для производства дрожжевого экстракта использовались различные виды дрожжей, особенно Saccharomyces cerevisiae (известные как пекарские дрожжи) (15-17). Дрожжевой экстракт получают с использованием различных методов, в том числе основанных на методах автолиза и гидролиза. Целью различных методов является разрушение клеточной стенки дрожжей (для высвобождения содержимого клеток) и восстановление растворимой фракции.В зависимости от цели производства процедура получения дрожжевого экстракта различается. Например, если целью производства дрожжевого экстракта является его использование в пищевой или косметической промышленности, требуется несколько этапов для получения дрожжевого экстракта пищевого / косметического качества. Эти этапы включают множество физических, химических и ферментативных методов разрушения клеточной стенки дрожжей, за которыми следуют несколько дополнительных этапов, таких как фильтрация, хроматография или другие методы разделения для удаления нерастворимых материалов с целью получения продукта без запаха, вкуса и цвета (18-19 ).Хотя качество дрожжевого экстракта улучшается за счет применения этих дополнительных процедур, но большинство из этих этапов очень трудоемки, отнимают много времени, дороги и несущественны, если целью производства является использование дрожжевого экстракта для микробиологических исследований в качестве одного из основных компонентов. среды для культивирования бактериальных клеток.
Независимо от наличия большого количества коммерческих дрожжевых экстрактов для приготовления питательной среды для микробов, простой метод приготовления высококачественного дрожжевого экстракта будет очень полезным.Принимая во внимание важность и широкий спектр применения дрожжевого экстракта в среде микробной ферментации, нашей целью в текущем исследовании было разработать простой, быстрый и рентабельный процесс производства дрожжевого экстракта, применимый в различных лабораториях, чтобы соответствовать требованиям экспериментальные потребности, а также возможность использования в промышленности в качестве важного компонента среды для микробной ферментации в больших количествах.
Материалы и методы
Приготовление дрожжевого экстракта
Водную суспензию дрожжевых клеток получали добавлением 500 г пекарских дрожжей ( Saccharomyces cerevisiae ) к 2 л деионизированной воды (вода milli-Q).Приготовленную суспензию автоклавировали при 115 ° C в течение 10 мин с последующим быстрым охлаждением на льду. Затем клеточный дебрис отделяли центрифугированием при 400 g при 4 ° C в течение 10 мин. Супернатант снова центрифугировали в тех же условиях, чтобы убедиться в удалении нерастворимого клеточного содержимого. Выделенный супернатант, содержащий растворимый компонент, повторно автоклавировали и снова охлаждали, как описано выше. Полученный водорастворимый экстракт хранили при –20 ° C до приготовления дрожжевого экстракта в виде порошка.Затем растворимую фракцию подвергали мини-распылительной сушилке (B-290, Büchi Labortechnik AG, Flawil, Швейцария) для получения порошкообразной формы дрожжевого экстракта.
Оценка роста бактериальных клеток
Рост бактерий, питаемых полученным дрожжевым экстрактом, контролировали для оценки качества продукта. С этой целью были приготовлены различные бактериальные культуральные среды либо в твердой, либо в жидкой форме. В первом подходе мы использовали только дрожжевой экстракт в качестве единственного источника питательных веществ в среде для культивирования бактериальных клеток.Для этой цели твердую и жидкую среду готовили по следующему протоколу: для твердой среды смесь 8 г полученного порошка дрожжевого экстракта и 15 г агара (Merck, Дармштадт, Германия) растворяли в 1 л деионизированной воды и автоклавировали (121 ° C). C, 15 фунтов) в течение 15 мин с последующим распределением по 8-сантиметровым стерильным пластиковым чашкам. В качестве среды отрицательного контроля также была приготовлена аналогичная твердая среда без порошка дрожжевого экстракта. Для жидкой среды 20 г полученного порошка дрожжевого экстракта растворяли в конечном объеме 1 л деионизированной воды и автоклавировали, как указано выше.Охлажденная среда разливалась по стерильным пробиркам. Также была приготовлена аналогичная среда для отрицательного контроля (т.е. среда без дрожжевого экстракта). Бактериями, использованными для культивирования в приготовленных средах, были E. coli (DH5α) и Staphylococcus aureus (PTCC 1112) как грамотрицательные и грамположительные бактерии, соответственно. Для твердых сред бактерии наносили штрихами на планшет и инкубировали в течение ночи при 37 ° C. В случае жидких сред свежую ночную культуру бактерий разводили в среде 1: 100 и инкубировали при 37 ° C при встряхивании со скоростью 180 об / мин.В разные интервалы времени (например, 2, 4, 8, 16, 24 и 48 ч) образцы были взяты в стерильных условиях для мониторинга роста бактерий в подготовленных средах путем считывания оптических плотностей (OD) образцов при 600 нм с использованием УФ-излучения. спектрофотометр (Ultrospec 2000, Amersham Pharmacia Biotech). Каждый эксперимент проводился в трех экземплярах.
В качестве дополнительного подхода к оценке рост бактерий контролировали в бульонной среде Лурия Бертани (обычно используемой в микробиологии среде), приготовленной с использованием дрожжевого экстракта, полученного в этом исследовании, и экстрактов, полученных от коммерческих поставщиков.Бульонную среду LB готовили следующим образом: 5 г порошка дрожжевого экстракта, 10 г триптона (HiMedia, Кат. №: RM014) и 5 г NaCl (Scharlau, Кат. №: SO0225) растворяли в 1 л деионизированной воды с последующим растворением. автоклавирование и розлив в стерильные пробирки. Чтобы сравнить профиль роста бактериальных клеток в среде, приготовленной из дрожжевого экстракта, полученного нами, с аналогичными коммерческими продуктами дрожжевого экстракта, три разных дрожжевых экстракта от известных компаний, а именно Sigma (каталожный номер: 92144-F), Merck ( Кот.№: 1.03753) и Applichem (№ по каталогу: A3732). Готовили среду, содержащую все ингредиенты, за исключением дрожжевого экстракта, и использовали ее в качестве среды отрицательного контроля. Все процедуры, связанные с культивированием бактерий и мониторингом роста бактериальных клеток, проводили, как описано выше.
Анализ состава продукта
Количественный анализ состава полученного дрожжевого экстракта был выполнен справочной лабораторией (лаборатория ASA, Тегеран, Иран). Были проанализированы химические свойства: общее количество белка, жира, золы, хлорида натрия, общего летучего азота (TVN), влаги и pH.
Статистический анализ
Все статистические анализы для сравнения роста бактерий в среде бульона LB, приготовленной с использованием различных дрожжевых экстрактов, проводили с использованием t-теста, реализованного в программе SPSS (версия 21.0). Статистически значимым считалось значение p <0,05.
Результаты
Производство дрожжевого экстракта
В данной работе для приготовления дрожжевого экстракта использовали пекарские дрожжи ( Saccharomyces cerevisiae ) . Готовили водную суспензию дрожжей с последующим автоклавированием и центрифугированием для получения растворимой фракции. Эти шаги (центрифугирование и автоклавирование) были повторены еще раз для полного удаления остатков клеток. Супернатант наносили на распылительную сушилку для получения порошкообразного дрожжевого экстракта.
Оценка роста бактериальных клеток в твердых и жидких средах
E. coli DH5α и Staphylococcus aureus , как представители грамотрицательных и грамположительных типов бактерий, соответственно, использовали для систематического определения роста бактерий как в твердой, так и в жидкой среде, приготовленной из полученного дрожжевого экстракта.Результат показал, что обе бактерии могут расти в твердой среде, содержащей полученный дрожжевой экстракт в качестве единственного источника питательной поддержки. . показаны колонии E. coli DH5α и Staphylococcus aureus, соответственно. Колоний в контрольной среде для обеих бактерий (.) Не наблюдалось. . продемонстрировать скорость роста E. coli DH5α и Staphylococcus aureus в жидкой бульонной среде, состоящей из полученного дрожжевого экстракта в качестве единственного источника энергии, соответственно.Графики показывают, что дрожжевой экстракт, полученный в этой работе, имеет достаточно высокое качество, чтобы использовать его в качестве единственного источника питания для роста бактериальных клеток.
Выращивание бактерий на твердой среде, приготовленной из дрожжевого экстракта, как единственного источника энергии для бактерий. (A) Колонии Staphylococcus au r eus в виде грамположительных бактерий на твердой среде, приготовленной из полученного дрожжевого экстракта. (B) Колонии E. coli DH5α в виде грамотрицательных бактерий на твердой среде, приготовленной из полученного дрожжевого экстракта.(C и D) Твердая среда без дрожжевого экстракта в качестве контроля для культивирования Staphylococcus au r eus и E. coli DH5α соответственно. Как видно на контрольных планшетах, в среде нет колоний. Эксперименты проводили в трех экземплярах.
(A) Схема роста E. coli DH5α как грамотрицательные бактерии (B) и Staphylococcus au r eus в виде грамположительных бактерий на жидких средах, приготовленных из полученного дрожжевого экстракта (в качестве единственного источника энергии) в различные промежутки времени.Как видно, количество бактерий увеличивается в течение 48 часов для обоих типов бактерий. Показаны средние ОП для трех отдельных экспериментов в разное время и соответствующее стандартное отклонение.
Качество полученного дрожжевого экстракта также оценивали как один из компонентов среды бульона LB и сравнивали с тремя коммерческими дрожжевыми экстрактами. Результаты показали, что оба типа бактерий были способны расти в среде LB, приготовленной из полученного дрожжевого экстракта, сравнимой с таковой в среде LB, приготовленной с использованием трех коммерческих дрожжевых экстрактов (.и .). Статистический анализ показал, что нет значительных различий между темпами роста обоих типов бактерий в бульонной среде LB, приготовленной с использованием нашего дрожжевого экстракта и трех коммерческих продуктов. Сравнение скорости роста бактерий в среде LB, приготовленной с использованием полученного дрожжевого экстракта, со скоростью роста в контрольной среде, лишенной какого-либо дрожжевого экстракта, выявило значительную разницу для обоих типов бактерий. Разница наблюдалась через 4–48 ч после инокуляции E.coli и 8–48 часов для Staphylococcus aureus (значение p <0,05) (. и.).
A) Профиль роста бактериальных клеток для E. coli DH5α в виде грамотрицательных бактерий на бульонной среде Luria Bertani, приготовленной из дрожжевого экстракта, полученного в этом исследовании, и коммерческих продуктов (Applichem, Merck и Sigma). В качестве контроля использовали среду, не содержащую дрожжевого экстракта. Для каждой точки данных были выполнены трехкратные определения. Для ясности стандартные отклонения показаны только для среды, приготовленной из дрожжевого экстракта, полученного нами, а также для контрольных сред.(B) Гистограмма E. coli DH5α Рост в другой среде LB. Результаты показывают, что нет значительной разницы между скоростью роста бактерий в бульонной среде LB, дополненной полученным дрожжевым экстрактом, и в бульонной среде LB, содержащей три коммерческих дрожжевых экстракта (значение p> 0,05). Анализ показывает значительную разницу между темпами роста E. coli DH5α на среде LB, приготовленной с использованием дрожжевого экстракта, полученного нами, и контроля через 4, 8, 16, 24 и 48 часов инокуляции (значение p <0.05). Существенные различия отмечены звездочками (*).
(A) Профиль роста бактериальных клеток для Staphylococcus au r eus в виде грамположительных бактерий на бульонной среде Luria Bertani, приготовленной из дрожжевого экстракта, полученного в этом исследовании, и коммерческих продуктов (Applichem, Merck и Sigma). В качестве контроля использовали среду, не содержащую дрожжевого экстракта. Для каждой точки данных были выполнены трехкратные определения. Для ясности стандартные отклонения показаны только для среды, приготовленной из дрожжевого экстракта, полученного нами, а также для контрольных сред.(B) Гистограмма Staphylococcus au r eus рост в другой среде LB. Результаты показывают, что нет значительной разницы между скоростью роста бактерий в бульонной среде LB, дополненной полученным дрожжевым экстрактом, и в бульонной среде LB, содержащей три коммерческих дрожжевых экстракта (значение p> 0,05). Анализ показывает значительную разницу в скорости роста Staphylococcus au r eus на среде LB, приготовленной с использованием дрожжевого экстракта и контроля, полученного нами, через 8, 16, 24 и 48 часов инокуляции (p-значение <0.05). Существенные различия отмечены звездочками (*).
Анализы состава дрожжевого экстракта
Количественный анализ полученного порошкового дрожжевого экстракта показал, что экстракт содержит: белок (30%), жир (0,42%), хлорид натрия (0,67%), золу (12,18%), общий летучий азот (9,2%) с влажностью. 4,72% и pH 6,29.
Обсуждение
Дрожжевой экстракт — продукт дрожжевых клеток, содержащий аминокислоты, липиды, витамины, минералы и другие растворимые компоненты, широко применяемый в пищевой промышленности, а также как источник питания для микробных культур в области исследований молекулярной биологии и ферментационной промышленности ( 20-22).Двумя общими подходами к производству дрожжевого экстракта являются автолиз и гидролиз, однако это не исчерпывающая категоризация, и многие методы выходят за рамки этой классификации. Автолиз, естественное событие, происходящее после гибели клетки, представляет собой саморазложение клеточных компонентов дрожжевой клетки высвобожденными эндогенными пищеварительными ферментами. Сообщалось о нескольких стратегиях улучшения процесса автолиза, таких как изменение температуры, pH и осмотического давления, облучение рентгеновскими лучами и механическое измельчение или использование хитозана, химических индукторов, таких как органические растворители и обычные соли (23-26).Процесс автолиза связан с некоторыми недостатками, такими как низкий выход экстракции, сложность разделения твердой и жидкой фаз из-за риска микробного загрязнения в результате длительной инкубации. В методе гидролиза для разрушения содержимого клеток используются различные экзогенные ферменты, кислоты или щелочи (27-29). При применении экзогенных ферментов в процессе гидролиза стоимость производства будет увеличена, кроме того, использование кислот или щелочей в этом процессе усложнит процессы очистки.
Исследования показывают, что в некоторых протоколах использовались различные механические процедуры для улучшения процессов авто- или гидролиза, но они не использовались отдельно для производства дрожжевого экстракта (30-31). В текущей работе мы разработали быстрый механический метод получения дрожжевого экстракта из пекарских дрожжей ( Saccharomyces cerevisiae ) для использования в качестве питательного агента в питательных средах для бактерий. В этом методе к суспензии дрожжевых клеток применялись высокая температура и давление с последующим быстрым охлаждением.Он вызывает потерю целостности клеточной мембраны, вызывая шок для дрожжевых клеток, что нельзя рассматривать как метод, основанный на автолизе или гидролизе. Впоследствии растворимая фракция экстракта была подвергнута распылительной сушилке для получения дрожжевого экстракта в виде порошка, который больше подходит для хранения. Качество полученного дрожжевого экстракта было многообещающим, что было сделано на основании характера роста бактериальных клеток в средах, приготовленных из этого продукта. Важно отметить, что полученный дрожжевой экстракт мог использоваться бактериями в качестве единственного источника энергии в бактериальных твердых и жидких средах (.и .). Полученный дрожжевой экстракт сравним с тремя коммерческими дрожжевыми экстрактами с точки зрения свойств роста бактерий в среде LB (и). Преимущества разработанного нами метода производства дрожжевого экстракта по сравнению с существующими протоколами следующие:
i) В процессе экстракции не использовались химические вещества, такие как кислоты, щелочи или соли, что, в свою очередь, устраняет сложности в последующих процессах из-за удаления добавленных реагентов и снижает стоимость производства.
ii) В процессе экстракции фермент не использовался, поэтому конечная стоимость производства будет снижена.
iii) Количество необходимых шагов в процессе экстракции было уменьшено, что ускорило производство дрожжевой экстракции по сравнению с другими доступными утомительными и трудоемкими методами.
Заключение
Таким образом, мы разработали простой, быстрый и рентабельный метод производства дрожжевого экстракта из пекарских дрожжей ( Saccharomyces cerevisiae) .Этот метод может использоваться в исследовательских лабораториях для снижения затрат на исследования и расширяться для производства больших количеств для промышленных применений, где необходимо культивирование микробов.
Конфликт интересов
Авторы не заявляют о конфликте интересов.
Ссылки
1. Менсор Н., Маргаритис А, Бриенс С., Пилкингтон Х., Рассел И. Применение иммобилизованных дрожжевых клеток в пивоваренной промышленности. Прог. Biotechnol. 1996; 11: 661–71. [Google Scholar] 2. Флот GH.Дрожжи в пищевых продуктах и напитках влияют на качество и безопасность продуктов. Curr. Opin. Biotechnol. 2007; 18: 170–5. [PubMed] [Google Scholar] 3. Маккар Р.С., ДиНово А.А., Вестуотер К., Скофилд Д.А. Ферментно-опосредованная биоремедиация органофосфатов с использованием стабильных дрожжевых биокатализаторов. J. Bioremed. Биодег. 2013; 4: 2. [Google Scholar] 4. Дато Л., Брандуарди П., Пассолунги С., Каттанео Д., Рибольди Л., Фраскотти Г., Валли М., Порро Д. Достижения в области молекулярных инструментов для использования Zygosaccharomyces bailii в качестве хозяина для биотехнологического производства и создания первого ауксотрофного мутанта.FEMS Yeast Res. 2010; 10: 894–908. [PubMed] [Google Scholar] 5. Делнери Д. Технология штрих-кода в применении дрожжей в фармакогеномике. FEMS Yeast Res. 2010; 10: 1083–9. [PubMed] [Google Scholar] 6. Салари Р., Раджаби О, Хашьярманеш З., Фатхи Наджафи М., Фазлы Баззаз Б.С. Характеристика инкапсулированного берберина в дрожжевых клетках Saccharomyces cerevisiae. Iran J. Pharm. Res. 2015; 14: 1247–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Криворучко А., Сиверс В., Нильсен Дж. Возможности метаболической инженерии дрожжей: уроки синтетической биологии.Biotechnol. J. 2011; 6: 262–76. [PubMed] [Google Scholar] 8. де Йонг Б., Сиверс В., Нильсен Дж. Системная биология дрожжей. передовые технологии для развития клеточных фабрик по производству передового биотоплива. Curr. Opin. Biotechnol. 2012; 23: 624–30. [PubMed] [Google Scholar] 9. Феррейра И., Пиньо О., Виейра Э., Таварела Дж. Биомасса дрожжей Saccharomyces Брюера: характеристики и потенциальные области применения. Тенденции. Food Sci. Technol. 2010; 21: 77–84. [Google Scholar] 10. Чэ ХД, Джу Х, Ин М-Дж. Использование клеток пивных дрожжей для производства экстракта пищевых дрожжей. Часть 1: влияние различных ферментативных обработок на извлечение твердого вещества и белка, а также вкусовые характеристики.Биоресурсы. Technol. 2001; 76: 253–8. [PubMed] [Google Scholar] 11. Gaudreau H, Renard N, Champagne C, Horn DV. Оценка смесей дрожжевых и картофельных экстрактов в питательных средах для производства биомассы молочных культур. Может. J. Microbiol. 2002. 48: 626–34. [PubMed] [Google Scholar] 12. Чжан Дж., Редди Дж., Бакленд Б., Грешэм Р. К последовательной и продуктивной комплексной среде для промышленных исследований ферментации дрожжевого экстракта для процесса ферментации рекомбинантных дрожжей. Biotechnol. Bioeng. 2003. 82: 640–52.[PubMed] [Google Scholar] 13. Акопян Л., Габриелян Л., Трчунян А. Дрожжевой экстракт как эффективный источник азота, стимулирующий рост клеток и усиливающий фоторождение водорода штаммами Rhodobacter sphaeroides из минеральных источников. Int. J. Водородная энергия. 2012; 37: 6519–26. [Google Scholar] 14. Li X, Li Z, Zheng J, Shi Z, Li L. Дрожжевой экстракт способствует фазовому сдвигу ферментации биобутанола под действием Clostridium acetobutylicum ATCC824 с использованием маниока в качестве субстрата. Биоресурсы. Technol. 2012; 125: 43–51. [PubMed] [Google Scholar] 15.Кадо Х., Шибата Т., Кобаяши Ф., Кубота М. Процесс производства дрожжевого экстракта. Патент WO. 1998 1 998 046 089. [Google Scholar] 16. Ревильон Дж. П., Бранделли А., Аюб МАЗ. Производство дрожжевого экстракта из сыворотки с использованием Kluyveromyces marxianus. Braz. Arch. Биол. Technol. 2003. 46: 121–128. [Google Scholar] 17. Милич Т.В., Ракин М., Шилер-Маринкович С. Использование пекарских дрожжей (Saccharomyces cerevisiae) для производства дрожжевого экстракта: влияние различных ферментативных обработок на восстановление твердых веществ, белков и углеводов.J. Serb. Chem. Soc. 2007. 72: 451–7. [Google Scholar] 18. Хачия Т., Такашима Х., Танекава Т. Производство дрожжевого экстракта, содержащего ароматизатор. Патент США. 1981 г. 4 303 680 человек. [Google Scholar] 19. Potman RP, Wesdorp J. Способ приготовления дрожжевого экстракта, указанный дрожжевой экстракт, его использование в качестве пищевого ароматизатора и пищевая композиция, содержащая дрожжевой экстракт. Патент США. 1994 5 288 509. [Google Scholar] 20. York S, Ingram L. Производство этанола рекомбинантной Escherichia coli KO11 с использованием сырого дрожжевого автолизата в качестве питательной добавки.Biotechnol. Lett. 1996; 18: 683–8. [Google Scholar] 21. Lo Y-M, Yang S-T, Min DB. Влияние дрожжевого экстракта и глюкозы на продукцию ксантана и рост клеток в периодической культуре Xanthomonas campestris. Прил. Microbiol. Biotechnol. 1997; 47: 689–94. [Google Scholar] 22. Yamal G, Sharmila P, Rao K, Pardha-Saradhi P. Дрожжевой экстракт маннитоловой среды и ее составляющие способствуют синтезу наночастиц Au. Process Biochem. 2013; 48: 532–8. [Google Scholar] 23. Нурдам Б. Способ производства дрожжевых экстрактов с низкой мутностью.Патент США. 2013 год — 20130316.047. [Google Scholar] 24. Бабаян Т., Безруков М. Автолиз дрожжей. Acta Biotechnol. 1985. 5: 129–36. [Google Scholar] 25. Kanegae Y, Sugiyama Y, Minami K. Способ получения дрожжевого экстракта. Патент EP. 1993 0,249,435. [Google Scholar] 26. Ориган А, Сато Т. Производство дрожжевого экстракта. Патент EP. 1994 0,466,922. [Google Scholar] 27. Калум Л. Способ получения дрожжевого экстракта. Патент EP. 2009 2,097 510. [Google Scholar] 28. Hyoeky G, Sarkki M.-l, Tylli M. Метод производства дрожжевого экстракта, используемого в продуктах питания, из которого удалены нежелательные ароматизаторы в экстракте.Патент EP. 1998 0,871,374. [Google Scholar] 29. Конвей Дж, Годро Х, Шампанское CP. Влияние добавления протеаз и глюканаз во время автолиза дрожжей на производство и свойства дрожжевых экстрактов. Может. J. Microbiol. 2001; 47: 18–24. [PubMed] [Google Scholar] 30. Moench S, Stute R. Процесс производства дрожжевых экстрактов. Патент EP. 2002 1 199 353 человека. [Google Scholar] 31. Харада С., Ито Дж., Яно М., Аояги Ю., Маекава Х. Дрожжевой экстракт и способ его приготовления. Патент EP. 1989 0,299 078.[Google Scholar]| Как крупный международный издатель академических и исследовательских журналов Science Alert издает и разрабатывает названия в партнерстве с самыми престижные научные общества и издатели. Наша цель заключается в том, чтобы максимально широко использовать качественные исследования аудитория. | ||||||
| Мы прилагаем все усилия, чтобы поддержать исследователей которые публикуют в наших журналах.Есть масса информации здесь, чтобы помочь вам публиковаться вместе с нами, а также ценные услуги для авторов, которые уже публиковались у нас. | ||||||
| 2021 цены уже доступны. Ты может получить личную / институциональную подписку перечисленных журналы прямо из Science Alert. В качестве альтернативы вы возможно, пожелает связаться с выбранным вами агентством по подписке.Направляйте заказы, платежи и запросы в службу поддержки. в службу поддержки клиентов журнала в Science Alert. | ||||||
| Science Alert гордится своей тесные и прозрачные отношения с обществом. В виде некоммерческий издатель, мы стремимся к самому широкому возможное распространение публикуемых нами материалов и на предоставление услуг высочайшего качества нашим издательские партнеры. | ||||||
| Здесь вы найдете ответы на наиболее часто задаваемые вопросы (FAQ), которые мы получили по электронной почте или через контактную форму в Интернете. В зависимости от характера вопросов мы разделили часто задаваемые вопросы на разные категории. | ||||||
| Азиатский индекс научного цитирования (ASCI) стремится предоставить авторитетный, надежный и значимая информация по освещению наиболее важных и влиятельные журналы для удовлетворения потребностей мировых научное сообщество.База данных ASCI также предоставляет ссылку к полнотекстовым статьям до более чем 25000 записей с ссылка на цитированные ссылки. | ||||||
Ростовые характеристики морозостойких пекарских дрожжей Saccharomyces cerevisiae AFY в периодической аэробной культуре | SpringerPlus
Модель роста клеток в периодической аэробной культуре
На рисунке 1 показан пример изменений концентраций клеток, глюкозы и этанола в культуральном бульоне во время периодического аэробного культивирования дрожжевого AFY, когда в культуральной среде исходная концентрация глюкозы составляла 40 г / л.Подобно другим штаммам S. cerevisiae (Serio et al. 2001; Wills 1990; Jones and Kompala 1999), рост дрожжевого AFY демонстрировал диауксический характер: первая стадия роста потребляла глюкозу, а вторая стадия роста потребляла этанол. . На первой стадии роста глюкоза также превращалась в этанол посредством ферментативного метаболического пути. Однако дрожжи предпочтительно потребляли глюкозу, когда были доступны и глюкоза, и этанол, до тех пор, пока вся глюкоза не была израсходована полностью.Смена первой стадии роста на вторую стадию роста связана с переключением ферментативных реакций и синтезом новых ферментов (Woehrer and Roehr 1981). Когда концентрация глюкозы была ниже критического уровня, дрожжи могли использовать одновременно глюкозу и этанол, исходя из дыхательного узкого места (Dantigny 1995).
Рис.1Пример изменений концентраций клеток, глюкозы и этанола в культуральном бульоне во время аэробного периодического культивирования дрожжевого AFY (начальная концентрация глюкозы: 40.0 г / л)
На рис. 2 показаны изменения выхода клеток и этанола в зависимости от исходной концентрации глюкозы на первой стадии роста дрожжевого AFY. На рис.2 показан выход ячеек ( Y C1 ) и выход этанола ( Y E1 ) определяли как рост клеток и образование этанола на грамм потребления глюкозы, соответственно. Y C1 уменьшается с увеличением начальной концентрации глюкозы.Особенно быстро снижение было в диапазоне исходных концентраций глюкозы 1,0–5,0 г / л. С другой стороны, Y E1 изменился в противоположном направлении как Y C1 сделал. При исходной концентрации глюкозы 1,0 г / л Y C1 было 0,41 г / г, а Y E1 0,22 г / г. Когда исходная концентрация глюкозы увеличилась до 40.0 г / л, Y C1 снизился до 0,20 г / г, а Y E1 увеличен до 0,40 г / г. Подавление роста клеток (то есть эффект Крэбтри) происходило из-за подавления синтеза респираторных ферментов, инактивации респираторных ферментов и снижения активности транспорта глюкозы (Win et al. 1996; Serio et al. 2001).
Рис. 2Изменения выхода клеток и этанола при начальной концентрации глюкозы на первой стадии роста дрожжей AFY
На рисунке 3 показано изменение выхода ячеек ( Y C2 ) с исходной концентрацией этанола на второй стадии роста дрожжей AFY. Y C2 определяли как рост клеток на грамм потребления этанола. Y C2 постепенно снижается с увеличением начальной концентрации этанола. При исходной концентрации этанола 0,4 г / л Y C2 составлял 0,70 г / г. Когда исходная концентрация этанола увеличилась до 16,0 г / л, Y C2 уменьшился до 0.28 г / г. Уменьшение Y C2 был быстрым в диапазоне исходной концентрации этанола 0,4–1,3 г / л. Уменьшение Y C2 был вызван токсичностью этанола, включая ограничение путей метаболизма в клетках, снижение активности аденозинтрифосфатазы (АТФазы) в клеточной мембране, изменение соотношения фосфолипид / эргостерол в клеточной мембране и окислительное повреждение митохондрий. (Чжан и др.2015).
Рис. 3Изменение выхода клеток при начальной концентрации этанола на второй стадии роста дрожжей AFY
Кинетика роста клеток на глюкозном субстрате
На первой стадии роста дрожжевого AFY культуральная среда имела постоянную пропорцию питательных веществ и постоянные уровни DO и pH. Следовательно, глюкоза может рассматриваться как доминирующий субстрат, когда она присутствует в культуральной среде (Serio et al. 2001; Jones and Kompala 1999).Глюкоза использовалась для производства клеточного материала и продуктов метаболизма, а также для поддержания жизни клеток.
Уравнение Моно для роста клеток
На рисунке 4 показано соотношение между обратной величиной удельной скорости роста клеток ( мкм −1 C1 ) и величина, обратная концентрации глюкозы ( C −1 G1 ) при начальной концентрации глюкозы 40.{2} = 0,944) $$
(2)
Рис. 4Зависимость между величиной, обратной величине удельной скорости роста клеток и величиной, обратной величиной концентрации глюкозы (исходная концентрация глюкозы: 40,0 г / л; диапазон концентраций глюкозы: 2,5–30,0 г / л)
Используя уравнение. 2 было вычислено, что мкм C1, макс. = 0,99 ч -1 и K 1 = 10.80 г / л. Кроме того, скорость роста клеток на глюкозном субстрате может быть описана как:
$$ \ frac {{dC_ {C1}}} {dt} = \ mu_ {C1} C_ {C1} = \ frac {{0.99 \ times C_ {G1}}} {{10.80 + C_ {G1}}} \ times C_ {C1} $$
(3)
Следует отметить, что уравнения. 2 и 3 были эффективны в диапазоне концентраций глюкозы 2,5–30,0 г / л, где рост клеток происходил в экспоненциальной фазе.
Уравнение Людекинга – Пирета для образования этанола
На рисунке 5 показана взаимосвязь между удельной скоростью образования этанола ( мкм E1 ) и удельной скорости роста клеток ( мкм C1 ), когда исходная концентрация глюкозы была 40.0 г / л. Значения мкм E1 и мкм C1 были получены в C G1 диапазон 2,5–30,0 г / л (как на рис. {\ prime} \)) и удельной скоростью роста клеток ( μ C1 ), когда исходная концентрация глюкозы была 40.{2} = 0,936) $$
(6)
Используя уравнение. 6 было рассчитано, что ω G1 = 3,57 и η G1 = 0,31. Кроме того, скорость потребления глюкозы может быть описана как:
$$ \ frac {{dC_ {G1}}} {dt} = — \ mu_ {G1} ‘C_ {C1} = — (3.57 \ mu_ {C1} + 0,31) C_ {C1} $$
(7)
Сравнение расчетных значений и экспериментальных данных для субстрата глюкозы
В настоящем исследовании одновременные уравнения уравнения3 (уравнение Моно), уравнение. 5 (уравнение Людекинга – Пирета) и уравнение. 7 (уравнение псевдо-Людекинга – Пирета) были решены численно с использованием метода прямой разности (Shinozaki and Matsushita, 1976). Временной интервал в анализе прямой разницы был установлен на 15 мин. На рис. 7 рассчитанные значения сравниваются с экспериментальными данными для концентраций клеток, этанола и глюкозы в культуральной жидкости. Аэробное периодическое культивирование начинали с начальной концентрацией глюкозы 40,0 г / л, и концентрация глюкозы варьировалась в диапазоне 2.5–30,0 г / л. Расчетные значения согласуются с экспериментальными данными, указывая на то, что установленные выше системы уравнений хорошо описывают первую фазу экспоненциального роста дрожжевого AFY.
Рис. 7Сравнение расчетных значений и экспериментальных данных для концентраций клеток, этанола и глюкозы в культуральном бульоне (исходная концентрация глюкозы: 40,0 г / л; диапазон концентраций глюкозы: 2,5–30,0 г / л)
Кинетический анализ был также выполнен для аэробной периодической культуры дрожжей AFY с другими исходными концентрациями глюкозы.Было обнаружено, что совместные уравнения уравнения Моно, уравнения Людекинга – Пирета и уравнения псевдо-Людекинга – Пирета применимы к первой фазе экспоненциального роста, когда начальная концентрация глюкозы находилась в диапазоне 5,0–40,0 г / л. Значения кинетических параметров и соответствующие им диапазоны концентраций глюкозы для различных исходных концентраций глюкозы перечислены в таблице 2. В каждом соответствующем диапазоне концентраций глюкозы рост клеток следовал экспоненциальной фазе.Для исходной концентрации глюкозы 5,0, 10,0 и 40,0 г / л мкг C1, max составлял 0,52, 0,98 и 0,99 ч -1 , а K 1 составляла 0,58, 2,97 и 10,80 г / л соответственно. мкм C1, max не коррелировали с исходной концентрацией глюкозы. О кинетических особенностях также сообщалось ранее для периодической ферментации с перемешиванием иммобилизованных дрожжей S.cerevisiae ATCC 9763 (Birol et al. 1998).
Таблица 2 Значения кинетических параметров и соответствующие им диапазоны концентраций глюкозы для различных исходных концентраций глюкозы на первой стадииКинетика роста клеток на этанольном субстрате
На второй стадии роста дрожжевого AFY клетки продолжали расти на этанольном субстрате после того, как глюкоза была истощена (рис. 1). Если предположить, что в питательной среде помимо этанола было достаточно питательных веществ, этанол стал доминирующим субстратом, и процесс культивирования на этанольном субстрате можно было проанализировать кинетически так же, как и на глюкозном субстрате.
Уравнение Моно для роста клеток
На рисунке 8 показано соотношение между обратной величиной удельной скорости роста клеток ( мкм −1 C2 ) и обратная величина от концентрации этанола ( C -1 E2 ), когда исходная концентрация этанола составляла 16,00 г / л. В концентрации этанола ( C E2 ) диапазон 0.1–2,6 г / л, мк −1 C2 линейно возрастает с увеличением C −1 E2 , и их взаимосвязь может быть выражена следующим уравнением Моно (преобразование) (Birol et al. 1998; Manikandan et al. 2008):
Рис. скорость роста клеток и величина, обратная концентрации этанола (начальная концентрация этанола: 16.{2} = 0,977) $$(8)
Используя уравнение. 8 было вычислено, что мкм C2, макс. = 0,07 ч -1 и K 2 = 1,34 г / л. Кроме того, скорость роста клеток может быть описана как:
$$ \ frac {{dC_ {C2}}} {dt} = \ mu_ {C2} C_ {C2} = \ frac {{0,07 \ times C_ {E2} }} {{1.34 + C_ {E2}}} C_ {C2} $$
(9)
Следует отметить, что уравнение.{\ prime} C_ {C2} = — (1,13 \ mu_ {C2} + 0,02) C_ {C2} $$
(11)
Сравнение расчетных значений и экспериментальных данных для субстрата этанола
Системные уравнения уравнения. 9 (уравнение Моно) и уравнение. 11 (уравнение псевдо-Люедекинга – Пирета) были решены численно с использованием метода прямой разности (Shinozaki and Matsushita, 1976). Временной интервал в анализе прямой разницы также был установлен на 15 мин, как и в разделе «Сравнение расчетных значений и экспериментальных данных для этанольного субстрата».На рис. 10 рассчитанные значения сравниваются с экспериментальными данными для концентраций клеток и этанола в культуральной жидкости. Аэробное периодическое культивирование начинали с начальной концентрацией этанола 16,0 г / л, и концентрация этанола варьировалась в диапазоне 0,1–2,6 г / л. Расчетные значения согласуются с экспериментальными данными, указывая на то, что установленные выше системы уравнений хорошо описывают вторую фазу экспоненциального роста дрожжевого AFY.
Рис.10Сравнение расчетных значений и экспериментальных данных для концентраций клеток и этанола в культуральном бульоне (исходная концентрация этанола: 16.0 г / л; диапазон концентрации этанола: 0,1–2,6 г / л)
Совместные уравнения уравнения Моно и уравнения псевдо-Людекинга – Пирета также могут быть использованы для описания второй фазы экспоненциального роста с другими начальными концентрациями этанола. Значения кинетических параметров и соответствующие им диапазоны концентраций этанола для различных исходных концентраций этанола перечислены в таблице 3. Исходная концентрация этанола 1,3, 3,0 и 16,0 г / л была получена в результате аэробной периодической культуры с начальной концентрацией глюкозы 5.0, 10,0 и 40,0 г / л (как показано в таблице 2) соответственно. Для исходной концентрации этанола 1,3, 3,0 и 16,0 г / л мкг C2, max составлял 0,11, 0,06 и 0,07 ч -1 , а K 2 составлял 0,47, 0,67 и 1,34 г / л соответственно. По сравнению с μ C1, макс (0,52, 0,98, 0,99 ч -1 ), мкм C2, макс. (0.11, 0,06, 0,07 ч −1 ) было значительно ниже. Снижение удельной скорости роста клеток во второй фазе роста было связано с метаболическими различиями глюкозы и этанола (Wills, 1990), а также изменениями концентраций питательных веществ и клеток в культуральном бульоне и т. Д. Эти результаты показали, что эффективность дрожжей производство может быть улучшено за счет сокращения производства этанола на первом этапе роста. Для этой цели обычно применяется периодическая культура с подпиткой с ограничением подачи глюкозы.
Таблица 3 Значения кинетических параметров и соответствующие им диапазоны концентраций этанола для различных исходных концентраций этанола на второй стадииСледует отметить, что значения максимальной удельной скорости роста (μ C, max ) и константы насыщения субстрата (K) варьируются в зависимости от метаболизма дрожжевых клеток, на который влияют штамм дрожжей, история роста, состояние культуры и т. Д. .Эти два параметра взаимосвязаны. Когда значение параметра изменяется, значение другого параметра также изменяется (Birol et al. 1998; Wang 2004; Kostov et al. 2012). Кроме того, могут быть получены другие значения для мкм C, max и K при использовании разных кинетических моделей (Костов и др., 2012). Следовательно, значения параметров, полученные для хлебопекарных дрожжей S. cerevisiae AFY в настоящем исследовании, действительны только для процессов в аналогичных условиях.
Запрещенное содержание
В соответствии с нашей Политикой конфиденциальности, мы хотим, чтобы вы знали, что мы делаем с предоставленной вами информацией. при создании учетной записи My CABI.
Мы собираем ваше имя, адрес электронной почты, институциональную принадлежность и учетные данные для входа. Мы используем эту информацию чтобы предоставить вам доступ к услуге My CABI, предоставить вам техническую поддержку или поддержку по продукту, а также обеспечить надежную работу службы.
Мы также можем использовать информацию о подключении цифрового отпечатка, такую как ваш IP-адрес и другие технические идентификаторы, для сбора данных об использовании, данных о потоках кликов и информации о страницах, которые вы посещали и искали, для анализа использование с целью расширения и улучшения нашего сервиса.
Мы хотели бы время от времени связываться с вами по электронной почте, чтобы узнать, как мы можем улучшить Мой CABI, например, добавление или изменение его функциональности, новых функций и содержимого.
Кроме того, мы также хотели бы сообщить вам о специальных предложениях, акциях, опросах и другой информации. связанных с продуктами и услугами CABI.
Вы можете удалить свою учетную запись My CABI со страницы своего профиля, и в этом случае вся ваша информация будет быть удалены с наших серверов.
Вы можете прочитать нашу полную Политику конфиденциальности здесь https://www.cabi.org/privacy-policy/.
Вы должны принять Политику конфиденциальности, чтобы продолжить
Ферментация сахаров с использованием дрожжей: новый эксперимент | Chem13 News Magazine
Введение
Ферментный катализ 1 — важная тема, которой часто пренебрегают на вводных курсах химии.В этой статье мы представляем простой эксперимент, включающий ферментацию сахаров, катализируемую дрожжами. Эксперимент прост в проведении, не требует дорогостоящего оборудования и подходит для вводных курсов химии.
Сахара, используемые в этом исследовании, включают сахарозу и лактозу (дисахариды), а также глюкозу, фруктозу и галактозу (моносахариды). Лактозу, глюкозу и фруктозу были приобретены в магазине по продаже диетических продуктов, а галактозу — в компании Carolina Science Supply Company. Сахароза была приобретена в продуктовом магазине в виде белого сахара.Вопрос, на который мы хотели ответить, звучал так: «Все ли сахара подвергаются дрожжевому брожению с одинаковой скоростью?»
Ферментация сахара приводит к образованию этанола и диоксида углерода. В случае сахарозы реакция ферментации:
\ [C_ {12} H_ {22} O_ {11} (водн.) + H_2 O \ overset {дрожжи \: ферменты} {\ longrightarrow} 4C_ {2} H_ {5} OH (водн.) + 4CO_ {2} (g) \]
Лактоза также представляет собой C 12 H 22 O 11 , но атомы расположены по-другому. Прежде чем дисахариды сахароза и лактоза смогут подвергнуться ферментации, они должны быть расщеплены на моносахариды с помощью реакции гидролиза, показанной ниже:
\ [C_ {12} H_ {22} O_ {11} + H_ {2} O \ longrightarrow 2C_ {6} H_ {12} O_ {6} \]
Гидролиз сахарозы приводит к образованию глюкозы и фруктозы, тогда как лактоза производит глюкозу и галактозу.
сахароза + вода \ (\ longrightarrow \) глюкоза + фруктоза
лактоза + вода \ (\ longrightarrow \) глюкоза + галактоза
Ферменты сахароза и лактаза способны катализировать гидролиз сахарозы и лактозы соответственно.
Все моносахариды глюкоза, фруктоза и галактоза имеют молекулярную формулу C 6 H 12 O 6 и ферментируются следующим образом:
\ [C_ {6} H_ {12} O_ {6} (водн.) \ Overset {дрожжевые ферменты} {\ longrightarrow} 2C_ {2} H_ {5} OH (водн.) + 2CO_ {2} (г) \]
Эксперимент
В наших экспериментах 20.0 г сахара растворяли в 100 мл водопроводной воды. Затем к раствору добавляли 7,0 г дрожжей Red Star ® Quick-Rise и смесь нагревали в микроволновой печи в течение 15 секунд на полной мощности, чтобы полностью активировать дрожжи. (Мощность микроволн составляет 1,65 кВт.) Это привело к температуре около 110 o F (43 o C), что находится в рекомендуемом диапазоне температур для активации. Крышка была ослаблена, чтобы дать возможность улетучиться диоксиду углерода. Массу реакционной смеси измеряли как функцию времени.Реакционную смесь поддерживали при температуре окружающей среды, и попытки регулирования температуры не предпринимались. Каждая упаковка дрожжей Red Star Quick-Rise Yeast имеет массу 7,0 г, поэтому это количество было выбрано для удобства. Могли быть использованы пекарские дрожжи других марок.
Об этом методе изучения химических реакций сообщили Lugemwa и Duffy et al. 2,3 Для измерений мы использовали весы с точностью до 0,1 г. Хотя ферментация — анаэробный процесс, для проведения этих экспериментов не нужно исключать кислород.Лактоза и галактоза растворяются медленно. Мягкий нагрев с использованием микроволновой печи значительно ускоряет процесс. При использовании этих сахаров дайте растворам сахара остыть до комнатной температуры, прежде чем добавлять дрожжи и ставить в микроволновую печь еще на 15 секунд.
Скорость ферментации сахарозы, одной лактозы и лактозы с лактазой
На рис. 1 показаны графики зависимости потери массы от времени для сахарозы, одной лактозы и лактозы с таблеткой лактазы к диетической добавке, добавленной за 1,5 часа до начала эксперимента.Все образцы содержали 20,0 г соответствующего сахара и 7,0 г дрожжей Red Star Quick-Rise. Первоначально потеря массы регистрировалась каждые 30 минут. Мы продолжали снимать показания до тех пор, пока масса не выровнялась, что составляло около 600 минут. Если кто-то хочет ускорить реакцию, можно использовать большее количество дрожжей. Результаты показывают, что, хотя сахароза легко теряет массу и, следовательно, ферментирует, лактоза — нет. Очевидно, что ферменты дрожжей не могут вызвать брожение лактозы. Однако, когда присутствует лактаза, происходит значительное брожение.Лактаза заставляет лактозу расщепляться на глюкозу и галактозу. Сравнение кривой ферментации сахарозы с кривой лактазы, содержащей лактазу, показывает, что изначально они оба ферментируют с одинаковой скоростью.
Рис. 1. Сравнение массы высвобожденного CO 2 в зависимости от времени для ферментации сахарозы, одной лактозы и лактозы с таблеткой лактазы. Каждый образец весом 20,0 г растворяли в 100 мл водопроводной воды, а затем добавляли 7,0 г дрожжей Red Star Quick-Rise.
Однако, когда реакции завершаются, смесь лактозы, лактазы и дрожжей выделяет лишь примерно половину CO 2 , чем смесь сахарозы и дрожжей.Это говорит о том, что один из двух сахаров, образующихся при гидролизе лактозы, не подвергается дрожжевой ферментации. Чтобы проверить это, мы сравнили скорость ферментации глюкозы и галактозы с использованием дрожжей и обнаружили, что в присутствии дрожжей глюкоза легко подвергается ферментации, в то время как в галактозе ферментация не происходит.
Рис. 2. Сравнение массы высвобожденного CO 2 в зависимости от времени для ферментации сахарозы, глюкозы и фруктозы.Каждую пробу 20 г сахара растворяли в 100 мл воды, а затем добавляли 7,0 г дрожжей.
Скорость ферментации сахарозы, глюкозы и фруктозы
Затем мы решили сравнить скорость ферментации сахарозы с глюкозой и фруктозой, двумя соединениями, составляющими сахарозу. Мы предположили, что дисахарид будет ферментировать медленнее, потому что сначала он должен подвергнуться гидролизу. Фактически, однако, рис. 2 показывает, что три сахара выделяют CO 2 примерно с одинаковой скоростью.Наша гипотеза была ошибочной. Хотя есть некоторое расхождение трех кривых в более длительные периоды времени, кривая сахарозы всегда так же высока, как кривые глюкозы и фруктозы, или выше. Наблюдение за тем, что общее количество CO 2 , высвобождаемое в конце, не является одинаковым для трех сахаров, может быть связано с тем, что чистота образцов фруктозы и глюкозы не такая высокая, как у сахарозы.
Скорость ферментации и концентрация сахара
Затем мы решили исследовать, как скорость ферментации зависит от концентрации сахара.На рис. 3 показаны кривые дрожжевого брожения для 10,0 г и 20,0 г глюкозы. Видно, что начальная скорость потери массы CO 2 одинакова для образцов 10,0 и 20,0 г. Конечно, общее количество CO 2 , выделяемое образцом 20,0 г, в два раза больше, чем ожидаемое количество образца 10,0 г. Позже мы повторили этот эксперимент, используя сахарозу вместо глюкозы, и получили тот же результат.
Рис. 3. Сравнение массы высвобожденного CO 2 в зависимости от времени ферментации 20.0 г глюкозы и 10,0 г глюкозы. Каждый образец сахара растворяли в 100 мл воды, а затем добавляли 7,0 г дрожжей.
Скорость ферментации и концентрация дрожжей
Убедившись, что скорость ферментации дрожжей не зависит от концентрации сахара в условиях наших экспериментов, мы решили посмотреть, зависит ли она от концентрации дрожжей. Мы взяли два образца глюкозы по 20,0 г и добавили 7,0 г дрожжей к одному и 3,5 г к другому. Результаты представлены на рис.4. Четко видно, что скорость высвобождения CO 2 действительно зависит от концентрации дрожжей. Наклон образца с 7,0 г дрожжей примерно в два раза больше, чем с 3,5 г дрожжей. Мы повторили эксперимент с сахарозой и фруктозой вместо глюкозы и получили аналогичные результаты.
Рис. 4. Сравнение массы высвобожденного CO 2 в зависимости от времени ферментации двух образцов глюкозы по 20,0 г, растворенных в 100 мл воды. У одного было 7.0 г дрожжей, а другой — 3,5 г дрожжей.
Обсуждение
В ретроспективе наблюдение, что скорость ферментации зависит от концентрации дрожжей, но не зависит от концентрации сахара, неудивительно. Насыщенность ферментами можно объяснить студентам очень просто. Молекула, такая как глюкоза, довольно мала по сравнению с типичным ферментом. Ферменты — это белки с большой молярной массой, обычно превышающей 100000 г / моль. 1 Очевидно, что в реакционной смеси гораздо больше молекул глюкозы, чем молекул фермента.Большое молекулярное соотношение сахара и фермента ясно означает, что каждый сайт фермента занят молекулой сахара. Таким образом, удвоение или уменьшение вдвое концентрации сахара не может существенно повлиять на начальную скорость реакции. С другой стороны, удвоение концентрации фермента должно удвоить скорость реакции, поскольку вы удваиваете количество ферментных сайтов.
Описанные здесь эксперименты просты в выполнении и требуют только весов с точностью до 0,1 г и таймера.Результаты этих экспериментов могут обсуждаться на различных уровнях сложности и согласуются с кинетикой ферментов, описанной в модели Михаэлиса-Ментен. 1 Эксперименты можно расширить, чтобы изучить влияние температуры на скорость реакции. Для таких ферментативных реакций реакция не происходит, если температура слишком высока, потому что ферменты денатурируются. Также можно исследовать влияние pH и концентрации соли.
Список литературы
- Джереми М.Берг, Джон Л. Тимочко и Люберт Страйер, Biochemistry , 6-е издание, W.H. Фримен и компания, 2007, страницы 205-237.
- Fugentius Lugemwa, Разложение перекиси водорода, Chemical Educator , апрель 2013 г., страницы 85-87.
- Дэниел К. Даффи, Стефани А. Шоу, Уильям Д. Бэр, Кеннет А. Голдсби, Больше химии в бутылке с газировкой, Сохранение массовой активности, Журнал химического образования , август 1995, страницы 734-736.
- Джессика Л. Эпштейн, Мэтью Виейра, Бинод Арьял, Николас Вера и Мелисса Солис, Разработка биотоплива в учебной лаборатории: этанол из различных источников, Журнал химического образования , апрель 2010 г., страницы 708–710.
Простой и быстрый протокол получения дрожжевого экстракта из Saccharomyces cerevisiae, пригодный для приготовления бактериальной культуральной среды.
Иранский журнал фармацевтических исследований (2016), 15 (4): 907-913 Получено: принято:Авторские права © 2016 Фармацевтическая школа им. Шахида Бехешти, Университет медицинских наук и служб здравоохранения
Первоначальная статья
Простой и быстрый протокол для Получение дрожжевого экстракта из Saccharomyces cerevisiae, подходящего для приготовления среды для бактериальных культур Омид Зарейя, b, c, Сиавуш Дастмалчия, d и Марьям Хамзех-Мивехруда, d * Биотехнологический исследовательский центр, Тебризский университет медицинских наук, Тебриз, Иран.Кафедра фармацевтической биотехнологии, фармацевтический факультет, Тебризский университет медицинских наук, Тебриз, Иран. cКомитет по исследованиям студентов, Тебризский университет медицинских наук, Тебриз, Иран. d Кафедра медицинской химии фармацевтического факультета Тебризского университета медицинских наук, Тебриз, Иран. a
b
Abstract Дрожжи, особенно Saccharomyces cerevisiae, являются одними из древнейших организмов с широким спектром применения благодаря своей уникальной генетике и физиологии.Дрожжевой экстракт, то есть продукт дрожжевых клеток, широко используется в качестве питательного ресурса в питательных средах для бактерий. Целью этого исследования было разработать простой, быстрый и рентабельный процесс производства дрожжевого экстракта. В этой процедуре для получения дрожжевого экстракта использовались механические методы, такие как высокая температура и давление. Рост бактерий, питаемых полученным дрожжевым экстрактом, контролировали, чтобы оценить качество продукта. Результаты показали, что качество полученного дрожжевого экстракта было очень многообещающим, сделанное на основании модели роста бактериальных клеток в средах, приготовленных из этого продукта, и было сопоставимо с качеством трех коммерческих дрожжевых экстрактов с точки зрения свойств роста бактерий.Одним из основных преимуществ нынешнего метода было то, что не использовались химические вещества и ферменты, что привело к снижению стоимости производства. Этот метод очень прост и рентабелен, и его можно реализовать в разумные сроки, что делает его пригодным для использования в исследовательских лабораториях. Кроме того, его можно масштабировать для производства больших партий для промышленного применения. Ключевые слова: пекарские дрожжи; Экстракт дрожжей; Рост бактерий; Saccharomyces cerevisiae.
Введение Дрожжи — важные эукариотические микроорганизмы, принадлежащие к царству грибов.С исторической точки зрения, они использовались для самых разных целей с тысячи лет назад, таких как ферментация, выпечка и биоремедиация (1-3), а также широкий спектр исследовательской деятельности в биологических науках благодаря своей уникальной генетике и физиологии. (4-8). Кроме того, питательная клетка * Автор, ответственный за переписку: E-mail: [email protected]; [email protected]
Содержимоедрожжей, известное как «дрожжевой экстракт», также используется для многих важных целей. Дрожжевой экстракт — это обработанный дрожжевой продукт, который содержит растворимые компоненты дрожжевых клеток и широко используется в пищевой промышленности в качестве пищевого ароматизатора, добавок и витаминных добавок, а также в качестве источника питания для бактериальных питательных сред, используемых в микробиологии и биотехнологии (9-10).Более того, важность использования дрожжевого экстракта в промышленной ферментации для производства микробной биомассы или продуктов доказана многочисленными исследованиями (1114). Для производства дрожжевого экстракта использовались различные виды дрожжей, особенно Saccharomyces cerevisiae (известные как дрожжи Baker’s
Zarei O et al. / IJPR (2016), 15 (4): 907-913
) (15-17). Дрожжевой экстракт получают с использованием различных методов, в том числе основанных на методах автолиза и гидролиза. Целью различных методов является разрушение клеточной стенки дрожжей (для высвобождения содержимого клеток) и восстановление растворимой фракции.В зависимости от цели производства процедура получения дрожжевого экстракта различается. Например, если целью производства дрожжевого экстракта является его использование в пищевой или косметической промышленности, требуется несколько этапов для получения дрожжевого экстракта пищевого / косметического качества. Эти этапы включают множество физических, химических и ферментативных методов разрушения клеточной стенки дрожжей, за которыми следуют несколько дополнительных этапов, таких как фильтрация, хроматография или другие методы разделения для удаления нерастворимых материалов с целью получения продукта без запаха, вкуса и цвета (18-19 ).Хотя качество дрожжевого экстракта улучшается путем применения этих дополнительных процедур, но большинство из этих этапов очень трудоемки, отнимают много времени, дороги и несущественны, если целью производства является использование дрожжевого экстракта для микробиологических исследований в качестве одного из основных компонентов бактериального среды для культивирования клеток. Независимо от наличия множества коммерческих дрожжевых экстрактов для приготовления питательной среды для микробов, простой метод приготовления высококачественного дрожжевого экстракта будет очень полезным.Принимая во внимание важность и широкий спектр применения дрожжевого экстракта в среде микробной ферментации, нашей целью в текущем исследовании было разработать простой, быстрый и рентабельный процесс производства дрожжевого экстракта, применимый в различных лабораториях, чтобы соответствовать требованиям экспериментальные потребности, а также возможность использования в промышленности в качестве важного компонента среды для микробной ферментации в больших количествах.
То же условие для удаления нерастворимого содержимого клеток. Выделенный супернатант, содержащий растворимый компонент, повторно автоклавировали и снова охлаждали, как описано выше.Полученный водорастворимый экстракт хранили при –20 ° C до приготовления дрожжевого экстракта в виде порошка. Затем растворимую фракцию подвергали мини-распылительной сушилке (B-290, Büchi Labortechnik AG, Flawil, Швейцария) для получения порошкообразной формы дрожжевого экстракта. Оценка роста бактериальных клеток Рост бактерий, питаемых полученным дрожжевым экстрактом, контролировали для оценки качества продукта. С этой целью были приготовлены различные бактериальные культуральные среды либо в твердой, либо в жидкой форме.В первом подходе мы использовали только дрожжевой экстракт в качестве единственного источника питательных веществ в среде для культивирования бактериальных клеток. Для этой цели твердую и жидкую среду готовили по следующему протоколу: для твердой среды смесь 8 г полученного порошка дрожжевого экстракта и 15 г агара (Merck, Дармштадт, Германия) растворяли в 1 л деионизированной воды и автоклавировали (121 ° C). C, 15 фунтов) в течение 15 мин с последующим распределением по 8-сантиметровым стерильным пластиковым чашкам. В качестве среды отрицательного контроля также была приготовлена аналогичная твердая среда без порошка дрожжевого экстракта.Для жидкой среды 20 г полученного порошка дрожжевого экстракта растворяли в конечном объеме 1 л деионизированной воды и автоклавировали, как указано выше. Охлажденная среда разливалась по стерильным пробиркам. Также была приготовлена аналогичная среда для отрицательного контроля (т.е. среда без дрожжевого экстракта). Бактерии, использованные для культивирования в приготовленных средах, представляли собой E. coli (DH5α) и Staphylococcus aureus (PTCC 1112) как грамотрицательные и грамположительные бактерии соответственно. Для твердых сред бактерии наносили штрихами на планшет и инкубировали в течение ночи при 37 ° C.В случае жидких сред свежую ночную культуру бактерий разводили в среде 1: 100 и инкубировали при 37 ° C при встряхивании со скоростью 180 об / мин. В разные интервалы времени (например, 2, 4, 8, 16, 24 и 48 ч) образцы были взяты в стерильных условиях для мониторинга роста бактерий в подготовленных средах путем считывания оптических плотностей (OD) образцов при 600 нм с использованием УФ-излучения. спектрофотометр (Ultrospec 2000, Amersham Pharmacia Biotech). Каждые
Материалы и методы. Приготовление дрожжевого экстракта. Водную суспензию дрожжевых клеток получали добавлением 500 г пекарских дрожжей (Saccharomyces cerevisiae) к 2 л деионизированной воды (вода milli-Q).Приготовленную суспензию автоклавировали при 115 ° C в течение 10 мин с последующим быстрым охлаждением на льду. Затем клеточный дебрис отделяли центрифугированием при 400 g при 4 ° C в течение 10 мин. Супернатант повторно центрифугировали при 908
. Простой и быстрый протокол для получения дрожжевого экстракта
эксперимент проводили в трех повторностях. В качестве дополнительного подхода к оценке рост бактерий отслеживали в бульонной среде Лурия Бертани (обычно используемой в микробиологии среде), приготовленной с использованием дрожжевого экстракта, полученного в этом исследовании, и экстрактов, полученных от коммерческих поставщиков.Бульонную среду LB готовили следующим образом: 5 г порошка дрожжевого экстракта, 10 г триптона (HiMedia, Кат. №: RM014) и 5 г NaCl (Scharlau, Кат. №: SO0225) растворяли в 1 л деионизированной воды с последующим растворением. автоклавирование и розлив в стерильные пробирки. Чтобы сравнить профиль роста бактериальных клеток в среде, приготовленной из дрожжевого экстракта, полученного нами, с аналогичными коммерческими продуктами дрожжевого экстракта, три разных дрожжевых экстракта от известных компаний, а именно Sigma (каталожный номер: 92144-F), Merck ( Кот.№: 1.03753) и Applichem (№ по каталогу: A3732). Готовили среду, содержащую все ингредиенты, за исключением дрожжевого экстракта, и использовали ее в качестве среды отрицательного контроля. Все процедуры, связанные с культивированием бактерий и мониторингом роста бактериальных клеток, проводили, как описано выше.
автоклавирование и центрифугирование для получения растворимой фракции. Эти шаги (центрифугирование и автоклавирование) были повторены еще раз для полного удаления остатков клеток. Супернатант наносили на распылительную сушилку для получения порошкообразного дрожжевого экстракта.Оценка роста бактериальных клеток в твердой и жидкой средах. E. coli DH5α и Staphylococcus aureus, как представители грамотрицательных и грамположительных типов бактерий, соответственно, использовались для систематического определения роста бактерий как в твердой, так и в жидкой среде, приготовленной с помощью полученного продукта. Экстракт дрожжей. Результат показал, что обе бактерии могут расти в твердой среде, содержащей полученный дрожжевой экстракт в качестве единственного источника питательной поддержки. Рисунки 1а. и 1b. показать колонии E.coli DH5α и золотистый стафилококк соответственно. Колоний для контрольных сред для обеих бактерий не наблюдалось (рисунки 1c и 1d). Рисунки 2а. и 2b. продемонстрировать скорость роста E. coli DH5α и Staphylococcus aureus в жидкой бульонной среде, состоящей из полученного дрожжевого экстракта в качестве единственного источника энергии, соответственно. Графики показывают, что дрожжевой экстракт, полученный в этой работе, имеет достаточно высокое качество, чтобы использовать его в качестве единственного источника питания для роста бактериальных клеток. Качество полученного дрожжевого экстракта также оценивали как один из компонентов среды бульона LB и сравнивали с тремя коммерческими дрожжевыми экстрактами.Результаты показали, что оба типа бактерий были способны расти в среде LB, приготовленной из полученного дрожжевого экстракта, сравнимой с таковой в среде LB, приготовленной с использованием трех коммерческих дрожжевых экстрактов (Фигуры 3a и 4a). Статистический анализ показал, что нет значительных различий между темпами роста обоих типов бактерий в бульонной среде LB, приготовленной с использованием нашего дрожжевого экстракта и трех коммерческих продуктов. Сравнение скорости роста бактерий в среде LB, приготовленной с использованием полученного дрожжевого экстракта, со скоростью роста в контрольной среде, лишенной какого-либо дрожжевого экстракта, выявило значительную разницу для обоих типов бактерий.
